芽孢杆菌产胞外酶的活性分析及其对凡纳滨对虾的作用❋
游 龙, 韩 茵, 张 凯, 祁自忠❋ ❋
(1.中国海洋大学海洋生命学院应用微生物技术实验室,山东 青岛 266003; 2.青岛贝宝海洋科技有限公司,山东 青岛 266400)
在若干抗生素替代品中,益生菌是最有潜力的一种,被广泛应用于水产养殖业[1]。益生菌的推广应用解决了抗生素及其他药物滥用所带来的问题,并能够通过提高水生动物的生产性能和控制疾病等途径提高水产品的产量,从而创造更好的经济效益[2]。水产养殖领域,应用最多的益生菌是乳酸菌、芽孢杆菌和双歧杆菌[3-4]。芽孢杆菌在缺乏营养或遇不良环境时能够形成内生孢子,对干燥、高温、高压、氧化等不良环境具有很强的抵抗力[5],具有易于保存,使用方便等特点,因此具有较大的推广和应用价值。
益生菌的作用机理之一是能产生有益的代谢产物,如乳酸菌可产生挥发性脂肪酸和乳酸,芽孢杆菌可产生脂肽类代谢产物如表面活性素、伊枯草菌素等,可以有效抑制致病菌生长;某些益生菌也能产生多种酶类,参与动物的消化作用,促进营养物质的消化吸收[6-7],芽孢杆菌就是其中之一。芽孢杆菌进入动物消化道后能够迅速定植并分泌高活性的蛋白酶、脂肪酶和淀粉酶,这些消化酶作用于植物性饲料中复杂的大分子物质,如蛋白质、脂类和碳水化合物等,将其降解成易于吸收利用的小分子物质,改善饲料的适口性,促进营养物质的消化和吸收,进而促进水生动物的生长[8]。至今为止,中国外对益生芽孢杆菌提高水生动物消化酶活力、促进水生动物的生长,提高鱼虾类的存活率作过不少研究[9]。丁贤等[10]的研究亦显示水生动物的生长与消化酶活性之间存在一定的正向作用关系,即消化酶活性在一定程度上反映出机体对饲料养分的消化利用程度。因此,具有较高消化酶活性的芽孢杆菌可能对水生动物的生长具有更好的促进作用。
一些研究表明芽孢杆菌作为益生菌能够改善动物体内的微环境,提高水生动物的消化性能和免疫性能,进而促进其生长,提高水生动物的存活率[1]。华雪铭等[9]将芽孢杆菌按照不同浓度添加到饲料中,投喂异育银鲫,实验异育银鲫的生长具有显著提高,实验异育银鲫对嗜水气单胞菌的抵抗力显著增强。丁贤等[10]在饲料中添加芽孢杆菌制剂,发现实验组凡纳滨对虾的蛋白酶、脂肪酶、纤维素酶较对照组显著提高,对虾成活率和增重率均优于对照组。虽然,芽孢杆菌的益生效果已在大量的研究中体现,但对于芽孢杆菌所产生的胞外酶与水生动物消化道内酶活性的关系仍需要进一步研究。
本研究探讨了液体发酵单株芽孢杆菌(解淀粉芽孢杆菌YL-10、枯草芽孢杆菌YL-09、地衣芽孢杆菌ge6-1和巨大芽孢杆菌H1)和多株混合芽孢杆菌(Tm1、Tm2、Tm3、Tm4和Tm5)的产酶情况,根据消化酶活性的高低和静置期消化酶的稳定性,选取解淀粉芽孢杆菌YL-10和多株混合芽孢杆菌Tm3添加到对虾饲料中饲喂凡纳滨对虾,研究单株芽孢杆和多株混合芽孢杆菌对凡纳滨对虾生长、消化酶活性和肝胰腺中胞外酶组成的影响,为芽孢杆菌制剂作为益生菌在水产养殖中的合理应用提供依据。
1 材料与方法
1.1 菌种
巨大芽孢杆菌(B.megateriumH1):分离自山东蓬莱健康养殖的仿刺参(ApostichopusjaponicusSelenka)肠道;枯草芽孢杆菌(B.subtilisYL-09)、地衣芽孢杆菌(B.licheniformisge6-1)、解淀粉芽孢杆菌(B.amyloliquefaciensYL-10):分离自山东胶南龙湾近海沉积物。
1.2 培养基
(1)胰蛋白胨大豆肉汤培养基(TSB)用于菌株活化培养。
(2)发酵培养基以TSB为基础培养基,以麦麸替代90%的蛋白胨和葡萄糖含量。
1.3 芽孢杆菌酶学性质研究
1.3.1 粗酶液的制备 用TSB培养基活化菌株YL-10、YL-09、H1和ge6-1,将培养物按1%接种于发酵培养基,32 ℃、160 r/m培养24 h,取发酵液6 000g离心10 min,吸取上清液即为单株芽孢杆菌粗酶液(分别标注为YL-10、YL-09、ge6-1和H1)。在培养24 h后的单株芽孢杆菌培养液中分别选取任意3株按1∶1∶1(Tm1:YL-10+H1+ge6-1;Tm2:YL-10+H1+YL-09;Tm3:YL-10+YL-09+ge6-1;Tm4:YL-09+H1+ge6-1)比例混合,以及四株按1∶1∶1∶1(Tm5:YL-10+H1+ge6-1+YL-09)的比例混合,室温放置2 h后,6 000g离心10 min,吸取上清液即为多株混合芽孢杆菌粗酶液。
1.3.2 消化酶活性测定方法 蛋白酶活性采用Folin-酚法[11]测定:在pH为7.5的条件下,37 ℃水浴反应10 min,酶液1 min水解干酪素产生1.0 μg酪氨酸作为1个酶活性单位(U);
淀粉酶活性采用3,5-二硝基水杨酸显色法(DNS法)[12]测定:在pH为5.6,温度为40 ℃的条件下,酶液1 min催化淀粉生成1.0 μg麦芽糖作为1个酶活性单位(U);
脂肪酶活性采用以聚乙烯醇橄榄油为底物的标准氢氧化钠溶液滴定法[13]测定:在pH为7.5,温度为40 ℃的条件下,酶液1 min水解底物产生1.0 μmol的可滴定的脂肪酸,即为1个酶活性单位(U)。
1.3.3 芽孢杆菌胞外酶产生情况测定 采用API zym系统对单株芽孢杆菌发酵液(YL-10、YL-09、H1和ge6-1)和多株混合芽孢杆菌发酵液(Tm1、Tm2、Tm3、Tm4和Tm5)中胞外酶产生情况进行半定量测定。测定过程分别吸取单株与多株混合芽孢杆菌粗酶液65 μL,加到试剂条小室中,并将试剂条放入湿盒,于每个API zym酶学测试板边缘标记菌株名称,37 ℃放置4 h。培养结束后,于每个小室中分别滴加一滴ZYM-A试剂和一滴ZYM-B试剂,反应5 min后,强光下照射10 s,根据显色进行结果的判定,并记录实验结果,作为筛选芽孢杆菌进行凡纳滨对虾养殖实验的依据。
1.4 凡纳滨对虾养殖实验
1.4.1 实验菌株 单株芽孢杆菌:解淀粉芽孢杆菌YL-10,由于YL-10具有最高的蛋白酶和淀粉酶活性,脂肪酶活性也仅低于ge6-1,选取该芽孢杆菌进行凡纳滨对虾实验。
多株混合芽孢杆菌:根据多株混合芽孢杆菌在静置期的消化酶活性(结果另见),选取最高的Tm3组(解淀粉芽孢杆菌YL-10,枯草芽孢杆菌YL-09,地衣芽孢杆菌ge6-1)进行凡纳滨对虾实验。
1.4.2 实验对虾 实验凡纳滨对虾来自青岛贝宝海洋科技有限公司,平均初始体重为(0.005±0.001)g,体色正常,健康活泼,共270只。实验前先暂养7d,每日换水1次,投饵4次。
1.4.3 实验饲料 对照组饲料:宁波天邦公司生产的“虾好养”对虾配合饲料,粗蛋白含量42.5%,脂肪含量为5%。
实验组饲料:(1)YL-10菌株活化后接种于发酵培养基中,37 ℃培养24 h,将菌液添加到对虾配合饲料中,制成YL-10菌株含量为108CFU/g的对虾饲料。(2)菌株YL-10、YL-09和ge6-1活化后接种于发酵培养基中37 ℃培养24 h,培养完成后将菌液等量混匀,添加到对虾配合饲料中,制成多株混合芽孢杆菌Tm3(YL-10+YL-09+ge6-1)含量为108CFU/g的对虾饲料。室温晾干后4 ℃保存备用。
1.4.4 养殖实验 实验设3个处理组:YL-10组:投喂添加解淀粉芽孢杆菌YL-10的对虾饲料;Tm3组:投喂添加多株混合芽孢杆菌Tm3的对虾饲料;对照组:只投喂对虾配合饲料。每组各设3个平行,每个平行30尾对虾。实验期间,每日投饵4次,每日吸污、换水,实验持续42 d。根据对虾摄食情况调节投喂量,水温26~32℃,盐度(30±1),pH=8.0±0.2,连续充气。
1.4.5 指标测定
1.4.5.1 生长指标 生长性能指标的计算公式如下:
体重增加(Weight gain,WG)=末均重-初均重;
特定生长率(Special growth rate,SGR)=(ln末均重-ln初均重)/饲养天数×100%;
存活率(Survival rate,SR)=试验结束对虾尾数/试验开始对虾尾数×100%。
1.4.5.2 对虾肝胰腺中消化酶活性测定 于实验的第42天,随机选取规格相近的各平行组对虾,每个组5只,冰浴解剖取出肝胰腺,去离子水冲洗后用滤纸吸干,迅速称重,置于玻璃匀浆器中,准确加入9倍体积生理盐水,冰浴匀浆,匀浆液用生理盐水稀释10倍,配制成1%的匀浆稀释液,冷冻离心10 min(4 ℃,6 000g),取上清液测定消化酶活性。
蛋白质含量采用试剂盒(购自南京建成生物研究所)测定;
蛋白酶活性采用Folin-酚法[11]测定;
淀粉酶活性采用3,5-二硝基水杨酸显色法(DNS法)[12]测定;
脂肪酶活性采用以聚乙烯醇橄榄油为底物的标准氢氧化钠溶液滴定法[13]测定。
1.4.5.3 对虾肝胰腺中胞外酶测定 于实验结束第42天,冰浴解剖取出各平行组对虾肝胰腺,称重,冰浴匀浆,配制成10%的肝胰腺匀浆液,分别取65 μL的匀浆液于API zym试剂条小室中,放入湿盒,于每个API zym酶学测试板边缘标记菌株,37 ℃培养4 h,培养完成后于每个小室中分别滴加一滴ZYM-A试剂和一滴ZYM-B试剂,反应5 min,在强光下照射10 s,根据显色进行结果的判定并记录实验结果。
1.5 数据统计分析
实验数据采用平均值±标准差表示,采用SPSS11.5软件进行数据分析和统计,先对数据作单因素方差分析,若处理间差异显著,再用Duncan’s分析进行多重比较,显著性水平为0.05。
2 结果
2.1 芽孢杆菌消化酶活性测定
四株芽孢杆菌(YL-10、YL-09、H1和ge6-1)在发酵培养基中培养24 h后,测定发酵液中消化酶(蛋白酶、脂肪酶和淀粉酶)活性,结果如图1所示。四株芽孢杆菌均能产生蛋白酶、脂肪酶和淀粉酶,但四株芽孢杆菌产生消化酶的能力各不相同。其中,YL-10具有最高的蛋白酶活性和淀粉酶活性,分别为335和3.0 U/mL;ge6-1具有最高的脂肪酶活性,为5.0 U/mL。测定多株混合芽孢杆菌发酵液中消化酶活性,结果显示:多株混合芽孢杆菌Tm1、Tm2、Tm3和Tm5发酵液中蛋白酶活性与淀粉酶活性均高于单株芽孢杆菌H1和ge6-1;多株混合芽孢杆菌Tm1具有最高的蛋白酶活性和脂肪酶活性,Tm5具有最高的淀粉酶活性。

图1 芽孢杆菌培养物中消化酶活性测定Fig.1 Protease activity, lipase activity and amylase activity of single and mixed Bacillus cultures
2.2 芽孢杆菌发酵液中胞外酶产生情况
单株芽孢杆菌和多株混合芽孢杆菌发酵液中胞外酶的组成如表1所示。酶谱显示:单株芽孢杆菌(YL-10,YL-09,H1和ge6-1)发酵液中均能检测到酯酶(C4)、类脂酯酶(C8)和萘酚-AS-BI-磷酸水解酶。仅H1发酵液中能检测到β-葡萄糖醛酸酶,仅YL-10发酵液中能检测到β-葡萄糖苷酶,仅YL-09发酵液中能检测到α-甘露糖苷酶。单株芽孢杆菌YL-10、YL-09和H1发酵液中能检测到6种胞外酶,ge6-1发酵液中能检测到7种胞外酶。
多株混合芽孢杆菌发酵液中均能检测到碱性磷酸酶、酯酶(C4)、类脂酯酶(C8)、亮氨酸芳胺酶、酸性磷酸酶、萘酚-AS-BI-磷酸水解酶和α-葡萄糖苷酶,其中Tm1、Tm4和Tm5培养液中能检测到β-葡萄糖醛酸酶。多株混合芽孢杆菌Tm1、Tm4和Tm5发酵液中均能检测到8种胞外酶,Tm2和Tm3发酵液中能检测到7种胞外酶。

表1 API zym系统测定单株芽孢杆菌和多株混合芽孢杆菌胞外酶产生情况半定量结果Table 1 Extracellular enzymatic activity of single and mixed Bacillus cultures
注:1.各芽孢杆菌培养物均不产生:类脂酶(C14)、缬氨酸芳胺酶、胱氨酸芳胺酶、胰岛素、胰凝乳蛋白酶、α-半乳糖苷酶、β-半乳糖苷酶、N-乙酰葡萄糖胺酶和β-岩藻糖苷酶。2.YL-09:枯草芽孢杆菌;ge6-1:地衣芽孢杆菌;H1:巨大芽孢杆菌;YL-10:解淀粉芽孢杆菌;Tm1:解淀粉芽孢杆菌+巨大芽孢杆菌+地衣芽孢杆菌;Tm2:解淀粉芽孢杆菌+枯草芽孢杆菌+巨大芽孢杆菌;Tm3:解淀粉芽孢杆菌+枯草芽孢杆菌+地衣芽孢杆菌;Tm4:枯草芽孢杆菌+巨大芽孢杆菌+地衣芽孢杆菌;Tm5:解淀粉芽孢杆菌+巨大芽孢杆菌+地衣芽孢杆菌+枯草芽孢杆菌。3.阴性反应:0;阳性反应:1~5。
Note:1.Negative results were obtained with:Lipase(C14),Valine arylamidase,α-chymotrypsin,Cystine arylamidase,Trypsin,α-galactosidase,β-glucuronidase,N-acetyl-β-glucosaminidase and α-fucosidase.2.YL-09=B.subtilis;ge6-1=B.licheniformis;H1=B.megaterium;YL-10=B.amyloliquefaciens;Tm1=B.amyloliquefaciens+B.megaterium+B.licheniformis;Tm2=B.amyloliquefaciens+B.subtilis+B.megaterium;Tm3=B.amyloliquefaciens+B.subtilis+B.licheniformis;Tm4=B.subtilis+B.megaterium+B.licheniformis;Tm5=B.amyloliquefaciens+B.subtilis+B.licheniformis+B.megaterium.3.0=negative reaction;1~5=positive reaction.
2.3 单株芽孢杆菌YL-10和多株混合芽孢杆菌Tm3对凡纳滨对虾生长的影响
饲料中添加芽孢杆菌YL-10和Tm3对凡纳滨对虾生长的影响如表2所示。与对照组相比,测得实验组YL-10与实验组Tm3对虾的体重增加、特定生长率和存活率均有显著提高(P<0.05)。实验组YL-10和实验组Tm3对虾体重增加、特定生长率和存活率无明显差别(P>0.05)。实验组Tm3对虾具有最高的成活率,为(91.1±1.9)%,较对照组提高了10.8%。

表2 添加单株芽孢杆菌YL-10与多株混合芽孢杆菌Tm3对凡纳滨对虾生长和存活率的影响Table 2 Growth performance and survival of L.vannamei fed with single and mixed Bacillus cultures, YL-10 and Tm3
注:上标字母不相同表示差异显著(P<0.05)。
Note: Values(means±SE)in the same column with different superscripts are significantly different (P<0.05).
2.4 单株芽孢杆菌YL-10和多株混合芽孢杆菌Tm3发酵液对凡纳滨对虾肝胰腺消化酶活性的影响
由图2可知,实验组YL-10和实验组Tm3对虾肝胰腺中蛋白酶活性较对照组分别提高了11.2%和20.7%;实验组Tm3对虾蛋白酶活性较对照组有显著提高(P<0.05),实验组Tm3与实验组YL-10之间蛋白酶活性无明显差别(P>0.05)。实验组Tm3对虾肝胰腺中脂肪酶活性较对照组显著提高(P<0.05),而实验组YL-10肝胰腺中脂肪酶活性显著低于对照组(P<0.05)。实验组YL-10具有最高的淀粉酶活性,较对照组淀粉酶活性提高了44.1%,实验组Tm3淀粉酶活性较对照组提高了29.4%。
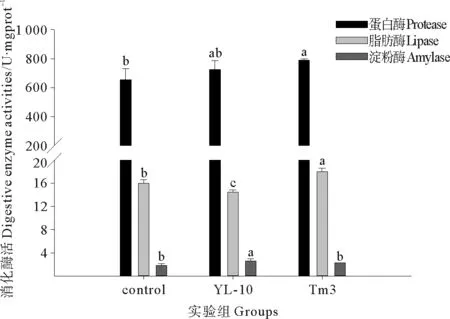
图2 添加单株芽孢杆菌YL-10与多株混合芽孢杆菌Tm3对凡纳滨对虾消化酶的影响Fig.2 Protease activity,lipase activity and amylase activity of L.vannamei fed with control diet,YL-10(B.amyloliquefaciens YL-10)and Tm3(B.amyloliquefaciens+B.subtilis+B.licheniformis)
2.5 芽孢杆菌对凡纳滨对虾肝胰腺胞外酶活性的影响
实验组(YL-10和Tm3)和对照组对虾肝胰腺中胞外酶组成如表3所示,实验组和对照组对虾肝胰腺中均检测到碱性磷酸酶、酯酶(C4)、类脂酶(C8)、亮氨酸芳胺酶、缬氨酸芳胺酶、胰岛素、酸性磷酸酶、萘酚-AS-BI-磷酸水解酶、α-半乳糖苷酶、β-半乳糖苷酶、β-葡萄糖醛酸酶、α-葡萄糖苷酶、β-葡萄糖苷酶、N-乙酰葡萄糖胺酶、α-甘露糖苷酶和α-岩藻糖苷酶(16种)。实验组YL-10对虾肝胰腺中类脂酶(C8)、亮氨酸芳胺酶、缬氨酸芳胺酶、胰岛素、萘酚-AS-BI-磷酸水解酶、β-半乳糖苷酶、α-葡萄糖苷酶、β-葡萄糖苷酶、α-甘露糖苷酶和α-岩藻糖苷酶(10种)的活性高于对照组,实验组Tm3对虾肝胰腺中类脂酶(C8)、亮氨酸芳胺酶、缬氨酸芳胺酶、胰岛素、萘酚-AS-BI-磷酸水解酶、α-半乳糖苷酶、β-半乳糖苷酶、β-葡萄糖醛酸酶、α-葡萄糖苷酶、β-葡萄糖苷酶、α-甘露糖苷酶和α-岩藻糖苷酶(12种)的活性高于对照组。其中,Tm3具有最高的亮氨酸芳胺酶、缬氨酸芳胺酶、萘酚-AS-BI-磷酸水解酶、α-半乳糖苷酶和β-葡萄糖醛酸酶活性;YL-10具有最高的类脂酶(C8)、酸性磷酸酶和α-岩藻糖苷酶活性。
3 讨论
芽孢杆菌(Bacillus)能够产生内生孢子,抗逆性强,能耐高温高压,易于储存,是一种具有发展前景的益生菌[5]。芽孢杆菌在生长繁殖的同时能够分泌产生包括蛋白酶、淀粉酶和脂肪酶在内的多种胞外酶,能有效分解大分子营养物质,促进养殖动物的消化吸收[8],这是芽孢杆菌作为益生菌的益生机理之一。因此,选取具有较高消化酶活性的芽孢杆菌应用于对虾养殖,能够更好地促进对虾的生长。然而,不同芽孢杆菌菌株之间所产生的胞外酶的种类和活性具有较大差异。陶容霞[14]研究了17株芽孢杆菌产酶特性,结果显示,17株芽孢杆菌的消化酶活性各不相同,其中,脂肪酶产生能力差异尤其显著。唐丽江等[15]测定了10株芽孢杆菌淀粉酶产生能力,测得菌株Pab03具有最高的淀粉酶活力,为(31.331±0.985)U,而同是芽孢杆菌的菌株PSAF1淀粉酶活力仅为(0.366±0.022) U。本实验分别测定四株单株芽孢杆菌(YL-10、YL-09、ge6-1和H1)和五种多株混合芽孢杆菌(Tm1、Tm2、Tm3、Tm4和Tm5)发酵液中的消化酶活性,结果表明:YL-10具有最高的蛋白酶和淀粉酶活性,ge6-1具有最高的脂肪酶活性;与单株芽孢杆菌ge6-1和H1相比,多株混合芽孢杆菌Tm1、Tm2、Tm3和Tm5具有更高的蛋白酶和淀粉酶活性。在益生菌的实际应用中,混合微生物制剂相较于单一微生物制剂具有更好的稳定性,作为饲料添加剂应用于水产养殖业取得了更好的效果[2]。王彦波等[16]的研究显示混合益生菌(包含等量的凝结芽孢杆菌、枯草芽孢杆菌、地衣芽孢杆菌、乳酸乳球菌、嗜酸乳杆菌和屎肠球菌,活菌总数为1×109CFU/g)能够显著促进凡纳滨对虾的生长和肠道消化酶产生。Zokaeifar等[17]将混合芽孢杆菌BM5和BM8添加到饲料中饲喂凡纳滨对虾也取得了相似的实验结果。因此,本实验选取具有较高消化酶活性的单株芽孢杆菌YL-10和具有最好稳定性的多株混合芽孢杆菌Tm3进行对虾养殖实验以研究芽孢杆菌对凡纳滨对虾生长、消化酶活性和消化道胞外酶组成的影响。

表3 添加单株芽孢杆菌YL-10与多株混合芽孢杆菌发酵液Tm3对凡纳滨对虾肝胰腺胞外酶活性的影响Table 3 Enzyme analysis of L.vannamei fed with single Bacillus culture(YL-10)and mixed Bacillus culture(Tm3)by using API zym Kit /U·mL-1
注:1.各组对虾消化道内均未检测到:类脂酶(C14)、胱氨酸芳胺酶和胰凝乳蛋白酶。2.阴性反应:0;阳性反应:1~5。
Note:1.Negative results were obtained with:Lipase(C14),Cystine arylamidase and α-chymotrypsin.2.0=negative reaction;1~5=positive reaction.
实验采用API zym系统测定单株芽孢杆菌发酵液和多株混合芽孢杆菌发酵液中胞外酶的产生情况,以进一步研究芽孢杆菌的产酶特性。胞外酶谱显示单株芽孢杆菌胞外酶产生存在一定的同源性,四株芽孢杆菌均能产生酯酶(C4)、类脂酯酶(C8)和萘酚-AS-BI-磷酸水解酶,且酶活性相差不大(半定量数值为2或3),这与Pane等[18]采用API zym系统测定的五株芽孢杆菌胞外酶产生情况所得到的实验结果一致。胞外酶谱亦显示四株芽孢杆菌胞外酶产生存在一定的差别,如只在芽孢杆菌H1发酵液中检测到β-葡萄糖醛酸酶,仅在YL-10发酵液中检测到β-葡萄糖苷酶。比较单株芽孢杆菌与多株混合芽孢杆菌发酵液中胞外酶的组成,发现多株混合芽孢杆菌发酵液中胞外酶的种类要高于单株芽孢杆菌。表明通过将不同芽孢杆菌发酵液混合,发酵液中各芽孢杆菌菌株产生的胞外酶互补,使得多株混合芽孢杆菌发酵液中能检测到更多种类的胞外酶和更为稳定的胞外酶产生。
将单株芽孢杆菌YL-10和多株混合芽孢杆菌Tm3发酵液添加到饲料中饲喂凡纳滨对虾,实验结果显示实验组对虾的体重增加和特殊生长率较对照组具有显著提高,表明芽孢杆菌能够提高对虾的生长性能。这与Wang YB[19]和丁贤等[10]的研究结果一致。芽孢杆菌的促生长作用可能是由于芽孢杆菌进入对虾消化道后,在消化道内增殖过程中能够合成分泌消化酶,这些消化酶可以弥补对虾内源酶分泌量的不足,间接提高对虾消化道内消化酶的活性,即两种不同来源的酶物质的协同作用引起宿主肠道内消化酶活性的叠加效应,而消化酶是对虾消化能力的体现,能够参与营养物质的消化利用[20],提高饲料的利用率,进而促进对虾的生长。本实验中,养殖对虾的生长与消化道内消化酶活性呈现较强的相关性;实验组Tm3对虾肝胰腺中蛋白酶活性与脂肪酶活性较对照组显著提高,实验组YL-10淀粉酶活性较对照组显著提高。Ziaei-Nejad等[21],Moriarty等[22]和丁贤等[10]的研究也取得了相似的实验结果。另一方面,芽孢杆菌作为活菌进入对虾体内,能够代谢产生对虾生长所需的营养物质如菌体蛋白、维生素和微量元素等,参与调节营养成分在对虾消化道内的代谢过程,从而促进对虾生长[10,20]。本实验中测定的是加入芽孢杆菌后对虾肝胰腺内消化酶酶活,对于芽孢杆菌分泌产生的消化酶的贡献率以及通过免疫刺激等作用机制所产生的消化酶活性变化,还需要进一步研究。实验组YL-10和实验组Tm3对虾存活率较对照组均显著提高,Zokaeifar等[17]用芽孢杆菌投喂凡纳滨对虾也取得了相似的结果,其可能的免疫刺激作用表现为消化道内超氧化物歧化酶和溶菌酶等免疫酶的活力的提高。
为了进一步研究芽孢杆菌对凡纳滨对虾胞外酶产生情况的影响,实验采用API zym系统测定对虾肝胰腺内胞外酶的产生情况。实验组和对照组对虾消化道内均能够检测到相同的16种胞外酶。其中,实验组YL-10对虾肝胰腺中有10种胞外酶活性高于对照组,而实验组Tm3对虾肝胰腺中有12种胞外酶活性高于对照组。因此,添加芽孢杆菌能够提高凡纳滨对虾肝胰腺胞外酶的活性,并且多株混合芽孢杆菌对于凡纳滨对虾肝胰腺胞外酶的活性提高好于单株芽孢杆菌。研究结果为混合芽孢杆菌的应用提供了基础数据。
[1] 郭小华, 赵志丹. 饲用益生芽孢杆菌的应用及其作用机理的研究进展[J]. 中国畜牧兽医, 2010, 37(2): 27-31.
Guo X H, Zhao Z D. Research progress on the application and mechanisms ofBacilli-derivedprobiotics [J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(2): 27-31.
[2] 高权新, 施兆鸿, 彭士明. 益生菌在水产养殖中的研究进展[J]. 海洋渔业, 2013, 35(3): 364-372.
Gao Q X, Shi Z H, Peng S M. Probiotics in aquaculture: Recent progress and outlook [J]. Marine Fisheries, 2013, 35(3): 364-372.
[3] Lee H S, Gilliland S E, Carter S. Amylolytic cultures ofLactobacillusacidophilus: Potential probiotics to improve dietary starch utilization [J]. Journal of Food Science, 2001, 66(2): 338-344.
[4] Guo X, Li D, Lu W, et al. Screening ofBacillusstrains as potential probiotics and subsequent confirmation of the in vivo effectiveness ofBacillussubtilisMA139 in pigs [J]. Antonie Van Leeuwenhoek, 2006, 90(2): 139-146.
[5] 刘君, 宋晓玲, 陈志鑫. 益生菌对水产动物的作用研究进展[J]. 动物医学进展, 2009, 30(9): 78-81.
Liu J, Song X L, Chen Z X. Progress on the function of probiotics in aquaculture [J]. Progress in Veterinary Medicine, 2009, 30(9): 78-81.
[6] Balcazar J L, Blas I, Ruiz-Zarzuela I et al. The role of probiotics in aquaculture [J]. Veterinary Microbiology, 2006, 114: 173-186.
[7] Verschuere L, Rombaut G, Sorgeloos P et al. Probiotic bacteria as biological control agents in aquaculture [J]. Microbiology and Molecular Biology Reviews, 2000, 64(4): 655-671.
[8] 惠明, 窦丽娜, 田青, 等. 枯草芽孢杆菌的应用研究进展[J]. 安徽农业科学, 2008, 36(27): 11623-11624, 11627.
Hui M, Dou L N, Tian Q et al. Advances in application research ofBacillussubtilis[J]. Journal of Anhui Agri. Sci., 2008, 36(27): 11623-11624, 11627.
[9] 华雪铭, 周洪琪, 邱小琮, 等. 饲料中添加芽孢杆菌和硒酵母对异育银鲫的生长及抗病力的影响[J]. 水产学报, 2001, 25(5): 448-453.
Hua X M, Zhou H Q, Qui X Z et al. Effects of dietaryBacillussp. and selenoyeast on the growth and disease resistance of allogynogenetic crucian carp [J]. Journal of Fishes of China, 2001, 25(5): 448-453.
[10] 丁贤, 李卓佳, 陈永青, 等. 芽孢杆菌对凡纳滨对虾生长和消化酶活性的影响[J]. 中国水产科学, 2004, 11(6): 580-584.
Ding X, Li Z J, Chen Y Q et al. Effects of probiotics on growth and activities of digestive enzymes ofPennausvannamei[J]. Journal of Fishes of China, 2004, 11(6): 580-584.
[11] Anson M L. The estimation of Pepsin, Trypsin, Papain and Cathepsin with hemoglobin [J]. Journal of General Physiology, 1938, 22: 79-89.
[12] Fuwa H. Phosphorylase and Q-enzyme in developing maize kernels [J]. Archives of Biochemistry and Biophysics, 1957, 70: 157-168.
[13] Ota Y, Gomi K, Cato S et al. Purification and some properties of cell-bound lipase fromSaccharomycopsislipolytica[J]. Agricultural and Biological Chemistry, 1982, 46: 2885-2893.
[14] 陶荣霞. 17株芽孢杆菌产酶特性及益生特性的研究[D]. 武汉: 华中农业大学, 2012.
Tao R X. Study on Characteristics of Enzyme Production and Probiotics by 17BacillusStrain [D]. Wuhan: Huazhong Agricultural University, 2012.
[15] 唐丽江, 王振华, 王迪. 高产淀粉酶芽孢杆菌菌株的筛选[J]. 安徽农业科学, 2009, 37(12): 5362-5363, 5371.
Tang L J, Wang Z H, Wang D. Research on the screening ofBacillusStrain producing high-yielding amylase [J]. Journal of Anhui Agricultural Sciences. 2009, 37(12): 5362-5363, 5371.
[16] 王彦波, 傅玲琳. 益生菌对凡纳滨对虾生长性能和消化酶活性的影响[J]. 饲料工业, 2010, 31(20): 12-14.
Wang Y B, Fu L L. Effect of probiotics on growth performance and digestive enzyme activity of the shrimp,Litopenaeusvannamei[J]. Feed Industry, 2010, 31(20): 12-14.
[17] Zokaeifar H, Balcazar J L, Saad C R, et al. Effects ofBacillussubtilison the growth performance, digestive enzymes, immune gene expression and disease resistance of white shrimp,Litopenaeusvannamei[J]. Fish & Shellfish Immunol, 2012, 33(4): 683-689.
[18] Pane C, Villecco D, Campanile F, et al. Novel strains ofBacillus, isolated from compost and compost-amended soils, as biological control agents against soil-bornephytopathogenic fungi [J]. Biocontrol Science and Technology, 2012, 22(12): 1373-1388.
[19] Wang Y B. Effect of probiotics on growth performance and digestive enzyme activity of the shrimpPenaeusvannamei[J]. Aquaculture, 2007, 269: 259-264.
[20] 朱学芝, 郑石轩, 潘庆军, 等. 微生态制剂对凡纳滨对虾生长及水质的影响[J]. 中山大学学报, 2008, 47: 58-62.
Zhu X Z, Zheng S X, Pan Q J et al. Effect of probiotics on growth performance and water quality forLitopenaeusvannamei[J]. ACTA Scientiarum Naturalium Universitatis Sunyatseni, 2008, 47: 58-62.
[21] Ziaei-Nejad S, Rezaei M H, Takami G A. The effect ofBacillusspp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimpFenneropenaeusindicus[J]. Aquaculture, 2006, 252: 516-524.
[22] Moriarty D J W. Control of luminousVibriospecies in penaeid aquaculture ponds [J]. Aquaculture, 1998, 164: 351-358.

