4月龄大菱鲆苗种耐氨氮性状的遗传参数评估❋
李之乡, 王伟继, 胡玉龙, 吕 丁, 吴欢欢, 栾 生, 孔 杰❋ ❋
(1.上海海洋大学水产与生命学院,上海 201306; 2.中国水产科学研究院黄海水产研究所,农业部海洋渔业资源可持续利用重点开放实验室,山东 青岛 266071; 3.青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071)
大菱鲆(Scophthalmusmaximus)具有生长快、营养丰富、肉质细嫩等优点,是欧洲重要的名贵海水养殖品种之一[1]。1992年由黄海水产研究所引入我国,并于1999年成功攻克人工育苗技术难关,随后成为我国北方地区工厂化养殖的主导品种之一,并开创了“温室大棚+深井海水”的养殖模式。根据国家鲆鲽类产业技术体系综合实验站调查,2015年我国大菱鲆产量为4.78万t,占鲆鲽类总产量的79.56%[2]。
随着大菱鲆养殖产业的进一步深入,“温室大棚+深井海水”的流水式工厂化养殖模式因不利于养殖生态的可持续发展而逐渐受到限制。其养殖模式逐渐向半封闭式工厂化养殖模式过渡,最后将发展为全封闭式工厂化循环水养殖模式[3]。封闭式循环水养殖模式相比于传统的养殖模式,具有非常明显的节水、环保和高产等优势,被认为是21世纪发展水产养殖业的主流方向[2]。
然而目前我国的封闭式工厂化循环水养殖尚在起步阶段,配套设备不完善[4]。在循环水养殖过程中,养殖密度高,随着养殖时间的延长,鱼类的残饵、排泄物等含氮有机物会逐渐积累并在微生物的作用下分解产生氨氮。氨氮是制约鱼类生长的重要环境因子之一,高浓度的氨氮不仅能够限制鱼体的生长,并且能够导致多重疾病的发生[5-6]。另外,循环水处理的生物滤池中使用的硝化细菌和亚硝化细菌的最适温度为23~30℃,而大菱鲆的最适养殖温度为16~18℃,这使得水处理过程中的去氮效果大打折扣,极易造成大菱鲆养殖循环水中的氨氮含量超标。因此,对大菱鲆进行遗传改良,选育耐氨氮能力更强的新品种非常有必要。
育种的核心是选择,选择育种在水产动物的遗传改良中应用非常广泛[7]。而评估选育性状的遗传参数是制定育种方案、开展选育工作的基础。遗传力和遗传相关是两个非常重要的遗传参数,对选育和育种工作具有非常重要的指导作用。动物模型BLUP法是有效评估动物数量性状遗传参数,显著提高遗传进展速度的一种常用方法。应用该方法对水产动物进行遗传改良,国内外已有很多研究。在大菱鲆[8-9]、中国对虾(Fenneropenaeuschinensis)[10]、罗氏沼虾(Macrobrachiumrosenbergii)[11]、凡纳滨对虾(Litopenaeusvannamei)[12]、俄罗斯鲟(Acipensergueldenstaedti)[13]等水产动物中均已应用该方法开展数量性状遗传参数的评估工作,并已取得显著成果,增加了经济产值。
本研究同样采用一般动物模型,利用限制性极大似然法(Restricted Maximum Likelihood, REML)并基于混合线性模型方程组(Mixed Model Equations, MME)[14]对40个大菱鲆家系954尾大菱鲆的耐氨氮性状、体长和体重的表型方差组分进行剖分,评估4月龄大菱鲆耐氨氮性状、体长和体重的遗传参数,以期为大菱鲆耐氨氮品系的选育以及耐氨氮的分子机制研究提供一定的理论参考。
1 材料和方法
1.1 实验材料
实验的开展地点在山东海阳黄海水产有限公司。在2006和2007年构建培育大菱鲆G0代家系,通过后裔测定,以收获时的体重值为育种目标,在2009—2012年构建了G1代群体,2013和2014年构建G2代群体,2016年采用2011、2012和2013年培育的亲鱼构建了G2代和G3代家系。本实验材料来自2016年构建的G2代和G3代家系群体,选取构建时间在一个月之内的40个家系(其中包含27个母系半同胞家系),共计954尾大菱鲆。每个家系分别培养在0.5 m3的玻璃钢(Fiber Reinforced Plastics, FRP)容器中,家系培养过程中严格采用环境条件标准化和数量标准化培育方法[15-16]。当实验鱼达到100日龄左右时,对其进行可视嵌入性荧光标记(Visible Implant Elastomer, VIE),用来识别个体的家系。标记完成后将实验鱼混养一个月,开展耐氨氮性状测试实验。
1.2 实验设计
实验在2个半径为1.2 m,高0.7 m的玻璃钢缸中进行,用其中一个提前配置所需氨氮浓度的海水,另一个用于进行耐氨氮性状测试实验。氨氮浓度为39.06 mg/L,非离子氨为1.80 mg/L(正式试验前一周得出的72 h半致死浓度),所需氨氮浓度用NH4Cl分析纯配制而得。实验前停食3天,实验过程中不投饵,溶解氧维持在5.0~7.0 mg/L。实验用水为砂滤海水,水温维持在(22.5±1)℃,pH为8.0~8.1,盐度30,每天换水量为100%。每2h观察一次,及时打捞死鱼,记录死亡时间、体长、体重、家系编号等数据。
1.3 数据处理
1.3.1 数据统计 使用Excel 2013软件对4月龄大菱鲆的耐氨氮存活时间、体长、体重及家系数量等描述性统计参数进行前期整理和初步分析。用SPSS 19.0对不同家系个体的3个性状进行方差分析。
1.3.2 建立混合模型 采用氨氮胁迫下的存活时间作为大菱鲆耐氨氮性状的表型观测值,存活时间越长,表示耐氨氮能力越强。用G0到G3代物理系谱估计个体之间的亲缘关系,使用R软件中的ASReml包[17-18]计算遗传力和遗传相关。根据实验数据结构,构建不同模型进行比较,最后确定一个最优模型。在计算体长和体重遗传力时,将日龄作为协变量;在计算耐氨氮性状遗传力时,采用体长作为协变量。构建的单性状动物模型如下:
Yij=μ+b×Daysi+ai+fj+eij;
Yij=μ+b×Bli+ai+fj+eij。
式中:Yij表示性状观测值;μ表示总体均值;b为回归系数;Daysi为日龄协变量;Bli为体长协变量;ai为加性遗传效应;fj为共同环境效应;eij为随机残差。
在耐氨氮性状、体长和体重的遗传相关和表型相关分析中,同样采用上述的两性状动物模型,将日龄作为协变量。
1.3.3 遗传参数的评估 遗传力的计算公式为:
式中:σa2表示加性遗传效应方差;σp2表示表型方差。
两性状相关性计算公式:
式中:σ11和σ22分别表示性状1和性状2的加性遗传方差或表型方差;σ12表示两性状的加性遗传协方差或表型协方差。
Z-score用来检验遗传力估计值与0之间是否存在显著差异。其公式为:
式中:xi和xj分别是性状的遗传力和遗传相关估计值;σi和σj分别是相应的遗传力和遗传相关的标准误。当检验遗传参数是否与0有显著性差异时,xj和σj均定义为0。如果︱Z︱≥1.96,遗传参数估计值与0存在显著差异(P<0.05);如果︱Z︱≥2.58,遗传参数估计值与0存在极显著差异(P<0.01)。
2 实验结果
2.1 大菱鲆表型性状的描述性统计
4月龄大菱鲆耐氨氮存活时间、体长和体重的描述性统计数据见表1。存活时间、体长和体重的平均值分别为99.05 h、7.04 cm和10.07 g。体重的变异系数最大,为38.27%;存活时间和体长的变异系数相对较小,分别为14.48%和14.47%。统计分析表明,体长和体重在不同的家系之间差异极显著(P<0.01)。

表1 大菱鲆耐氨氮存活时间、体长和体重的描述性统计Table 1 The descriptive statistics of survival time to ammonia-resistant, body length, body weight to turbot
图1显示,4月龄大菱鲆在实验氨氮浓度胁迫下4 h左右即有个体开始死亡,80 h左右死亡数量逐渐增多,并且随着氨氮胁迫时间的延长,累计死亡率逐渐升高直至所有个体全部死亡。整个死亡过程大约持续了128 h。
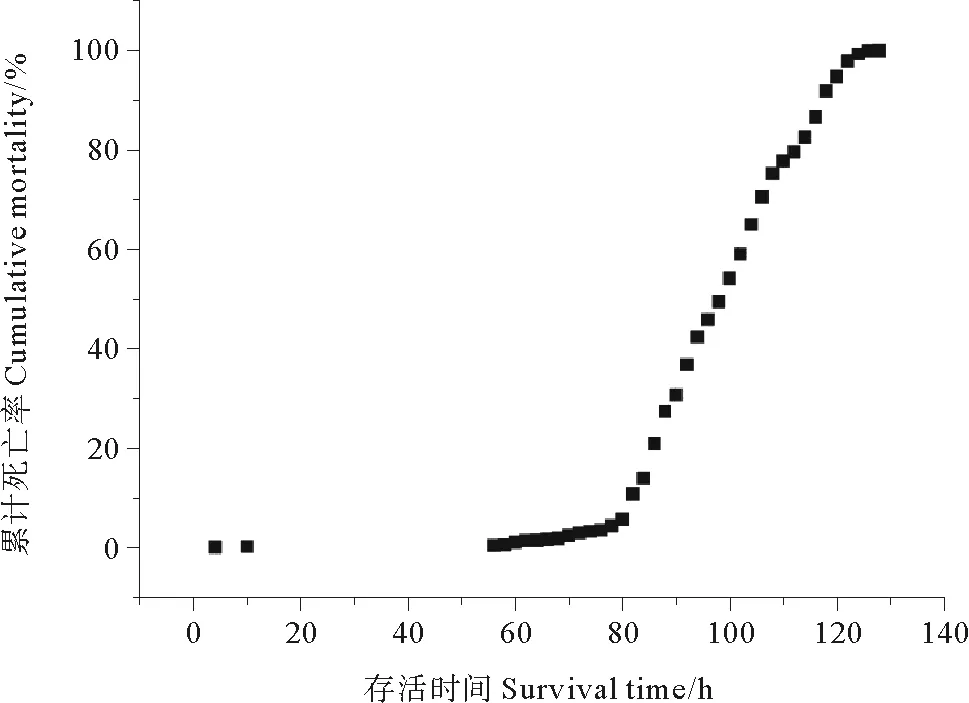
图1 大菱鲆氨氮胁迫下的累计死亡率
2.2 不同家系间耐氨氮存活时间的差异比较
图2中的箱线图列出了4月龄大菱鲆不同家系之间在耐氨氮性状测试实验中存活时间的中位数、第一四分位数、第三四分位数、最小值、最大值和异常值。结果显示,大菱鲆各家系之间以及家系内的各个体之间存活时间差异较大。各个家系平均存活时间的变化范围为85.48~114.42 h,变异系数为7.75%。统计分析结果同样显示,不同家系间的存活时间存在极显著差异(P<0.01)(见表2)。

图2 40个大菱鲆家系耐氨氮存活时间的箱线图Fig.2 The box-plot of survival time to ammonia-resistant from 40 turbot families

性状Trait变异来源Variationsource平方和Sumofsquares自由度Degreesoffreedom均方MeansquareF值FvalueP值Pvalue存活时间Survivaltime/h组间Betweengroups54409.93391395.138.980.00组内Withingroups141651.23912155.32
2.3 大菱鲆耐氨氮性状及体长、体重的遗传参数
如表3所示,4月龄大菱鲆的耐氨氮性状遗传力为0.46±0.20,属于高遗传力,与0相比具有显著性差异。体长遗传力为0.14±0.22,属于低遗传力。体重遗传力为0.29±0.30,属于中遗传力。4月龄大菱鲆体长和体重遗传力估计值与0相比均没有显著性差异。体长和体重性状的共同环境效应分别为0.18±0.10和0.20±0.13,均远大于耐氨氮性状的共同环境效应(0.03±0.07)。

表3 大菱鲆耐氨氮性状、体长和体重的方差组分、共同环境效应和遗传力
注:σp2为表型方差,σf2为全同胞家系方差,σa2为加性遗传方差,σe2为残差。c2表示共同环境系数,h2表示遗传力。*表示差异显著(P<0.05)。
Note: σp2-phenotype variance,σf2-full-sib variance,σa2-additive genetic variance,σe2-residual variance.c2-common environment effect, .h2-heritability.*means significantly different(P<0.05).
4月龄大菱鲆的耐氨氮性状、体长和体重间的遗传相关和表型相关如表4所示。由表4可见,大菱鲆耐氨氮性状与体长之间的遗传相关和表型相关均表现为低度线性负相关,分别为-0.06和-0.10。耐氨氮性状与体重的遗传相关和表型相关同样表现为低度线性负相关,分别为-0.02和-0.06,统计检验均不显著(P>0.05)。大菱鲆的体长与体重两个性状间的遗传相关和表型相关均为极显著正相关(P<0.01),其相关系数分别为0.88和0.83。

表4 耐氨氮性状、体长和体重之间的遗传相关和表型相关Table 4 Genetic correlation and phenotypic correlation between ammonia-resistant, body length and body weight
注:对角线上方为遗传相关,下方为表型相关,**表示差异极显著(P<0.01)。
Note: Above the diagonal line is the genetic correlation,below it is the phenotypic correlation;**means extremely significant difference(P<0.01)
3 讨论
3.1 大菱鲆耐氨氮性状、体长和体重的遗传力估计
遗传力是数量遗传学中的一个最基本参数,它反映了亲代将某一数量性状遗传给下一代的能力。在估计育种值、制定选择指数、预测选择反应以及育种规划和决策等方面都起着非常重要的作用[19]。准确估计遗传力是从表型变异研究其遗传实质的基础。使用不同的模型所估计的遗传力也有所差别。
氨氮作为水产养殖中最重要的污染因子之一,尤其是在高密度的养殖过程中,对鱼的生长存活产生非常大的负面作用。因而在大菱鲆养殖业中,提高循环水水处理工艺水平和选育耐氨氮大菱鲆新品系要齐头并进。在本实验中,其大菱鲆死亡时间晚于预实验结果,其主要原因可能是大菱鲆的批次和实验条件控制等差异引起的,所得结果不会影响大菱鲆各性状的遗传参数评估。
在水产动物中有关耐氨氮遗传参数评估的研究较少,李文嘉[20]等研究了南美白对虾耐氨氮遗传力为0.15±0.05,与本文得出的4月龄大菱鲆耐氨氮遗传力(0.46±0.20)差别较大。另外,本文估计的大菱鲆耐氨氮性状遗传力均高于其他水产动物的抗性性状遗传力,如大菱鲆耐热性遗传力(0.03±0.03)[8],牙鲆抗迟缓爱德华氏菌遗传力(0.18±0.02)[21],南美白对虾的抗TSV遗传力(0.28±0.14)[22]以及大黄鱼耐低氧遗传力(0.23)和耐低pH遗传力(0.23)[23]等。动物的抗病、耐高温、耐低温等抗性性状均属于阈性状,其表型呈现非连续性变异,而其遗传基础受多基因控制,与一般数量性状类似,具有一个潜在的连续型分布。同时,一个物种的性状遗传力并不是一成不变的,它还与群体的遗传结构以及群体所处的外界环境有关。控制性状的加性遗传效应越大,估计的遗传力就越高;对于一个群体来说,控制该性状的遗传基础一致性越好,基因的纯合度越大,反而估计的遗传力却很低。然而这种遗传力的降低并不意味着性状遗传能力的下降,反而表明群体平均遗传能力越强[19]。在本实验中所估计的耐氨氮性状遗传力均大于水产动物的其他抗性遗传力,可能是因为大菱鲆的耐氨氮性状选育第一次开展,个体间遗传基础存在很大的差异性,具有很高的选育潜力。而其他水产动物的抗性性状经过几代有效选育,个体的遗传基础一致性较好,故所估计的遗传力比较低。
另外,本研究结果显示,4月龄大菱鲆体重和体长遗传力属于中低遗传力。有关大菱鲆体长和体重遗传参数评估的研究比较多。刘宝锁等[8]采用两种动物模型进行比较,最后得出大菱鲆的体重遗传力为0.22±0.09。张庆文等[24]通过混合模型方程,使用约束最大似然法估计了25日龄大菱鲆的体长遗传力为0.20。以上研究结果与本研究估计的体重遗传力(0.29)和体长遗传力(0.14)比较接近。马爱军等[25]使用父系半同胞组内相关法估计了6月龄大菱鲆的体长和体重遗传力分别为0.28和0.45,属于中高遗传力。这可能是因为父系半同胞组内相关法与动物模型相比,并不能利用个体之间的亲缘关系,也不能有效剖分随机效应,其遗传力估计值会偏高。
3.2 耐氨氮性状、体长和体重的相关性
由于基因的一因多效以及基因不平衡连锁等原因,使得生物体的各个性状之间存在不同程度的遗传相关。研究这些性状之间的相关性可以制定一个综合选择指数,并以此指数制定多性状选择育种方案,对家系或个体进行挑选,提高选择效率,选育理想品种。性状间的遗传相关性越高,间接选择的效果就越好[26]。
在本研究中得出4月龄大菱鲆的体长和体重的遗传相关和表型相关均非常高,分别为0.88±0.18和0.83±0.02,跟预想和实际情况基本一致。而体长和体重两个性状与耐氨氮性状的遗传相关和表型相关均表现为低度负相关(R<0.10),并且显著性检验表明没有统计学意义。说明对体长和体重性状进行选育时并不会对耐氨氮性状起到间接选育的效果。
3.3 共同环境效应评价
共同环境效应是指全同胞家系内个体间由于共同的生活环境造成某些性状的相似性增加,共同环境效应的剖分对准确估计遗传力具有非常重要的作用。在本研究中体长和体重两个性状的共同环境效应较大,可能是因为在大菱鲆培育的早期阶段每个缸独立培育产生的。而耐氨氮性状测试实验持续时间相对较短,产生的耐氨氮性状共同环境效应较低。另外,本研究估计的遗传力标准误普遍偏高,可能是实验使用的大菱鲆总体数量和半同胞家系数量偏少造成的。
马爱军等[27]研究表明,在大菱鲆的不同发育阶段,基因的加性效应和显性效应存在交替表达现象。于飞等[28]研究表明,通过BLUP法对大菱鲆早期个体进行遗传改良时,由于个体生长速度不同,会影响选择的效率和可信度。王新安等[29]比较了不同家系在不同生长时期生长数据不一致,建议在对大菱鲆进行个体选择时不低于9月龄。徐利永等[9]测量了大菱鲆在低温条件下养殖54d时,体重和体长遗传力分别为0.44和0.30,而在90d时测得的体重和体长遗传力分别为0.55和0.50。因而具体选择哪个生长阶段来估计大菱鲆耐氨氮性状遗传参数,使其选育效果达到最理想化,仍需进一步研究。
4 结语
本研究通过大规模建立大菱鲆家系,采用一般动物模型,利用限制性极大似然法评估大菱鲆耐氨氮性状、体长和体重的遗传参数。研究发现,大菱鲆耐氨氮性状遗传力为0.46±0.20,属于高遗传力,耐氨氮性状与体长、体重的遗传相关和表型相关均非常低。研究结果表明,大菱鲆具备开展基于表型性状的耐氨氮选育潜力,且选育结果不会对大菱鲆的体长和体重产生显著影响。研究结果将为进一步选育大菱鲆耐氨氮品系提供理论依据。
[1] 门强, 雷霁霖, 王印庚. 大菱鲆的生物学特性和苗种生产关键技术[J]. 海洋科学, 2004, 28(3): 1-4.
Men Q, Lei J L, Wang Y G.Biology and critical breeding techniques of turbot,Scophthalmusmaximus[J]. Marine Sciences, 2004, 28(3): 1-4.
[2] 国家鲆鲽类产业技术研发中心. 国家鲆鲽类产业技术体系年度报告(2015)[M]. 青岛: 中国海洋大学出版社, 2015: 5-9.
National Flatfish Industry Technology Development Center. Annual Report 2015 of National Technology System for Flatfish Culture Industry[M]. Qingdao: Ocean University of China Press, 2015: 5-9.
[3] 雷霁霖. 鲆鲽类养殖新形势和发展动向[J]. 科学养鱼, 2005(1): 34-35.
Lei J L. The new situation and development trend of flatfish aquaculture[J]. Scientific Fish Farming, 2005(1): 34-35.
[4] 张文香, 王志敏, 张卫国. 海水鱼类工厂化养殖的现状与发展趋势[J]. 水产科学, 2005, 24(5): 50-52.
Zhang W X, Wang Z M, Zhang W G. Current status and development trend of industrialized mariculture of fish[J]. Fisheries Science, 2005, 24(5): 50-52.
[5] Ruyet P L, Galland R, Roux A L, et al. Chronic ammonia toxicity in juvenile turbot (Scophthalmusmaximus)[J]. Aquaculture, 1997, 154(2): 155-171.
[6] Foss A, Imsland A K, Roth B, et al. Effects of chronic and periodic exposure to ammonia on growth and blood physiology in juvenile turbot (Scophthalmusmaximus)[J]. Aquaculture, 2009, 296(s1-2): 45-50.
[7] 栾生, 孔杰, 王清印. 水产动物育种值估计方法及其应用的研究进展[J]. 海洋水产研究, 2008, 29(3): 101-107.
Luan S, Kong J, Wang Q Y. Methods and application of aquatic animal breeding value estimation: A review[J]. Marine Fisheries Research, 2008, 29(3): 101-107.
[8] 刘宝锁, 张天时, 孔杰, 等. 大菱鲆生长和耐高温性状的遗传参数估计[J]. 水产学报, 2011, 35(11): 1601-1606.
Liu B S, Zhang T S, Kong J, et al. Estimation of genetic parameters for growth and upper thermal tolerance traits in turbotScophthalmusmaximus[J]. Journal of Fisheries of China, 2011, 35(11): 1601-1606.
[9] 徐利永, 王伟继, 孔杰, 等. 不同低温养殖时长对大菱鲆生长性能及数量性状遗传力的影响[J]. 中国水产科学, 2014, 21(5): 929-935.
Xu L Y, Wang W J, Kong J, et al. Effect of duration of exposure to low temperature on growth of turbot(ScophthalmusmaximusL.) and heritability of cold resistance[J]. Journal of Fishery Sciences of China, 2014, 21(5): 929-935.
[10] 田燚, 孔杰, 栾生, 等. 中国对虾生长性状遗传参数的估计[J]. 渔业科学进展, 2008(3): 1-6.
Tian Y, Kong J, Luan S, et al. Estimation of genetic parameters for growth traits of Chinese shrimpFenneropenaeuschinensis[J]. Marine Fisheries Research, 2008(3): 1-6.
[11] 罗坤, 孔杰, 栾生, 等. 罗氏沼虾生长性状的遗传参数及其相关性[J]. 渔业科学进展, 2008, 29(3): 80-84.
Luo K, Kong J, Luan S, et al. Correlation analysis for genetic parameters of growth traits ofMacrobrachiumrosenbergii[J]. Marine Fisheries Research, 2008, 29(3): 80-84.
[12] 栾生, 罗坤, 阮晓红, 等. 凡纳滨对虾(Litopenaeusvannamei)体重、存活性状的遗传参数和基因型与环境互作效应[J]. 海洋与湖沼, 2013, 44(2): 445-452.
Luan S, Luo K, Ruan X H, et al. Genetic parameters and genotype by environment interaction for body weight and survival of pacific white shrimpLitopenaeusNannamei[J]. Oceanologia et Limnologia Sinica, 2013, 44(2): 445-452.
[13] 罗坤, 夏永涛, 王斌, 等. 俄罗斯鲟早期生长性状遗传参数的估计[J]. 中国水产科学, 2015, 22(3): 426-432.
Luo K, Xia Y T, Wang B, et al. Estimates of genetic growth trait parameters during early development ofAcipensergueldenstaedtii[J]. Journal of Fishery Sciences of China, 2015, 22(3): 426-432.
[14] Butler D G, Cullis B R, Gilmour A R, et al. ASReml-R Reference Manual[M]. Bribane, Australia:Department of Primary Industries and Fisheries, 2009.
[15] 马爱军, 王新安, 薛宝贵, 等. 大菱鲆(Scophthalmusmaximus)选育家系的构建和培育技术研究[J]. 海洋与湖沼, 2010, 41(3): 301-306.
Ma A J, Wang X A, Xue B G, et al. Investigation on family construction and rearing techniques for turbot(ScophthalmusmaximusL.) family selection[J]. Oceanologia et Limnologia Sinica, 2010, 41(3): 301-306.
[16] 胡玉龙. 大菱鲆早期性别分化及性别相关SNP位点筛选研究[D]. 上海: 上海海洋大学, 2014:14-16.
Hu Y L. Studies on Early sex differentiation and sex-associated SNPs screening in turbots (ScophthalmusmaximusL.)[D]. Shanghai: Shanghai Ocean University, 2014:14-16.
[17] Gilmour A R, Gogel B J, Cullis B R, et al. ASReml User Guide Release 3.0[M]. Hemel Hempstead, UK:VSN International Ltd., 2009.
[18] R Core Team. R: A Language and Environment for Statistical Computing[M]. Vienna, Austria:R Foundation for Statistical Computing, 2014.
[19] 盛志廉. 数量遗传学[M]. 北京: 科学出版社, 1999: 42-48.
Sheng Z L. Quantitative Genetics[M]. Beijing: Science Press, 1999: 42-48.
[20] Li W, Lu X, Luan S, et al. Heritability of body weight and resistance to ammonia in the Pacific white shrimpLitopenaeusvannameijuveniles[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(5): 1025-1033.
[21] 郑卫卫, 陈松林, 李泽宇, 等. 牙鲆抗迟缓爱德华氏菌性状的遗传力和育种值分析[J]. 农业生物技术学报, 2016, 24(8): 1181-1189.
Zheng W W, Chen S L, Li Z Y, et al. Analyzing of heritability and breeding value of disease resistance for Edwardsiella tarda in Japanese Flounder (Paralichthysolivaceus)[J]. Journal of Agricultural Biotechnology, 2016, 24(8): 1181-1189.
[22] Argue B J, Arce S M, Lotz J M, et al. Selective breeding of Pacific white shrimp (Litopenaeusvannamei) for growth and resistance to Taura Syndrome Virus[J]. Aquaculture, 2002, 204(3): 447-460.
[23] Wang X Q, Wang Z Y, He X R. Heritability and tolerance of Larimichthys crocea to environmental factors[J]. Oceanologia et Limnologia Sinica, 2009, 40(6): 781-785.
[24] 张庆文, 孔杰, 栾生, 等. 大菱鲆25日龄3个经济性状的遗传参数评估[J]. 海洋水产研究, 2008, 29(3): 53-56.
Zhang Q W, Kong J, Luan S, et al. Estimation of genetic parameters for three economic traits in 25d turbot fry[J]. Marine Fisheries Research, 2008, 29(3): 53-56.
[25] 马爱军, 王新安, 杨志, 等. 大菱鲆(Scophthalmusmaximus)幼鱼生长性状的遗传力及其相关性分析[J]. 海洋与湖沼, 2008, 39(5): 499-504.
Ma A J, Wang X A, Yang Z, et al. The growth traits and their heritability of young turbot (ScophthalmusmaximusL.)[J]. Oceanologia et Limnologia Sinica, 2008, 39(5): 499-504.
[26] 李思发, 王成辉, 刘志国, 等. 三种红鲤生长性状的杂种优势与遗传相关分析[J]. 水产学报, 2006, 30(2): 175-180.
Li S F, Wang C H, Liu Z G, et al. Analysis of heterosis and genetic correlation of growth traits in three variants of red common carp[J]. Journal of Fisheries of China, 2006, 30(2): 175-180.
[27] 马爱军, 王新安. 大菱鲆体重性状不同生长期的遗传分析[J]. 中国水产科学, 2014, 21(2): 244-249.
Ma A J, Wang X A. Genetic analyses for body weight trait in turbot (ScophthalmusmaximusL.). at different developmental stages[J]. Journal of Fishery Sciences of China, 2014, 21(2): 244-249.
[28] 于飞, 张庆文, 孔杰, 等. 大菱鲆不同进口群体杂交后代的早期生长差异[J]. 水产学报, 2008, 32(1): 58-64.
Yu F, Zhang Q W, Kong J, et al. Growth of the juvenile hybrids from different crossing combinations of the importedScophthalmusmaximusL.[J]. Journal of Fisheries of China, 2008, 32(1): 58-64.
[29] 王新安, 马爱军, 雷霁霖, 等. 大菱鲆不同家系生长性能的比较[J]. 海洋科学, 2011(4): 1-8.
Wang X A, Ma A J, Lei J L, et al. Comparison of the growing performance of different families of turbot (ScophthalmusmaximusL.)[J]. Marine Sciences, 2011(4): 1-8.

