“海大金贝”类胡萝卜素浓度与生长性状的相关性分析❋
张 璐, 李 雪, 李 宁, 王姝玥, 李 旭, 孙贵东, 胡晓丽,2❋ ❋, 包振民,2
(1.中国海洋大学海洋生命学院,海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003; 2.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237)
类胡萝卜素是自然界中最常见的色素,大多是由细菌、真菌、藻类、植物等光合作用生物体合成的。在目前已发现的750种天然类胡萝卜素中,超过250种来源于海洋生物[1]。包括海洋动物在内的大多数动物自身不能合成类胡萝卜素,只能从食物中获取。这些类胡萝卜素沉积于海洋动物的皮肤、贝壳或外骨骼中,在生殖、光保护、抗氧化等过程中发挥作用[1]。例如,类胡萝卜素可以促进海洋生物性腺的发育和成熟[1-3]。向人工培育的大西洋鲑(Salmosalar)和红海鲤鱼(Cbrysophrysmajor)喂食虾青素可以提高卵巢发育、受精、孵化[2];喂食β胡萝卜素的海胆(Pseudocentrotusdepressus)可代谢生成海胆酮,能促进繁殖和提高幼体的成活率[3]。另外,类胡萝卜素有很好的抗氧化性能,可以抑制脂类过氧化反应,如虹鳟(Oncorhynchusmykiss)补充虾青素后可以抵御氧化压力[4-5]。
除了在繁殖、免疫、抗氧化等方面起重要作用,类胡萝卜素积累也与人类和动物的生长有密切关系。在体外环境下,类胡萝卜素β-cryptoxanthin对刺激成骨细胞的形成和抑制破骨细胞再吸收有一定的作用,从而增加人体骨骼重量,并且摄入β-cryptoxanthin可以预防健康人和绝经后妇女的骨流失[6]。类胡萝卜素与海洋经济动物生长的关系也备受关注。例如,在对虾(Penaeussemisulcatus)的研究中发现,喂食虾青素、β-胡萝卜素等类胡萝卜素可以缩短蜕皮周期、加速幼虾的发育,并对提高幼虾的生长速率也有帮助[7-9]。Christiansen等的研究显示[10],当鱼苗的日常饲料中虾青素含量高于5.3 mg/kg时,大西洋鲑鱼可保持正常生长,低于该值时,鱼苗生长缓慢。向人工培育的大西洋鲑和红海鲤鱼喂食虾青素还可以促进幼鱼的生长[2]。类胡萝卜素还可以增强海洋生物的免疫能力和对环境压力的抗性,刺激细胞增长等[11-12]
虾夷扇贝(Patinopectenyessoensis)是中国北方的重要养殖贝类,于1982年由日本引入中国[13]。与大多数双壳贝类一样,虾夷扇贝的闭壳肌是白色的。本课题组通过选育,培育出闭壳肌呈橘红色的虾夷扇贝新品种“海大金贝”[14]。经鉴定,“海大金贝”闭壳肌中富含2种类胡萝卜素:扇贝醇酮和梳黄质[15],而在普通扇贝的闭壳肌中检测不到类胡萝卜素。作为重要的维生素A源和抗氧化剂,类胡萝卜素的富集可能对扇贝生产性状产生积极影响。本课题组在前期的养殖实践中也发现,“海大金贝”苗种的成活率和生长率较普通虾夷扇贝有明显优势。生长性状是扇贝品种培育的重要性状指标,开展“海大金贝”类胡萝卜素积累与生产性状间相关性分析可为“海大金贝”的进一步改良提供重要的参考。本研究跟踪测量了“海大金贝”养殖群体各项生长性状,包括壳高、壳长、壳宽、体重、软体重、闭壳肌重,并且检测了闭壳肌中类胡萝卜素浓度,发现“海大金贝”在生长过程中,其生长性状值的变化与闭壳肌中类胡萝卜素浓度的变化呈显著正相关性。
1 材料及方法
1.1 扇贝取样
实验用虾夷扇贝取自大连獐子岛集团股份有限公司在中国黄海北部(38°55′15″N, 121°38′21″E)区域养殖的“海大金贝”群体(2007年4月繁育)。分别在2007年11月(7月龄)、2008年2月(10月龄)、2008年4月(12月龄)、2008年7月(15月龄)、2008年10月(18月龄)和2008年12月(20月龄)对该养殖群体进行随机取样,共获得163个个体。测量取样扇贝的生长性状,体尺性状:壳高、壳宽、壳长,体重性状:总重、软体重、闭壳肌重。测量完毕后解剖扇贝,取闭壳肌保存在-80 ℃冰箱中,用于类胡萝卜素浓度的测定。
1.2 类胡萝卜素浓度检测
为防止类胡萝卜素被氧化和光异构化,所有操作均在氮气下避光进行。准确称取已进行冷冻干燥的虾夷扇贝闭壳肌1.00 g,将其放入20 mL乙酸乙酯+0.1%丁基羟基甲苯BHT浸提液中,转速为1 000 r/min高速匀浆5 min,然后4 000 r/min高速冷冻离心5 min,取上清;以上浸润、匀浆、离心、取上清的步骤需重复多次,直至浸提液为无色,以便完全萃取类胡萝卜素。将上述上清液收集于梨形瓶中,旋转蒸发至含有少量液体,氮气吹干后,用流动相乙腈∶甲醇∶二氯甲烷(V/V/V=50∶46∶4)溶解浸膏,定容至2 mL,经0.22 μm滤膜过滤至HPLC小瓶中。扇贝醇酮和梳黄质的标准品参照李宁的方法[15]制备。色谱柱为Agilent公司的Eclipse XDB-C18柱(200 mm×4.6 mm,i.d.5 μm);进样体积10 μL;流速1 mL/min;检测波长450 nm;柱温25 ℃。流动相为乙腈∶甲醇∶二氯甲烷(V/V/V=50∶46∶4)并加入0.1%的丁基羟基甲苯,检测时间15min。
1.3 类胡萝卜素积累与生长性状的相关性分析
采用Matlab程序中的线性回归模型分析各生长性状与类胡萝卜素浓度的相关性,生长性状值的增长率与类胡萝卜素浓度增长率的相关性。每个取样时间点生长性状值的变化和类胡萝卜素浓度的变化通过以下公式计算获得:
Yn=(Xn-Xn-1)/Xn-1。
式中:Yn为性状在n时间段的增长率;Xn为n时间点性状的平均值;Xn-1为n的前一个时间点性状平均值。
回归系数|r|> 0.8为高度相关,0.3<|r|≤0.8为中度相关,|r| ≤0.3关系极弱,为不相关[16]。采用SPSS软件对各生长性状值变化与类胡萝卜素浓度变化的相关性进行显著性检验(双尾,成对检验),P<0.01为极显著,P<0.05为显著。
2 结果
2.1 “海大金贝”养殖群体闭壳肌中类胡萝卜素浓度变化规律
2种类胡萝卜素梳黄质和扇贝醇酮在“海大金贝”养殖群体闭壳肌中的积累浓度变化如图1、表1所示。“海大金贝”养殖群体闭壳肌中类胡萝卜素平均浓度在7~12月龄期间呈增长趋势,并在12月龄时出现最高值,此时扇贝醇酮、梳黄质的浓度分别达到(13.717±3.777) μg/g和(9.356±1.433) μg/g。之后2种类胡萝卜素的浓度均出现下降,其中梳黄质浓度在15月龄开始上升,而扇贝醇酮浓度持续下降。两者的总浓度在15~18月龄期间稍有提高,但18~20月龄期间又出现下降。从类胡萝卜素浓度变化的总体趋势来看,在7~12月龄期间浓度增长最快,而12~15月龄期间浓度下降最为明显。
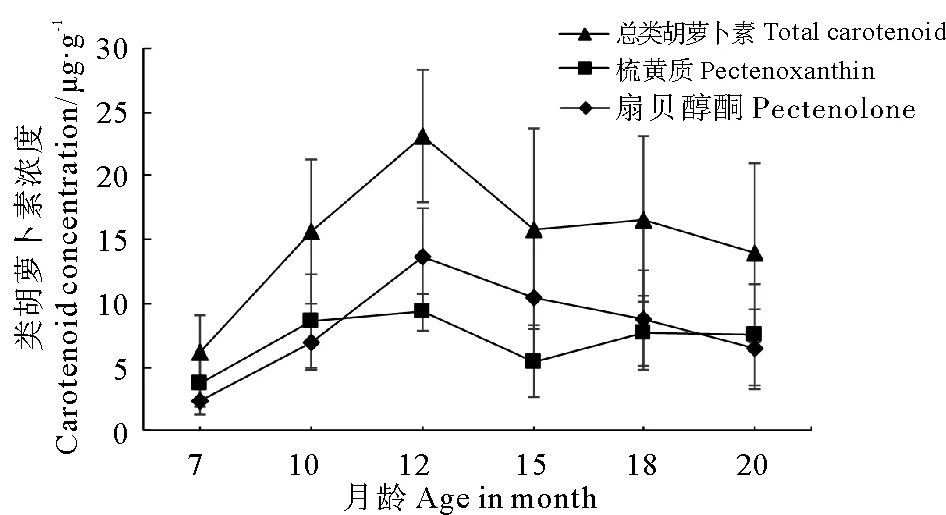
图1 “海大金贝”养殖群体闭壳肌类胡萝卜素浓度变化

月龄①扇贝醇酮浓度②/μg·g-1梳黄质浓度③/μg·g-1类胡萝卜素总浓度④/μg·g-172.363±1.014a3.806±1.920a6.170±2.915a106.970±2.104b8.647±3.634b15.618±5.583b1213.717±3.777c9.356±1.433c23.073±5.196c1510.380±5.143d5.453±2.832d15.834±7.889d188.877±3.753e7.779±2.924e16.656±6.497e206.413±3.169f7.548±3.961f13.961±6.963f
注:同一列中标有不同字母的上标表示差异性显著(P<0.05)。
Note:Different letters in the same column indicate significant differences (P<0.05).
①Age in month;②Pectenolone concentration;③Pectenoxanthin concentration;④Total carotenoid concentration
2.2 “海大金贝”生长性状变化规律
“海大金贝”养殖群体在6个取样时间点的体尺性状和体重性状见图2、表2。“海大金贝”各项生长性状值均呈持续增加趋势,最高值均出现在取样的最后一个时间点,即20月龄,表明其生长尚未达到平台期。壳高、壳长、壳宽和总重,软体重闭壳肌重在20月龄时分别达到(86.37±8.71)mm、(88.04±9.34)mm、(24.15±3.24)m和(81.70±19.73)g、(33.76±10.00) g和(9.70±2.97) g。在体尺性状中,壳高与壳长的变化趋势较为一致,即在7~12月龄增速较快,12~15月龄增速放缓,此后又持续提升;而壳宽则一直呈缓慢增加趋势(见图2)。体重性状中,总重和软体重一直处于增长状态,闭壳肌重在10~12月龄期间出现小幅下降,其余阶段一直处于增长状态。

图2 “海大金贝”养殖群体体尺性状(A)与体重性状(B)变化
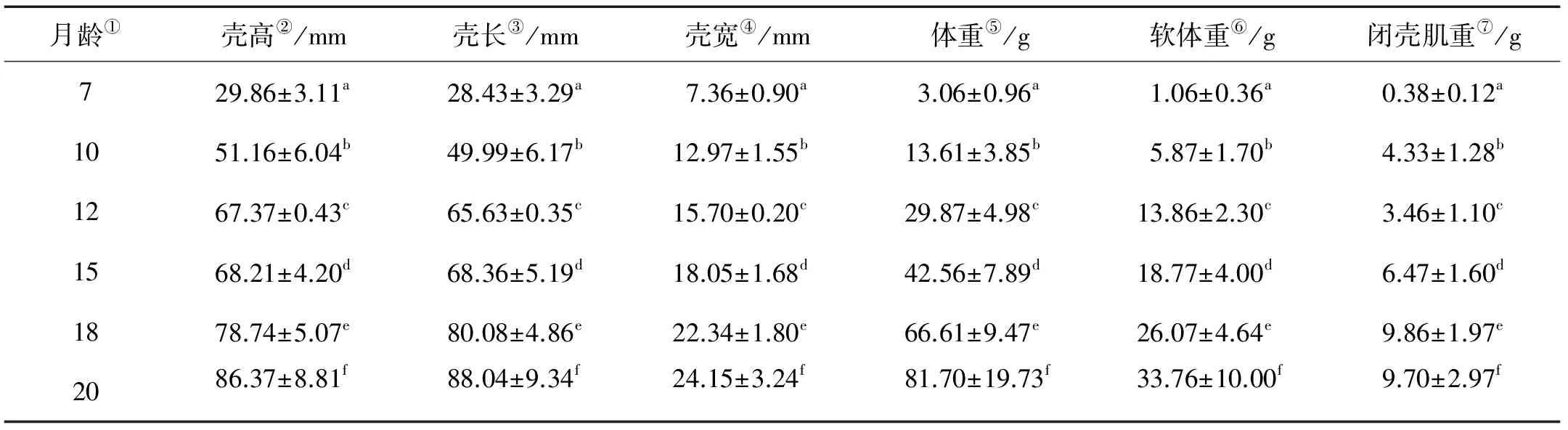
月龄①壳高②/mm壳长③/mm壳宽④/mm体重⑤/g软体重⑥/g闭壳肌重⑦/g729.86±3.11a28.43±3.29a7.36±0.90a3.06±0.96a1.06±0.36a0.38±0.12a1051.16±6.04b49.99±6.17b12.97±1.55b13.61±3.85b5.87±1.70b4.33±1.28b1267.37±0.43c65.63±0.35c15.70±0.20c29.87±4.98c13.86±2.30c3.46±1.10c1568.21±4.20d68.36±5.19d18.05±1.68d42.56±7.89d18.77±4.00d6.47±1.60d1878.74±5.07e80.08±4.86e22.34±1.80e66.61±9.47e26.07±4.64e9.86±1.97e2086.37±8.81f88.04±9.34f24.15±3.24f81.70±19.73f33.76±10.00f9.70±2.97f
注:同一列中标有不同字母的上标表示差异性显著(P<0.05)。
Note:Different letters in the same column indicate significant differences (P<0.05).
①Age in month ;②Shell height;③Shell length;④Shell width;⑤Total weight;⑥Soft body weight;⑦Adductor muscle weight
2.3 “海大金贝”生长性状及闭壳肌类胡萝卜素浓度变化规律
“海大金贝”5个时间点的壳高、壳长、壳宽、体重、软体重、闭壳肌重和类胡萝卜素浓度的增长率见表3、4和图3。各生长性状的变化与类胡萝卜素浓度的变化有相似的趋势。所有性状的增长率均在7~10月龄处于最高值;壳高、壳长的增长率和类胡萝卜素浓度增长率在12~15月龄处于最低值,而壳宽、体重、软体重增长率在18~20月龄处于最低值,闭壳肌增长率在10~12月龄处于最低。
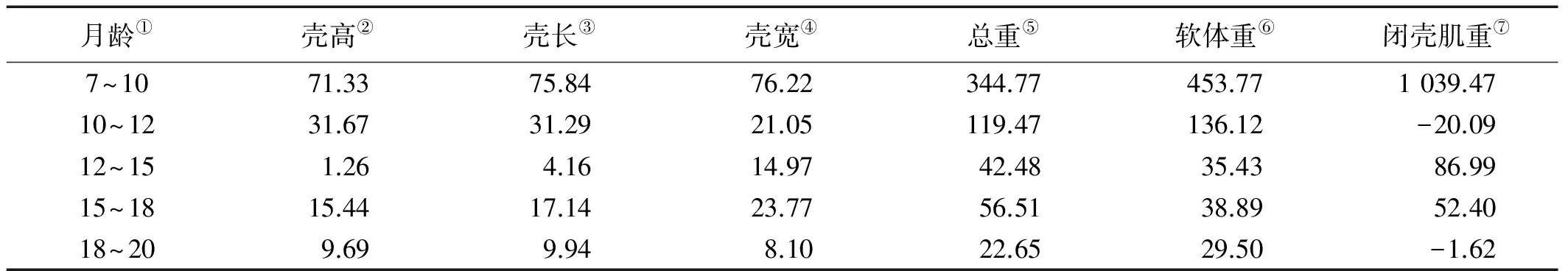
表3 “海大金贝”生长性状增长率
Note:①Age in month;②Shell height ;③Shell length ;④Shell weight ;⑤Total weight ;⑥Soft body weight;⑦Adductor muscle weight

表4 “海大金贝”闭壳肌中类胡萝卜素浓度的增长率Table 4 Growth rate of carotenoid concentration in the adductor muscle of ‘Haida golden scallop’ /%
Note:①Age in month;②Pctenolone concentration;③Pctenoxanthin concentration;④Total carotenoid concentration
2.4 “海大金贝”闭壳肌类胡萝卜素浓度与生长性状间的相关性
将各时期体尺性状和体重性状与类胡萝卜素浓度进行相关性分析,发现各生长性状与类胡萝卜素浓度的相关性均较低(r<0.3)。但生长性状值的增长率与闭壳肌类胡萝卜素浓度的变化率呈高度相关(r>0.8)。壳高、壳长、体重、软体重4个性状的增长率与类胡萝卜素浓度增长率呈极显著线性正相关(P<0.01) (见表5),相关系数r分别为0.999 3、0.998 5、0.982 9和0.977 3;壳宽、闭壳肌重的增长率与闭壳肌中类胡萝卜素总浓度增长率呈显著正相关(P<0.05),相关系数r分别为0.947 1、0.885 3。扇贝醇酮和梳黄质与各性状之间的相关性均小于类胡萝卜素总浓度与各性状的相关性。
3 讨论
生物在特定环境条件下生长性状值的差异取决于生长相关遗传因素的调控。本研究中,“海大金贝”在生长过程中,生长性状值与类胡萝卜素浓度相关度较低,可能是由于生长调控是多基因决定的。本研究发现“海大金贝”生长性状值增长率与闭壳肌中类胡萝卜素浓度增长率呈显著正相关,其中壳高、壳长、体重、软体重4个性状的增长率与类胡萝卜素浓度增长率呈极显著线性正相关(P<0.01),相关系数r分别为0.999 3、0.998 5、0.982 9和0.977 3,壳宽、闭壳肌重的增长率与闭壳肌中类胡萝卜素总浓度增长率呈显著正相关(P<0.05),相关系数r分别为0.947 1、0.885 3。实验结果提示扇贝醇酮和梳黄质的积累可能促进扇贝生长。类胡萝卜素对生长的促进作用已在多种海洋经济动物中报道。在甲壳动物中,Kanasawa 等最早提出了在喂食日本对虾(P.japonicus)过程中添加β-胡萝卜素和维生素A可以促进幼虾的生长[17],He等演示了维生素A在凡纳滨对虾(P.vannamei)中对生长所起到的必要性作用[18]。Petit等实验验证了类胡萝卜素可以增加日本对虾(P.japonicus)的生长[8-9]。在鱼类中,Torrissen等[2]对大西洋鲑投喂虾青素和角黄素可以在早期喂养阶段提高生长速率。在棘皮动物中,Kawakami等研究海胆中β-类胡萝卜素有利于海胆吞噬细胞的增加[3,12]。类胡萝卜素促进海洋生物生长的机理暂不明确,但在骨生长的研究中发现[6],类胡萝卜素通过调节与成骨细胞形成和破骨细胞再吸收的相关蛋白的基因表达来促进骨的生长,例如类胡萝卜素β-cryptoxanthin可能通过绑定成骨细胞核内的孤儿受体促进骨生长相关蛋白的基因表达,同时通过激活PKC或MAPK通路促进调节生长相关蛋白的转录活性。在本研究中,就单一类胡萝卜素与生长性状相关性比较而言,闭壳肌中扇贝醇酮增长率与壳高、壳长增长率呈极显著相关(P<0.01),相关系数r分别为0.972、0.966 5,与壳宽、总重和软体重呈显著相关(P<0.05),相关系数r分别为0.884 8、0.957 6和0.952 9;闭壳肌中梳黄质增长率与壳高、壳长、壳宽和总重增长率呈显著相关(P<0.05),相关系数r分别为0.913 3、0.018 7、0.922和0.882 7。扇贝醇酮和梳黄质与各性状之间的相关性均小于类胡萝卜素总浓度与各性状的相关性,暗示2种类胡萝卜素协同促进生长。基因表达谱分析发现,与普通虾夷扇贝相比,“海大金贝”闭壳肌中与类胡萝卜素吸收、转运相关的基因显著上调表达(未发表),提示“海大金贝”有较高的类胡萝卜素吸收能力,使类胡萝卜素在体内富集,并进而促进生长。

图3 “海大金贝”生长性状(A,B)和闭壳肌中类胡萝卜素浓度(C)的增长率
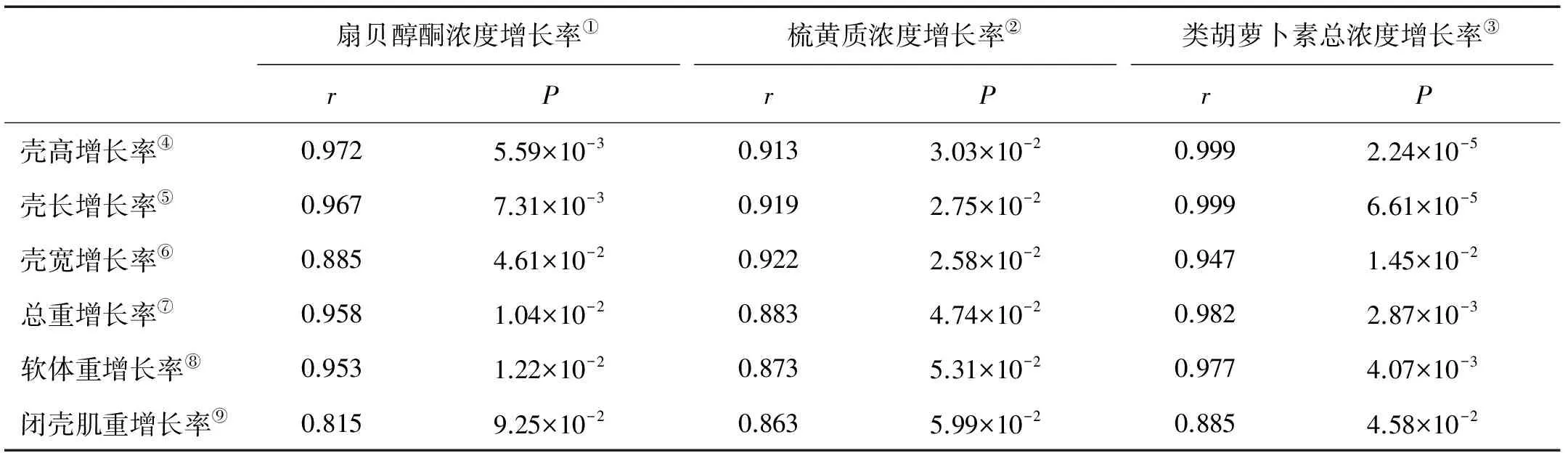
扇贝醇酮浓度增长率①梳黄质浓度增长率②类胡萝卜素总浓度增长率③rPrPrP壳高增长率④0.9725.59×10-30.9133.03×10-20.9992.24×10-5壳长增长率⑤0.9677.31×10-30.9192.75×10-20.9996.61×10-5壳宽增长率⑥0.8854.61×10-20.9222.58×10-20.9471.45×10-2总重增长率⑦0.9581.04×10-20.8834.74×10-20.9822.87×10-3软体重增长率⑧0.9531.22×10-20.8735.31×10-20.9774.07×10-3闭壳肌重增长率⑨0.8159.25×10-20.8635.99×10-20.8854.58×10-2
Note:①Growth rate of pectenolone concentration;②Growth rate of pectenoxanthin concentration;③Growth rate of total carotenoid concentration;④Growth rate of shell height;⑤Growth rate of shell length;⑥Growth rate of shell width;⑦Growth rate of total weight;⑧Growth rate of soft body weight;⑨Growth rate of adductor muscle weight
相较于普通扇贝,“海大金贝”最明显的特征是具有橘红色的富集类胡萝卜素的闭壳肌。在本研究中,壳高、壳长、体重、软体重的增长率与闭壳肌中类胡萝卜素浓度的变化率均呈极显著正相关(P<0.01),相关系数分别为0.999 3、0.998 5、0.982 9和0.977 3。前期的研究显示,“海大金贝”外套膜、肾脏、鳃等组织中,类胡萝卜素浓度也都高于普通扇贝[19]。因此,闭壳肌类胡萝卜素浓度的变化可能也反映了其它组织类胡萝卜素积累程度的改变。外套膜是扇贝形成贝壳最重要的器官[20],“海大金贝”体尺性状值的变化可能与外套膜中类胡萝卜素浓度的变化有关。研究表明一些类胡萝卜素参与动物的钙化过程,例如在人类骨骼的研究中发现,类胡萝卜素β-cryptoxanthin在体外实验环境下对骨骼的钙化有着刺激作用[21-22]。在对3 200名中老年人骨密度研究中发现,视黄醇、α-及β-胡萝卜素、番茄红素浓度越高骨密度也越高,其中,α-胡萝卜素关联度最高,β-胡萝卜素次之,女性关联度略高于男性[23]。“海大金贝”中类胡萝卜素的富集是否能够促进碳酸钙的形成及壳的生长有待进一步研究。
“海大金贝”闭壳肌中,类胡萝卜积累呈现春季浓度升高而夏季浓度降低的趋势,如在春季10~12月龄,扇贝醇酮、梳黄质和总类胡萝卜素浓度增长率分别为96.79%、8.19%和47.73%;而在夏季12~15月龄期间,扇贝醇酮、梳黄质和总类胡萝卜素浓度增长率分别为-24.32%、-41.71%和-31.37%。研究表明,海洋生物类胡萝卜素的积累受多种因素影响。Yanar等[24]发现在地中海东部的2种对虾P.semisulcatus和Metapenaeusmonoceros,类胡萝卜素含量在春季最高,而秋冬季节最低,推测认为这种变化是由于水体中饵料丰度和种类变化导致的。另外,春季是扇贝的繁殖季节,此时类胡萝卜的高水平积累也可能与内分泌调节有关。其次,类胡萝卜素多为亲脂性,其吸收、代谢、转运等代谢过程多依赖脂类代谢[25],前期研究显示,“海大金贝”的类胡萝卜素积累与单不饱和脂肪酸合成的限速酶SCD基因的表达可能有相关性[26]。对“海大金贝”类胡萝卜素积累调节机制的深入解析将有助于理解其与生长调控之间的关系。
4 结语
本研究对“海大金贝”养殖群体各项生长性状与闭壳肌中类胡萝卜素浓度进行相关性分析,结果显示各生长性状值的增长率与闭壳肌中类胡萝卜素浓度增长率呈显著正相关,研究提示类胡萝卜素积累可能对“海大金贝”生长有促进作用。
[1] Maoka T. Carotenoids in marine animals[J]. Mar Drugs, 2011, 9(2): 278-293.
[2] Torrissen O J, Christiansen R. Requirements for carotenoids in fish diets[J]. Journal of Applied Ichthyology, 1995, 11(3-4): 225-230.
[3] Tsushlma M, Kawakami T, Mine M, et al. The role of carotenoids in the development of the sea urchinPseudocentrotusdepressus[J]. Invertebr Reprod Dev, 1997, 32(2): 149-153.
[4] Nakano T, Tosa M, Takeuchi M. Improvement of biochemical features in fish health by red yeast and synthetic astaxanthin[J]. Journal of Agricultural & Food Chemistry, 1995, 43(6): 30-30.
[5] Nakano T, Kanmuri T, Sato M, et al. Effect of astaxanthin rich red yeast (Phaffiarhodozyma) on oxidative stress in rainbow trout[J]. Biochimica Et Biophysica Acta, 1999, 1426(1): 119-125.
[6] Yamaguchi M. Role of carotenoid β-cryptoxanthin in bone homeostasis[J]. Journal of Biomedical Science, 2012, 19(1): 1-13.
[7] Dall W. Carotenoids versus retinoids (Vitamin A) as essential growth factors in penaeid prawns (Penaeussemisulcatus)[J]. Marine Biology, 1995, 124(2): 209-213.
[8] Petit H, Nègre-Sadargues G, Castillo R, et al. The effects of dietary astaxanthin on growth and moulting cycle of postlarval stages of the prawn,Penaeusjaponicus(Crustacea, Decapoda)[J]. Comparative Biochemistry & Physiology Part A Physiology, 1997, 117(4): 539-544.
[9] Petit H, Nègre-Sadargues G, Castillo R, et al. The effects of dietary astaxanthin on the carotenoid pattern of the prawnPenaeusjaponicus, during postlarval development[J]. Comparative Biochemistry & Physiology Part A Molecular & Integrative Physiology, 1998, 119(2): 523-527.
[10] Christiansen R, Lie O, Torrissen O J. Growth and survival of Atlantic salmon, Salmo salar L. fed different dietary levels of astaxanthin. First-feeding fry[J]. Aquaculture Nutrition, 1995, 1(3): 189-198.
[11] Thompson I, Choubert G, Houlihan D, et al. The effect of dietary vitamin A and astaxanthin on the immunocompetence of rainbow trout[J]. Aquaculture, 1995, 133(2): 91-102.
[12] Kawakami T, Tsushima M, Katabami Y, et al. Effect of β, β-carotene, β-echinenone, astaxanthin, fucoxanthin, vitamin A and vitamin E on the biological defense of the sea urchinPseudocentrotusdepressus[J]. J Exp Mar Biol Ecol, 1998, 226(2): 165-174.
[13] 王庆成. 虾夷扇贝的引进及其在我国北方培养殖的前景[J]. 水产科学, 1984(4): 24-27.
Wang Q C. Introduction of Japanese scallop and prospect of culture it in northern China[J]. Fisheries Sci, 1984(4): 24-27.
[14] 中华人民共和国农业部. 中华人民共和国农业部公告第1339号.[EB/OL].(2010-2-3)[2010-3-8]. http://www.moa.gov.cn/govpublic/YYJ/201006/t20100606_1538706.htm.
Ministry of Agriculture of the People’s Republic of China. Announcement No. 1339th of the Ministry of Agriculture of the People’s Republic of China.[EB/OL].(2010-2-3)[2010-3-8]. http://www.moa.gov.cn/govpublic/YYJ/201006/t20100606_1538706.htm.
[15] Li N, Hu J, Wang S. et al. Isolation and identification of the main carotenoid pigment from the rare orange muscle of the Yesso scallop[J]. Food Chemistry, 2010, 118(3): 616-619.
[16] 盛骤, 谢式千, 潘承毅. 概率论与数理统计[M]. 第三版. 北京:高等教育出版社, 2005: 27-30.
Sheng Z, Xie S Q, Pan C Y. Probability and Statistics[M]. Third Edition. Beijing: Higher Education Press, 2005: 27-30.
[17] Kanazawa A. Nutrition of penaeid prawns and shrimps[C]//First International Conference on the Culture of Penaeid Prawns/Shrimps.Iloilo, Philippines:Aquaculture Department, Southeast Asian Fisheries Development Center, 1985: 123-130.
[18] He H, Lawrence A L, Liu R. Evaluation of dietary essentiality of fat-soluble vitamins, A, D, E and K for penaeid shrimp (Penaeusvannamei)[J]. Aquaculture, 1992, 103(2): 177-185.
[19] 李宁. 虾夷扇贝橘红色闭壳肌产生的原因及其在育种中的应用[D]. 青岛:中国海洋大学, 2009.
Li N. What accounting for orange color of Yesso scallop muscle (Patinopectenyessoensis) and its application in breeding[D]. Qingdao:Ocean University of China, 2009.
[20] Addadi L, Joester D, Nudelman F, et al. Mollusk shell formation: a source of new concepts for understanding biomineralization processes[J]. Chemistry, 2006, 12(4): 980-987.
[21] Yamaguchi M, Uchiyama S. Effect of carotenoid on calcium content and alkaline phosphatase activity in rat femoral tissues in vitro: the unique anabolic effect of beta-cryptoxanthin.[J]. Biological & Pharmaceutical Bulletin, 2003, 26(8): 1188-1191.
[22] Yamaguchi M, Uchiyama S. beta-Cryptoxanthin stimulates bone formation and inhibits bone resorption in tissue culture in vitro.[J]. Molecular and Cellular Biochemistry, 2004, 258(1): 137-144.
[23] 陈裕明, 刘俊, 张喆庆,等.维生素A,E和类胡萝卜素与3200名中老年人骨密度、动脉粥样硬化、脂肪肝及肌肉量的关系[C].北京:全国营养科学大会, 2015.
Chen Y M, Liu J, Zhang J Q, et al. The Association of Vitamin A, E, and Carotenoids with Bone Mineral Density, Atherosclerosis, Fatty Liver, and Muscle Mass in 3200 Middle-aged and Elderly Subjects[C]. Beijing:China Nutrition Science Congress, 2015.
[24] Yanar Y, Gelik M, Yanar M. Seasonal changes in total carotenoid contents of wild marine shrimps (Penaeussemisulcatus, andMetapenaeusmonoceros) inhabiting the eastern Mediterranean[J]. Food Chemistry, 2004, 88(2): 267-269.
[25] Harrison E H. Mechanisms of digestion and absorption of dietary vitamin A[J]. Annual Review of Nutrition, 2005, 25(1): 87-103.
[26] Li X, Ning X, Dou J, et al. An SCD gene from the Mollusca and its upregulation in carotenoid-enriched scallops[J]. Gene, 2015, 564(1): 101-108.

