喹烯酮与鸡鸭血浆蛋白结合率的检测❋
张瑞丽, 郝智慧, 曲少奇, 王远红, 姜廷福, 吕志华❋ ❋
(1中国海洋大学医药学院海洋药物教育部重点实验室, 山东 青岛 266003; 2 青岛农业大学化学与药学院农用生物药物创制技术国家地方联合工程实验室,山东 青岛 266003)
喹烯酮(Quinocetone,QCT),是经国家农业部批准的一类新兽药,属于喹噁啉-1,4-二氧化物类化合物[1]。喹烯酮在抗菌[2]、促进动物生长、控制动物消化道疾病以及提高饲料利用率方面具有显著的作用[3]。喹烯酮为中国在国际上首创的一类新兽药,其在我国养殖业中作为饲料添加剂已被广泛使用。临床上喹烯酮在鸡鸭上的应用也很普遍, Miao X L等[4]研究表明,喹烯酮提高肉仔鸡日增重和改善饲喂效率效果显著;徐善金等[5]研究表明,喹烯酮能够很好地促进肉鸭的生长及屠宰性能;陈权军等[6]的试验发现喹烯酮在肉鸭增重及料肉比方面优于同类药物喹乙醇。
血浆蛋白结合率反应出药物与血浆蛋白结合的情况[7],药物血浆蛋白结合率对药物在体内的吸收、分布、代谢及消除有影响,因此了解药物的血浆蛋白结合率是新药研发中必要开展的项目[8]。目前报道的喹烯酮的血浆蛋白结合的数据只有喹烯酮与草鱼[9]及三黄鸡[10]的血浆蛋白结合率,喹烯酮与白羽肉鸡、樱桃谷肉鸭的血浆蛋白结合率未有研究。本研究采用平衡透析法测定喹烯酮与鸡、鸭血浆蛋白结合率,为喹烯酮在鸡、鸭的临床用药以及体内的药代动力学研究提供指导。
1 材料与方法
1.1 药品与主要试剂
喹烯酮原料(含量98.6%,武汉拉那白医药化工有限公司);喹烯酮对照品(纯度≥99%,德国Dr. Ehrenstorfer公司);乙腈(德国Merck公司,色谱纯);甲酸(天津市科密欧化学试剂有限公司,色谱纯);三氯乙酸(国药集团化学试剂有限公司,分析纯),肝素钠(效价150 μ/mg,北京博奥拓达科技有限公司,分析纯),其它试剂为分析纯。
1.2 主要仪器
Agilent1260型高效液相色谱仪(美国安捷伦科技有限公司,配备四元泵、脱气机、自动进样器、DAD检测器等);台式冷冻离心机(UNIVERSAL 320R,德国海蒂诗(Hettich)科学仪器公司);分析天平(AL204型,梅特勒-托利多仪器(上海)有限公司);迷你旋涡振荡器(MS-3型,德国IKA集团公司);透析袋(截留分子量8 000~14 000,Solarbio Life Sciences);超纯水系统(Milli-QE型,美国MILLIPOR公司)。
1.3 血浆的采集
樱桃谷肉鸭5只,体重1.5~2 kg,饲喂不含喹噁啉类药物及其他抗生素的定制肉鸭饲料,试验前采血检测确认血浆中无喹噁啉类药物的干扰。正常预饲一周,颈静脉采血,分离血浆-20 ℃保存备用。
健康白羽肉鸡5只,体重1.5 kg左右,饲喂不含喹噁啉类药物及其他抗生素的定制肉鸭饲料,试验前采血检测确认血浆中无喹噁啉类药物的干扰。正常预饲一周,颈静脉采血,分离血浆-20 ℃保存备用。
1.4 溶液的配制
喹烯酮标准储备液:准确称取喹烯酮对照品10 mg置10 mL棕色容量瓶中,加入1 mL的DMSO溶解后,用乙腈定容至刻度,配制成浓度为1 mg/mL的标准储备液, -20 ℃避光保存备用;有效期1个月。
空白透析液(PBS)的配制:准确称取磷酸氢二钾7.06 g、磷酸二氢钾1.29 g和氯化钠0.995 g,加入超纯水定容至500 mL(pH=7.4)。
肝素钠抗凝剂的配制:称取肝素钠1 g,加入100 mL超纯水,超声溶解。
1.5 试验方法(平衡透析法)
将透析袋剪成长度约7 cm的小段,一端用线扎紧,将1 mL空白血浆加入至透析袋中,扎紧袋口,将透析袋置于 100 mL聚乙烯塑料离心管(其中装有25 mL的含药溶液),调整透析袋位置,使其内外液面保持在同一水平面,并避免透析袋紧贴于管壁,密封管口,于4 ℃冰箱直至药物扩散平衡,每个浓度设3个平行。
透析结束后,吸取一定量透析外液,加入10%三氯乙酸溶液,若析出白色絮状沉淀,表明有血浆蛋白漏出,则该样品作废。无血浆蛋白漏出者,分别取透析袋内外样品,按照1.5项下方法处理,检测透析袋内外喹烯酮的浓度,计算血浆蛋白结合率;血浆蛋白结合率计算公式见(1)。
(1)
式中:(Dt为透析袋内喹烯酮的浓度;Df为透析袋外喹烯酮的浓度
1.6 样品的前处理方法
取透析平衡后的血浆0.5 mL于2 mL离心管中,加入1 mL乙腈,充分涡旋1 min, 4 ℃、12 000 r/min离心10 min,取上清液,残渣用乙腈重复萃取3次,合并上清液, 50℃氮气下吹干,500μL乙腈复溶后过0.22μm的滤膜,进行HPLC分析。
取透析平衡后的外液0.5 mL,冷冻干燥后用500μL乙腈复溶后过0.22μm的滤膜,进行HPLC分析。
1.7 液相色谱条件
色谱柱:InterSustain-C18(4.6×250 mm,5μm);流动相:0.1%甲酸-乙腈(60:40),等度洗脱;流速:1.0 mL/min;柱温:30 ℃;检测波长:314 nm;进样量:20μL。
1.8 测定方法的考察
1.8.1 专属性 考察喹烯酮对照品色谱图、空白透析液色谱图、空白透析液加喹烯酮色谱图、空白血浆样品的色谱图、空白血浆样品加喹烯酮色谱图,血浆及透析液中所含的杂质应不干扰喹烯酮的检测。
1.8.2 检测限及定量限 分别在空白透析液及鸡、鸭血浆中添加系列浓度喹烯酮对照品溶液依次进样检测,以信噪比S/N=3时的喹烯酮浓度定为检测限,S/N=10时的喹烯酮浓度定为定量限。
1.8.3 标准曲线 取鸡、鸭血浆和空白透析液各450μL,分别加入3、5、10、20、50和100μg/mL喹烯酮对照品溶液各50μL,使得样品中喹烯酮终浓度为0.3、0.5、1、2、5和10μg/mL,涡旋1 min混匀,按照1.6项下方法处理,进HPLC分析。记录色谱图和喹烯酮的峰面积,将喹烯酮的峰面积与其浓度作线性回归,得出标准曲线及相关系数。
1.8.4 回收率 取鸡、鸭血浆和空白透析液各450μL,分别加入3、10和20μg/mL喹烯酮对照品溶液50μL,使得样品中喹烯酮终浓度为0.3、1和2μg/mL,涡旋1 min混匀,按照1.6项下方法处理,进HPLC分析,每个浓度制备5个平行样品。根据峰面积计算出喹烯酮的浓度并与喹烯酮添加浓度相比,计算回收率。
1.8.5 精密度及准确度 日内精密度:在同一天内,按照1.8.4项下方法制备低、中、高3个浓度的质控样品,每个浓度制备5个平行样品,测定低、中、高浓度的质控样品间的RSD。
日间精密度:在连续3天内按照1.8.4项下方法,每天连续制备1个分析批次的低、中、高浓度的质控样品,测定低、中、高浓度的质控样品间的RSD,一般RSD应小于15%。
1.8.6 稳定性 按照1.8.4项下方法配制低、中、高3个浓度的质控样品,分别在4、25和37 ℃放置36 h,按照1.6项下方法处理,进HPLC分析,根据峰面积计算喹烯酮的浓度,考察喹烯酮在鸭血浆中的稳定性。
1.9 平衡透析时间的考察
取1 mL空白透析液加入到透析袋中,扎紧袋口,将透析袋置于盛有20 mL含喹烯酮浓度为0.5μg/mL的PBS溶液中,按照1.6项下操作,分别于2、4、12、24、36、48、60和72 h结束试验,测定透析袋内外的QCT浓度,以透析袋内外QCT浓度的比值对时间作图,当QCT浓度比随时间延长而基本不变时表明透析达到平衡。
1.10 透析膜对药物的吸附作用
取1 mL空白透析液加入透析袋中(V1),将透析袋放入装有20 mL (V2)药物浓度为0.5μg/mL (Co)的透析液的离心管中,放入4 ℃恒温培养箱,药物扩散平衡后,测定透析袋外的喹烯酮的浓度(C1),按照公式(2)计算透析袋对喹烯酮的吸附率。
X=[ Co×V2- C1×( V1+ V2)]/ Co×V2×100%。
(2)
1.11 药物浓度对结合率的影响
分别取1 mL的空白鸡鸭血浆若干份加入透析袋中,每份分别置于20 mL含喹烯酮浓度为0.5、1、2、4和8μg/mL透析液中,于4 ℃冰箱静置36 h直至药物扩散平衡。测定袋内血浆中喹烯酮浓度及袋外缓冲液中喹烯酮浓度,按照公式(1)计算喹烯酮血浆蛋白结合率。
2 结果
2.1 测定方法的考察
2.1.1 方法的专属性 图1为QCT对照品溶液HPLC图。由图可知,喹烯酮在该液相色谱图条件下保留时间为4.9 min,色谱图的系统适用性良好。由图2~4可以看出,透析液和血浆中的杂质均在3 min以前出峰,杂质峰不干扰QCT的检测,方法的专属性良好。

图1 喹烯酮对照品溶液HPLC色谱图Fig.1 Chromotogram of QCT standard solution

图2 空白透析液(A)和加标透析液(B)HPLC色谱图Fig.2 Chromotograms of QCT in PBS solution

图3 空白鸭血浆(A)和加标鸭血浆(B)HPLC色谱图Fig.3 Chromotograms of QCT in duck plasma
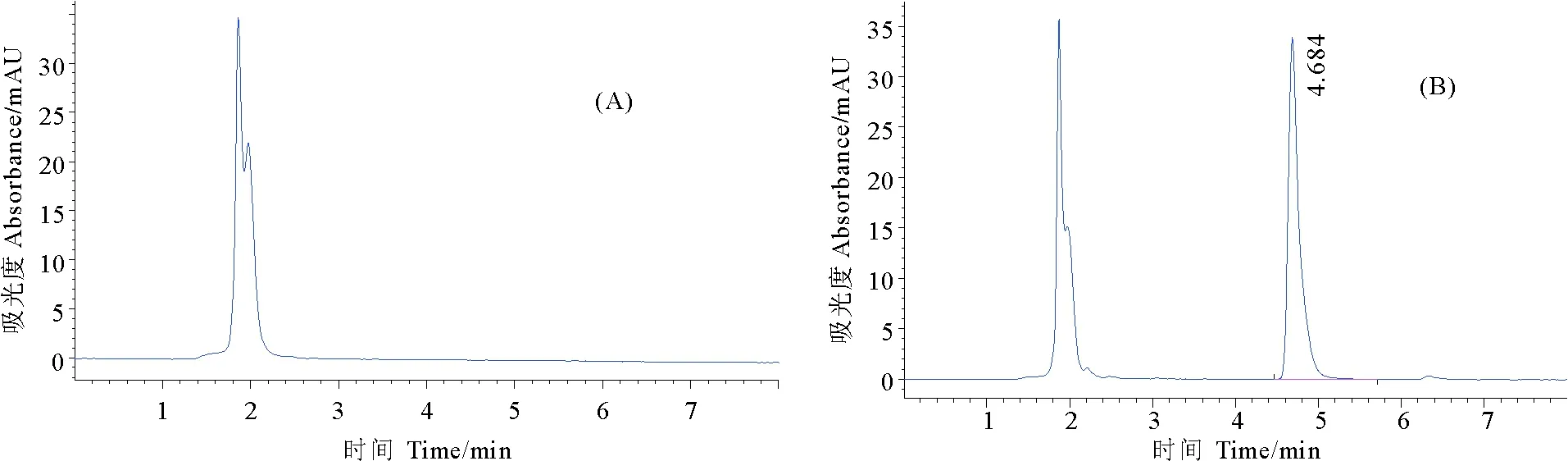
图4 空白鸡血浆(A)和加标鸡血浆(B)HPLC色谱图Fig.4 Chromotograms of QCT in chicken plasma
2.1.2 检测限及定量限 试验可知,QCT在血浆和透析液中的检测限为0.1μg/mL,定量限为0.3μg/mL。
2.1.3 标准曲线 QCT在鸡、鸭血浆和透析液中的标准曲线见表1,结果表明QCT在PBS缓冲液、鸡鸭血浆中线性关系良好,相关系数在0.999 5以上。
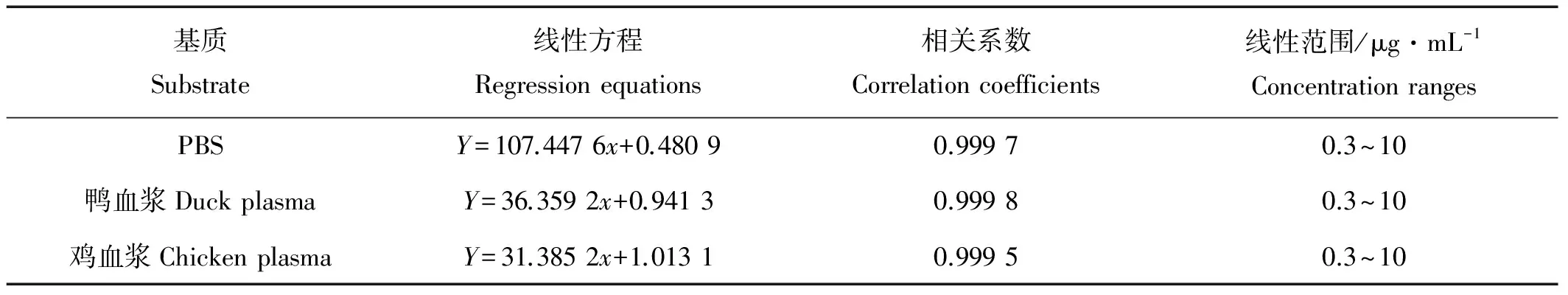
表1 QCT标准工作曲线Table1 Standard curve of QCT
2.1.4 回收率和精密度 经测定,PBS溶液及鸡、鸭血浆样品中的QCT的回收率和精密度见表2。高、中、低浓度的样品平均回收率均能达到85%以上。日内、日间精密度的RSD值均小于5%。表明方法的精密度和准确度良好。
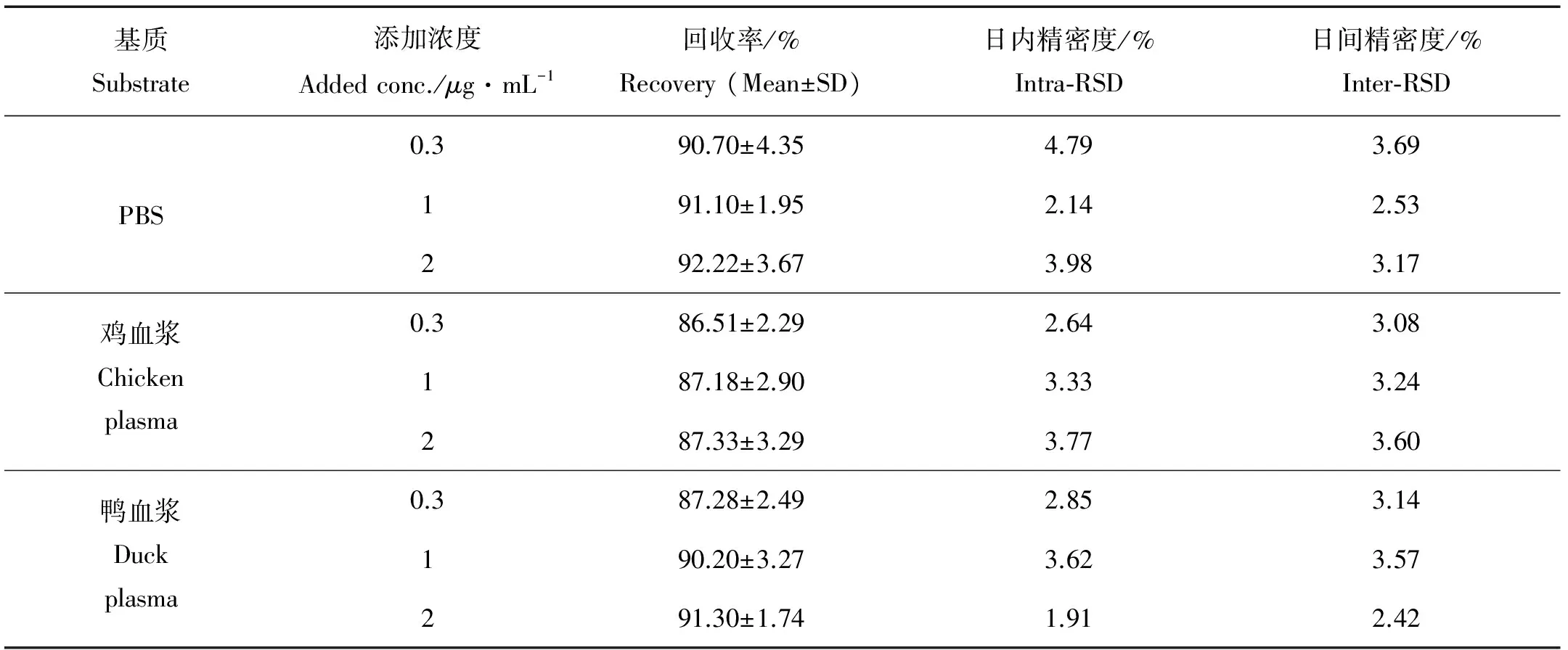
表2 QCT在鸡鸭血浆及PBS中的回收率及精密度
2.1.5 稳定性 从表3可知,低、中、高3个浓度的质控样品,在4 、25和37 ℃放置36 h,损失率小于5.0%,RSD均小于3.5%,结果表明,鸭血浆中喹烯酮在上述条件下36 h内稳定性良好。
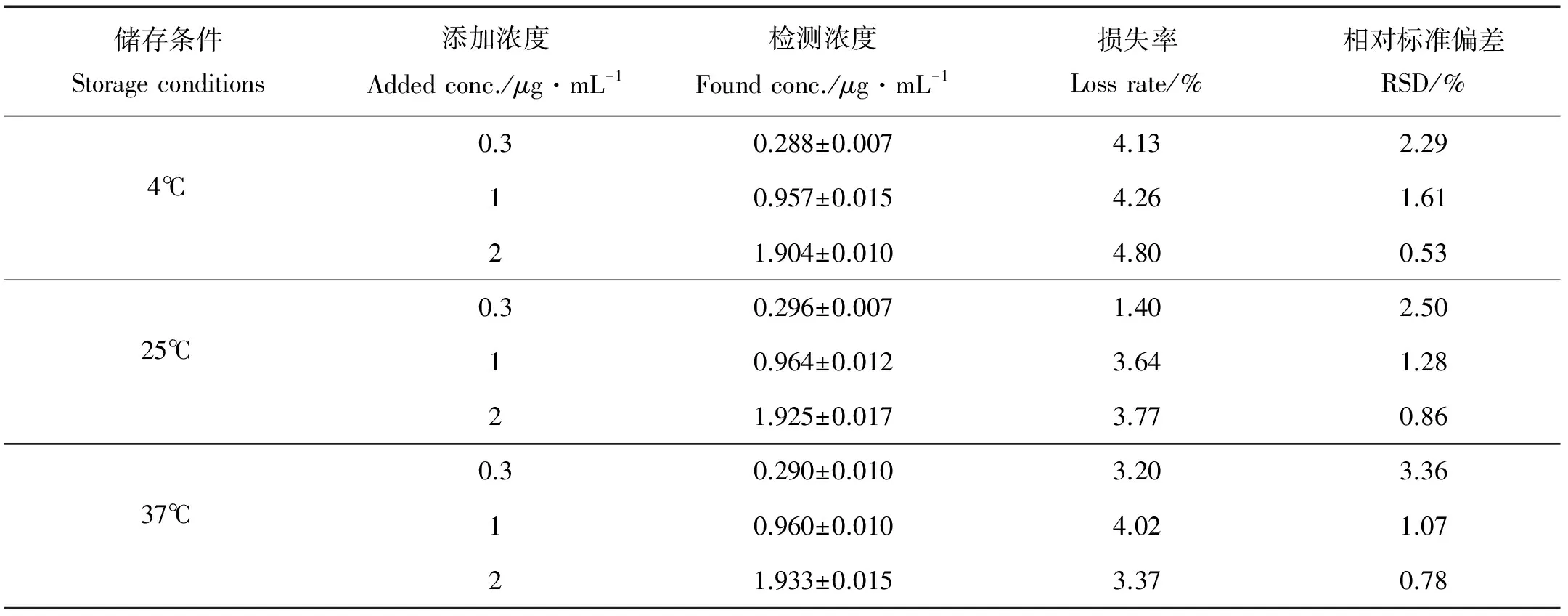
表3 鸭血浆中QCT的稳定性试验结果
2.2 透析平衡时间
以透析袋内外QCT浓度比时间作图,结果见图5,QCT平衡时间约需36 h。

图5 QCT平衡透析时间Fig.5 Equilibration time of QCT
2.3 透析膜对药物的吸附作用
结果表明,低、中、高3个质量浓度下吸附率的结果分别为1.31%、1.46%、0.95 %,透析膜对喹烯酮有少量吸附,但对喹烯酮的检测没有显著影响。
2.4 药物浓度与血浆蛋白结合率
考察了不同浓度喹烯酮与鸡、鸭血浆的蛋白结合率,结果见表4。喹烯酮与鸡鸭血浆蛋白结合率平均分别为40.53%±1.09%和46.88%±1.25%,不同浓度的喹烯酮与鸡鸭血浆蛋白结合率经SPSS软件进行方差分析。结果表明,不同浓度的喹烯酮血浆蛋白结合率不存在显著性差异(P>0.05),蛋白结合呈现非浓度依赖的特性。但鸡、鸭之间的喹烯酮的血浆蛋白结合率经SPSS软件进行方差分析,存在显著性差异(P<0.05),表明喹烯酮血浆蛋白结合率在不同动物种属间存在差异。

表4 不同浓度喹烯酮在鸡、鸭血浆中的蛋白结合率(Mean±SD)(n=3)Table 4 Protein binding rate of QCT in duck and chicken plasma(n=3)
3 讨论
药物血浆蛋白结合率的测定是新药研究开发中必要的项目。目前,血浆蛋白结合率的常见的测定方法有平衡透析法、超滤法、微透析法、超速离心法[8]。虽然测定血浆蛋白结合率的新方法不断出现,但平衡透析法可以最大限度反映体内情况[11],结果可靠,目前仍是一种使用频繁的经典参比方法[11]。本试验参考已有文献中的喹烯酮检测方法[13-14],建立了检测鸡鸭血浆以及PBS溶液中喹烯酮的HPLC方法,喹烯酮在PBS溶液中的平均回收率高于90%,在血浆中的平均回收率高于86%;上述介质中的回收率高于已有文献报道[9],且建立方法的重复性和精密度良好。
采用建立的HPLC方法结合平衡透析法测定了喹烯酮在鸡鸭血浆中的蛋白结合率,喹烯酮平均蛋白结合率在40%~50%之间,属于中等蛋白结合药物,且在实验检测浓度范围内,喹烯酮与蛋白结合呈现非浓度依赖的特点。目前报道的喹烯酮与草鱼血浆蛋白结合率平均为80.5%[9],喹烯酮与三黄鸡血浆蛋白结合率平均为51.6%[10],均高于喹烯酮与白羽肉鸡、樱桃谷肉鸭的血浆蛋白结合率,喹烯酮的血浆蛋白结合率在不同动物种属间存在一定的差异,因此在临床用药时需考虑动物种属及其血浆蛋白结合率的情况合理用药。喹烯酮在草鱼中应用时较易发生血浆蛋白结合介导的药物相互作用,进而导致毒性反应;而在鸡鸭中应用时喹烯酮药物时出现上述相互作用的概率较低。喹烯酮与鸡鸭血浆蛋白结合的测定结果表明喹烯酮大部分以游离形式发挥作用,且不具有浓度依赖性,它可以更有效地穿过细胞膜达到机体作用部位,且游离型药物能通过肾小管排泄出体外,因此喹烯酮在鸡鸭中用药的安全性较高。本文的研究结果对喹烯酮在鸡、鸭的临床联合用药以及体内的药代动力学研究提供参考依据。
[1] Qian C. Investigation of the genotoxicity of quinocetone, carbadox and olaquindox in vitro using Vero cells[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2009, 47(2): 328-334.
[2] Zhao Y, Cheng G, Hao H, et al. In vitro antimicrobial activities of animal-used quinoxaline 1, 4-di-N-oxides against mycobacteria, mycoplasma and fungi[J]. BMC Veterinary Research, 2016, 12(1): 186-189.
[3] Ihsan A, Wang X, Zhang W, et al. Genotoxicity of quinocetone, cyadox and olaquindox in vitro and in vivo[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2013, 59(8): 207-214.
[4] Miao X L, Jin-Shan L I, Jian-Yong L I, et al. Studied the effect of quinocetone on growth performance in broiler chickens[J]. Journal of Animal Science & Veterinary Medicine, 2008, 27(4): 31-32.
[5] 徐善金, 朱永兴. 喹烯酮对肉鸭生长及屠宰性能影响的研究[J]. 饲料广角, 2012(22): 33-34.
Xu S J, Zhu Y X. Studies on the effect of Quinocetone on the growth and slaughter performance of duck[J]. Feed China, 2012(22): 33-34.
[6] 陈权军, 邓岳松, 杜景德. 喹烯酮、牛至油和喹乙醇对肉鸭生长的影响[J]. 饲料工业, 2004, 25(3): 41-42.
Chen Q J, Deng Y S, Du J D. The effect of Quinocetone, Origanum oil, olaquindox on the growth of duck[J]. Feed Industry, 2004, 25(3): 41-42.
[7] Sarre S, Belle K V, Smolders I, et al. The use of microdialysis for the determination of plasma protein binding of drugs[J]. Journal of Pharmaceutical & Biomedical Analysis, 1992, 10(10-12): 735.
[8] Talbert A M, Tranter G E, Holmes E, et al. Determination of drug-plasma protein binding kinetics and equilibria by chromatographic profiling: exemplification of the method using L-tryptophan and albumin [J]. Analytical Chemistry, 2002, 74(2): 446.
[9] 赵凤, 刘永涛, 胥宁, 等. 喹烯酮在草鱼血浆中蛋白结合率的测定[J]. 淡水渔业, 2014, 44(2): 71-76.
Zhao F, Liu Y T, Xu N, et al. Determination of protein binding of Quinocetone with grass carp (Ctenopharyngodon idellus) plasma[J]. Freshwater Fisheries, 2014, 44(2): 71-76.
[10] 李建喜, 杨志强, 王学智, 等. 三种喹喔啉类药物血浆蛋白结合率分析[C]. [s.l.]: 中国畜牧兽医学会兽医药理毒理学分会第十次研讨会论文摘要集, 2009.
Li J X, Yang Z Q, Wang X Z, et al. Analysis of the Plasma Protein Binding Rate of Three Kinds of Quinoxaline [C]. [s.l.]: The Tenth seminar of Institute of Veterinary Pharmacology and Toxicology, 2009.
[11] Sandlad P, Arnell R, Samuelsson J, et al. Approach for reliable evaluation of drug proteins interactions using surface plasma resonance technology[J]. Anal Chem, 2009(9): 3551-3559.
[12] Waters N J, Jones R, Williams G, et al. Validation of a rapid equilibrium dialysis approach for the measurement of plasma protein binding[J]. Journal of Pharmaceutical Sciences, 2008, 97(10): 4586-4595.
[13] Li Y, Gao Z, Dong F, et al. Quantitative determination of quinocetone and its metabolites in chicken plasma by liquid chromatography/tandem mass spectrometry [J]. Journal of Aoac International, 2008, 91(6): 1494.
[14] Yan Y, Liu Y, He L, et al. Simultaneous determination of quinocetone and its major metabolites in chicken tissues by high-performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2013, 919-920(3): 30-37.

