颞叶癫痫患者海马硬化与认知障碍的相关性分析
邬 刚, 马鹏程, 战丽萍, 董小林, 李 杨, 王 婷
认知功能可以被理解为人类各种有意识的精神活动[1],认知障碍主要影响记忆力、注意力、语言能力、判断力及社会行为等功能[2]。疾病严重程度可能与起病年龄、病程、高热惊厥史、发作类型、发作间期异常放电、使用抗癫痫药物等因素有关[3]。海马与认知功能关系密切,TLE反复发作可导致海马硬化(Hippocampal sclerosis,HS),从而影响认知功能[4,5],导致认知障碍。
目前对TLE患者认知功能的评估主要依靠采集患者的病史、症状、体征以及对患者进行认知量表评定,缺乏一定的客观性。氢离子磁共振波谱成像(1H-Magnetic resonance spectroscopy,1H-MRS)技术是目前唯一可对活体脑组织代谢产物进行测量的无创方法,对脑组织的研究已深入到分子水平和组织学水平[6],能对脑组织的N-乙酰天门冬氨酸(N-acetylaspartate,NAA)、胆碱 (Choline,Cho)、肌酸(Creatine,Cr)浓度进行测定,并计算出NAA/(Cho+Cr)值。本研究通过1H-MRS技术对TLE患者海马NAA/(Cho+Cr)值进行测定,详细采集患者起病年龄、病程、高热惊厥史、全面强直阵挛发作(Generalized tonic clonic seizure,GTCS)等相关病史,运用《中国修订版韦氏成人智力量表》和《中国修订版韦氏成人记忆量表》对认知功能进行评测,从而对HS与认知障碍的关系进行研究。
1 资料与方法
1.1 研究对象与入组标准 选取2013年4月-2016年4月间昆明医科大学附属延安医院神经内科门诊及病房就诊的TLE患者共45例,均符合1989年ILAE关于癫痫和癫痫综合征的分类标准中关于TLE的诊断标准[7];简易精神状态检查量表评分大于24分,汉密尔顿抑郁量表<17分,初中以上文化程度;排外头部MRI发现颅内占位、脑血管病和先天发育畸形等异常影像学表现者。并取24例正常人作为对照组。所有患者签署知情同意书,并取得医院伦理委员会讨论同意。
1.2 分组方法 将1H-MRS发现HS的TLE患者纳入研究组1:包括左侧HS 1a组、右侧HS 1b组、双侧HS 1c组;将1H-MRS未发现HS的TLE患者纳入研究组2;正常人作为对照组。
1.3 研究方法
1.3.1 头部MRI检查方法 常规MRI扫描:采用我院医学影像中心Siemens Verio 3.0T磁共振扫描仪,8通道相控阵线圈。各例均行常规头部横断面T1WI、T2WI、液体衰减反转恢复(FLAIR)序列及双侧海马区1H-MRS。MRI成像:自旋回波序列(SE)横断面T1WI;快速自旋回波序列(TSE)横断面T2WI;垂直于矢状位海马长轴的倾斜冠状面TSE序列T2WI。
1.3.2 双侧海马1H-MRS扫描 检查仪器同上,先扫描3D矢状位T1WI序列并重建出横轴位及斜冠状位,利用三平面将感兴趣区(regions of interest,ROI)定位于双侧海马,利用手动匀场,完成发射、接收增益调节匀场和水抑制扫描,在水峰的半高全宽≤5 Hz及水抑制率≥95%的条件下进行化学位移成像中的点分辨自旋回波序列(TR=4300 ms,TE=105 ms),生成ROI的代谢物谱线。所有入组患者扫描条件均一致。图像处理与分析:(1)常规MRI分析:由两名有丰富经验的影像诊断医师对图像进行分析和评价,评价标准包括两侧海马大小、形态是否对称、双侧海马信号是否均匀一致、颞叶有无萎缩、双侧颞角是否对称;(2)1H-MRS分析:选择NAA、Cho、Cr代谢物峰作为研究指标,根据其化合物的峰值下面积记录数据结果并计算NAA/(Cho+Cr)比值。1H-MRS显示NAA/(Cho+Cr)比值低于0.68为HS标准。影像诊断由两名经验丰富副主任共同完成。
1.3.3 认知功能评测 采用湖南医科大学龚耀先[8]修订的中国修订版韦氏成人智力量表及中国修订版韦氏成人记忆量表作为评测工具,由取得测试资格的医师进行测评。受试完后,按照参考手册将各个分测验粗分转化为量表分,再通过查找不同年龄段的智商表,得出并记录患者的智商(fun intelligence quotient,FIQ)和记忆商(memory quotient,MQ)。

2 结 果
2.1 一般资料 研究组1共32例,男15例,女17例,平均年龄(30.16±9.72)岁,平均起病年龄(14.91±6.44)岁,平均病程(11.16±4.73)y,有高热惊厥史18例,病程中泛化GTCS发作21例。研究组1中左侧HS15例,右侧HS10例,双侧HS7例。研究组2共13例,男6例,女7例,平均年龄(31.08±6.19)岁,平均起病年龄(25.77±7.58)岁,平均病程(4.31±2.75)y,有高热惊厥史6例,病程中泛化GTCS发作7例。对照组共24例,男11例,女13例,平均年龄(30±6.33)岁。3组患者在性别、年龄、文化程度上差异无统计学意义(P>0.05)。
2.2 起病年龄、病程、高热惊厥史、GTCS等因素对海马NAA/(Cho+Cr)值的相关性 研究组1患者中,起病年龄越小、病程越长;有高热惊厥史、有GTCS发作患者的海马NAA/(Cho+Cr)值更低,差异有统计学意义(P<0.05)(见表1)。
2.3 起病年龄、病程、高热惊厥史、GTCS等因素对FIQ、MQ的影响 研究组1、2中,起病年龄越小、病程越长;有高热惊厥史、有GTCS发作的TLE患者FIQ、MQ更低,差异有统计学意义(P<0.05)(见表2)。
2.4 对比研究组1、研究组2及对照组的FIQ、MQ 对研究组1、研究组2与对照组FIQ、MQ进行对比,发现FIQ、MQ依次下降,差异有统计学意义(P<0.05)(见表3)。
2.5 研究组1患侧海马NAA/(Cho+Cr)值与FIQ、MQ的相关性 左侧HS患者左侧海马NAA/(Cho+Cr)值与FIQ呈负相关(r=0.745,P<0.05),左侧HS患者左侧海马NAA/(Cho+Cr)值与MQ呈负相关(r=0.648,P<0.05);右侧HS患者右侧海马NAA/(Cho+Cr)值与FIQ呈负相关(r=0.698,P<0.05),右侧HS患者右侧海马NAA/(Cho+Cr)值与MQ呈负相关(r=0.577,P<0.05)。

表1 起病年龄、病程、高热惊厥史、GTCS发作对海马NAA/(Cho+Cr)值的影响
*P<0.05
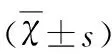
表2 起病年龄、病程、高热惊厥史、GTCS等因素与FIQ、MQ的相关性
*P<0.05
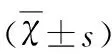
表3 研究组1、研究组2、对照组FIQ、MQ的对比分析
*P<0.05
3 讨 论
癫痫是大脑神经元反复、同步、短暂的异常放电引起的脑功能异常的慢性、发作性疾病。可影响患者执行力、判断力、理解力、计算力、记忆力、语言、注意力等认知功能[9]。80%的癫痫患者存在认知障碍,其中有50%患者认知障碍更为明显[10,11]。参与认知的脑功能区较多,但主要为额叶、颞叶[12,13]。TLE患者的认知障碍与颞叶神经网络连接受损,影响记忆的生成,保存与提取有关[14]。
TLE反复发作造成HS是目前TLE研究领域的共识。海马反复异常放电可导致海马髓鞘溶解并分解、海马细胞水含量增加、中性脂肪被吞噬细胞吞噬、组织中脂类含量逐渐减少,使海马组织变为亲水状态,更易导致细胞胶质细胞增生。NAA由线粒体产生,主要存在于神经元及其前体细胞,其含量的多少反映神经元的数量和功能状态,峰值降低提示神经元细胞减少或功能障碍。Cr和Cho主要存在于神经胶质细胞中,其峰值升高提示胶质增生。因此NAA/(Cho+Cr)值的下降可以作为定性和定量反映病灶内神经元丧失或功能障碍、胶质细胞增生的指标。
本研究首先发现起病年龄越小、病程越长,有高热惊厥史、发作泛化GTCS的患者患侧或双侧海马NAA/(Cho+Cr)值下降更严重,且健测海马NAA/(Cho+Cr)值也会有不同程度下降,这也提示TLE发作期、发作间期海马反复异常放电对海马神经元损害非常明显。随后本研究发现,起病年龄越小、病程越长,认知障碍程度越严重,可能海马早期反复异常放电导致患者脑白质总容量减少有关[15];也可能与海马组织细胞成熟过晚从而导致解剖异常有关[16],这与Inoue K等[17~19]研究结果一致。既往对高热惊厥史与HS形成关系的研究[20,21]发现,儿童期有高热惊厥史的TLE患者更易出现海马损伤,变为TLE的病理基础,从而导致认知功能下降。GTCS发作对患者的影响包括病理生理及日常生活,影响包括:GTCS发作除导致神经元微环境紊乱、神经元丧失、突触联系异常外,可造成神经闭合环路电信号流动受阻,从而使AEDs使用时间延长,患者社会心理功能下降。以上因素直接导致了HS的产生,也间接导致了患者认知功能下降。
本研究对研究组1、研究组2、对照组TLE患者的FIQ、MQ进行对比,发现研究组1、研究组2、对照组患者FIQ、MQ依次减低。伴HS的TLE患者较不伴HS的TLE患者认知功能下降明显,且两者认知功能较对照组均有明显下降,与既往研究[22]相似。造成上述结果的原因可能为癫痫发作间期的反复异常放电引起的脑内神经递质失调及慢性应激状态,从而造成海马持续损伤。目前对HS的进展表明,HS既可以是TLE反复发作的原因,也可以是其结果,神经环路一旦形成,局灶性放电沿着神经网络扩散可累及相关颞叶皮质及边缘系统,引起图形记忆、语词记忆等MQ指数下降,而海马损害本身也可引起远、近记忆功能的损害。同理,起源于颞叶的局灶性放电扩散到相关额叶皮质则出现执行功能、注意力等FIQ异常,随着病程的延长。伴或不伴HS的TLE患者FIQ、MQ均出现不同程度损害,HS患者上述情况更加严重,而研究组1患者海马NAA/(Cho+Cr)值与FIQ与MQ下降程度具有相关性,再次证实海马损伤是引起TLE患者认知障碍的重要因素,与既往研究结果基本相同。
TLE患者的临床诊疗强调早期诊断、早期控制发作、早期评估再发风险,对患者的日常生活能力的评估与干预也尤为重要。1H-MRS检查具有简单、经济、无创、准确等优点,通过对海马NAA/(Cho+Cr)值的评测,结合起病年龄、病程、高热惊厥史、GTCS发作等因素可早期对认知障碍进行评估与干预,为临床合理选择抗癫痫药物治疗、早期添加改善认知障碍药物、改善患者生活质量提供依据。
[1]王湘庆,郎森阳,毛燕玲,等.癫痫患者认知功能损害及其影响因素分析[J].卒中与神经疾病,2006,13(5):273-275.
[2]van Rijckevorsel K.Cognitive problems related to epilepsy syndromes,especially malignant epilepsies[J].Seizure,2006,15:227-234.
[3]张明之,龙发青,许 虹.癫痫及抗癫痫药物对认知功能障碍的影响[J].陕西医学杂志,2008,37(7):885-886.
[4]Hennann BP,Seidenberg M,Dow C,et al.Cognitive prognosis in chronic temporal lobe epilepsy[J].Ann Neurol,2006,60:80-87.
[5]Garcia-Fifiana M,Denby CE,Keler SS,et al.Degree of hippocampal atrophy is related to side of seizure onset in temporal lobe epilepsy[J].AJNR Am J Neuroradiol,2006,27:1046-1052.
[6]Gerez M,Sada A,Tello A.Amygdalar hyperactivity,a fear-related link between panic disorder and mesiotemporal epilepsy[J].Clin EEG Neurosci,2011,42(1):29-39.
[7]Proposal for revised classification of epilepsies and epileptic syndromes.Commission on classification and terminology of the international league against epilepsy[J].Epilepsia,1989,30:389-399.
[8]Gong YX.Wechsler adult intelligence scale-revised in China[M].Changsha:Hunan Map Press,1992.17-32.
[9]Meador KJ.Cognitive outcomes and predictive factors in epilepsy[J].Neurology,2002,58(Suppl 5):21-26.
[10]Berg AT,Caplan R,Hesdorffer DC.Psychiatric and neurodevelopmental disorders in childhood onset epilepsy[J].Epilepsy Behav,2011,20(3):550-555.
[11]Mei J,Li HY.The orrelation analysis and influencing factors of cognitivedysfunction of epilepsy patients[J].Chin J Diffic and Compl Cas,2016,15(5):445-448.
[12]虞培敏,郭起浩,丁 玎,等.癫痫患者认知功能特点的研究[J].中国临床神经科学,2006,14(5):494-500.
[13]Cahn-Weiner DA,Wittenberg D,MeDonahl C.Everyday cognilionin temporal lobe and frontal lobe epilepsy[J].Epileptie Disord,2009,11(3):222.
[14]Wichards WS,Schobben AR,Lenten FS.Pefiopemtive substitutionofantiepileptic drugs[J].J Neurol,2013,260(11):2865-2875.
[15]Hermann B,Seidenberg M,Bell B,et al.The neurodevelopmental impact of childhood-onset temporallobe epilepsy on brain structure and function[J].Epilepsia,2002,43(9):1062-1071.
[16]Meador KJ,Gilliam FG,Kanner AM,et al.Cognitive and behavioral effects of antiepileptic drugs[J].Epilepsy Behav,2001,2(4):1-17.
[17]Inoue K,Suzuki E,Yazawa R,et al.Influence of uridine diphosphate glucuronosyltransferase 2B7-161C>T polymorphism on the concentration of valproic acid in pediatric epilepsy patients[J].Ther Drug Monit,2014,36(3):406-409.
[18]姚晓娟,毓 青,杨一娟,等.额叶癫痫患者执行功能损害及其与P300的相关性分析[J].中华医学杂志,2014,94(7):521-524.
[19]黄从刚,卞红强,罗正利,等.左乙拉西坦和托吡酯治疗癫痫疗效和安全性的系统评价[J].中华神经医学杂志,2014,13(5):499-503.
[20]Cendes F.Febrile seizures and mesial temporal sclerosis[J].Curr Opin Neurol,2004,17(2):161-164.
[21]Lewis DV,Shinnar S,Hesdorffer DC,et al.Hippocampal sclerosis after febrile status epilepticus: the FEBSTAT study[J].Ann Neurol,2014,75(2):178-185.
[22]Oyegblie TO,Dow C,Jones J,et al.The nature and course of neuropsychological morbidity in chronic temporal lobe epilepsy[J].Neurology,2004,62:1736-1742.

