4例进行性核上性麻痹的临床特征分析
魏 丹, 刘金玲, 滕军放
进行性核上性麻痹(progressive supranuclear palsy,PSP)是一种较为常见的非典型帕金森综合征,文献报道日本的患病率为2~17/10万,高于欧美的3.1~6.5/10万的患病率,而我国目前尚无确切的流行病学资料。
进行性核上性麻痹中位发病年龄是65.9岁[1](IOR 60.6~70),平均病程为5~9 y。其特征性的临床表现是发病早期姿势不稳而反复跌倒、轴性肢体强直、运动迟缓、垂直性凝视麻痹、假性球麻痹所致的构音障碍及吞咽困难、皮质下痴呆、睡眠节律紊乱以及对左旋多巴反应差等。大多为散发,与tau蛋白在脑内的过度磷酸化及不同部位的聚集有关,属于tau蛋白病范畴,其病因尚不明确,诊断主要依靠临床表现和磁共振特征,治疗多为对症处理,因此早期诊断显得尤为重要。现将我科收治的4例进行性核上性麻痹进行全面的临床分析,旨在提高神经科医师对其的诊断。
1 临床资料
病例1,患者,男性,66岁,以“身体前倾、走路不稳2 y余,加重伴言语不清3 m”为主诉入院。2 y前,无明显诱因出现走路不稳,身体前倾,骑自行车时向一侧摔倒,就诊于当地医院诊断为“帕金森病”,给予“美多芭1/2片tid”口服,症状进行性加重。半年前,出现不能转身,起立时不能行走,言语含糊,后在我院门诊规律复查,规律用药,现口服“美多芭3/4片tid,盐酸金刚烷胺2粒tid”,症状未见明显缓解。3 m前上述症状加重,伴言语不利,吐字不清。为进一步诊治来我院,门诊以“帕金森叠加综合征”收入我科。神经科查体:神志清,精神可,言语不利,动作迟缓,眼球各方向运动充分,四肢肌力肌张力正常,腱反射亢进,双侧巴氏征阴性,走“一”字不能,冻结步态,抬脚后走路可,以一侧为轴转身,向后跌倒,双上肢联带动作缺乏,小字征阴性。简易精神状况检查量表(MMSE)评分25分。头部磁共振显示(见图1):轻度老年性脑萎缩,中脑轴位示“米老鼠征”,正中矢状位中脑被盖部萎缩呈“蜂鸟征”。
病例2,患者,男性,70岁,以“反应迟钝、行走不稳4 y,加重1 y”为主诉入院。4 y前逐渐出现反应迟钝,记忆力减退,行走不稳,易向后倾倒,伴颈部僵硬、行为异常、言语错乱、迷路等症状,生活不能自理,1 y前症状加重,不能自己行走,四肢僵硬,吞咽困难,逐渐消瘦。为求进一步诊治来我院,门诊以“帕金森综合征”为诊断收入我科。神经查体:意识清,反应迟钝,言语不能,高级智能活动检查不能配合,颈部僵硬后仰,双眼球水平运动充分,垂直运动不配合,双上肢肌力正常,双下肢肌力4级,四肢肌张力增强,腱反射增强,巴氏征阳性,余检查不能配合。外院简易精神状况检查量表(MMSE)评分26分(4 y前),头部磁共振示(见图2):正中矢状位示“蜂鸟征”。予美多芭治疗,症状无明显改善。
病例3,患者,男性,67岁,以“言语不清、行走不稳3 y,加重3 m”为主诉入院;3 y前无明显诱因出现言语不清,饮水呛咳,行走不稳,行走时容易向后摔倒,伴夜间睡眠时尖叫,肢体不自主运动,在当地医院门诊诊断为轻度脑萎缩、高血压病、睡眠呼吸间歇综合征,睡眠时给予呼吸机佩戴治疗,因佩戴呼吸机不适应,基本未应用,目前症状仍存在,间断口服药物治疗,治疗后效果差,3个月前患者上述症状加重,行走时向后摔倒频繁,查头部MRI示:脑梗死、脑萎缩,诊断为帕金森病,给予阿司匹林肠溶片、美多芭口服,治疗效果差。为求进一步治疗来我院,门诊以“帕金森叠加综合征”收住入院。神经查体:意识清楚,语言不清,记忆力、理解力、计算力尚可;眼球位置居中,上视、下视运动不能,咽反射存在,饮水呛咳,伸舌充分,舌尖位置稍偏左,无舌肌萎缩及肌束震颤。四肢肌张力增强。四肢肌力5-级。Romberg征阴性。无不自主运动,蹒跚步态,走“一”字不稳。病理征阴性。头部磁共振示:老年性脑萎缩,正中矢状位示“蜂鸟征”(见图3)。
病例4,患者,女性,85岁,以“肢体僵硬、言语不能4 y”为主诉来我科门诊就诊。4 y前逐渐出现姿势不稳、肢体僵硬、颈部强直后仰、吞咽困难、言语不能等症状,病情进展,不能行走,轮椅推入我科门诊。神经查体:神志清,言语不能,眼球上下凝视麻痹,颈部强直,四肢肌张力增高,肌力4级,病理征阴性。外院头部磁共振示:老年性脑萎缩,中脑轴位示“米老鼠征”,正中矢状位示“蜂鸟征”。
综上可见,4例患者发病年龄均大于63岁,早期姿势不稳是共同表现,反复跌倒、眼球凝视麻痹是进行性核上性麻痹最常见的临床表现,其他临床特征还有轴性肌强直、步态异常、假性球麻痹认知障碍等。

图1 病例1可见中脑横断面“米老鼠征”和正中矢状位“蜂鸟征”
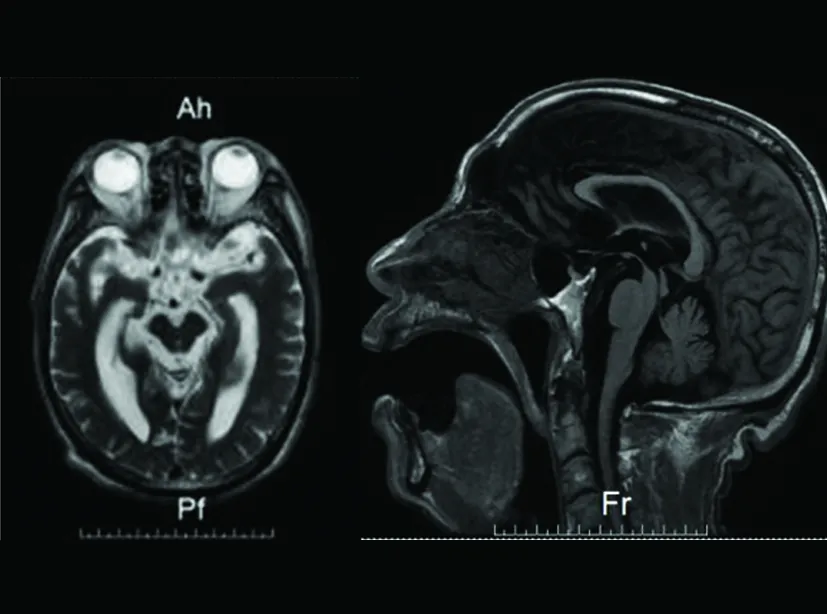
图2 病例2可见中脑横断面“米老鼠征”和正中矢状位“蜂鸟征”
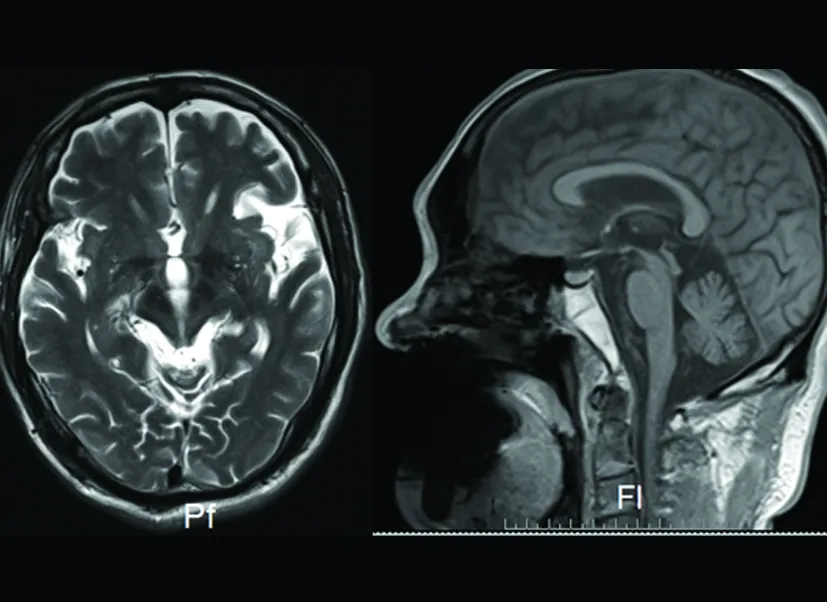
图3 病例3可见中脑横断面“牵牛花征”和正中矢状位“蜂鸟征”
2 讨 论
1964年Steele、Richardson及Olszeski首次对进行性核上性麻痹进行了病理特征的描述,称为理查森综合征。随着研究的深入,PSP的临床表现变异性很大,目前进行性核上性麻痹被分为7种临床表型,包括常见的PSP理查森型(PSP-Rixhardson’syndrome,PSP-RS)、PSP帕金森综合征型(PSP-Parkinsonism,PSP-P)及少见的PSP纯少动伴冻结步态型、PSP皮质基底节综合征型、PSP非流利变异型原发性进行性失语、PSP小脑共济失调型、PSP行为变异型额颞叶痴呆。
PSP是一种tau蛋白病(taupathy),病理上可见丘脑底核、脑干(尤其是中脑被盖部)以及小脑上脚萎缩、黑质脱色等表现,镜下可见在基底节、间脑和脑干有tau蛋白病理性聚集形成的神经元纤维缠结、线性神经纤维网结构、丛状星形细胞以及少突胶质细胞螺旋小体等结构[2~4]。PSP的各种临床变异型反映了病理性tau蛋白不同的解剖分布,但是它们与理查森型在组织病理学、生化学、遗传学方面具有共同的特征。
PSP特征性的临床表现为垂直核上性眼肌麻痹、严重的姿势不稳伴早起跌倒、假性球麻痹、中轴性肌张力增高、对称性多巴对抗的运动不能及认知功能障碍等。国外的人口统计学资料显示,本病的发病年龄是61~67.2岁,性别无明显差异。也有认为PSP男性患者中更常见[5],进行性核上性麻痹的诊断时间通常在发病2.2~4.7 y,从发病到死亡病程约7 y。因此神经科医师只有很短的时间去治疗甚至延缓病情进展及治疗并发症。早期诊断就显得尤为重要。
尽管未被纳入我国诊断标准,前驱型PSP阶段现被广泛提及,此阶段是指虽无临床症状但有高度发展为进行性核上性麻痹的风险,这个阶段的神经病理改变只能在尸检时确认,在一项基于社区的尸检研究中,233人中有5人有PSP神经病理改变[6],另有两项类似的研究。这表明,PSP的发病率应高于流行病学数据,同样也说明,有一部分前驱型PSP最终未发展为临床阶段。
在发病早期,运动症状是最频繁描述的,主要表现为姿势不稳,反复跌倒,不对称起病只有11.6%[7]。有文章认为,早期出现精神心理症状有44.2%,但我科收治的4例病例中,只有1例有明确的精神心理问题,低于此比例,不能排除医师及亲属对精神心理问题的忽视,尤其是其他更严重的症状更易被关注,因此也提醒神经科医师进行全面细致的神经系统查体,当患者不能配合时,详尽的病史显得尤为重要。姿势不稳和反复跌倒更多见于病程1 y内,进行性核上性麻痹多表现为向后跌倒,这可能是由于眼-前庭功能障碍、躯干僵直、转身时不便重叠导致。有别于帕金森病背驮姿势,PSP呈典型的轴性肌强直,主要表现为身体笔直伴颈后仰的特殊体姿(如病例2、4)。在发病早期,眼球凝视麻痹比较少见,多在病程2 y后出现,病例1发病2 y余无眼球凝视麻痹,因此被一直误诊为帕金森病。假性球麻痹常见构音障碍、吞咽困难、咽反射亢进等,其发生常常先于凝视麻痹。还可伴腱反射亢进、巴氏征阳性等表现。PSP的认知功能障碍以皮质下痴呆为特征[3],表现为健忘、思维缓慢、抑郁以及执行功能减退。PSP的步态异常主要表现为冻结步态,这个特征可以和其他类型的神经退行性疾病鉴别,是PSP早期诊断的一个重要标志。当前研究显示,PSP患者的冻结步态有3种表现形式:(1)伴或不伴对称性帕金森症状的冻结步态;(2)所有首次主诉有冻结步态的PSP患者至少有另外一种核心症状;(3)冻结步态不仅仅见于PSP[8~11]。
有研究发现,较晚的发病年龄,早期出现的吞咽困难,认知障碍和行为不能,预示着进行性核上性麻痹更短的生存期[7],尤其是典型的理查森型[12]。相较于其他类型的神经退行性疾病,PSP晚期更容易出现行为不能,超过一半的患者在发病4 y后会发展为行为不能,无自主行为能力,依赖轮椅及他人照顾,极大的增加了家庭负担,我们收治的病例2与病例4即是如此。
进行性核上性麻痹以病理诊断为“金标准”,尚缺乏客观的临床生物学标志。目前,对临床诊断的PSP,除典型症状外,还需要磁共振特征性的表现。即正中矢状位T1WI MRI:(1)表现为以中脑萎缩为主的特征性征象:中脑被盖上缘平坦及蜂鸟征;(2)核磁共振帕金森综合征指数(magnetic resonance parkinsonism index,MRPI)=脑桥与中脑面积比值×小脑中脚/小脑上脚宽度比值>13.55;(3)中脑和脑桥长轴的垂直线比值<0.52或中脑长轴垂直线<9.35 mm[13]。
4例病例中,头部磁共振正中矢状位T1WI MRI均表现为典型的蜂鸟征(hummingbird sign),即中脑顶盖、被盖部萎缩明显,中脑嘴变尖,使中脑、脑桥和小脑整体上形似“蜂鸟”(见图1~图3)。在中脑横断面上见脚尖池变宽、导水管扩张、中脑前后径变短,呈“米老鼠征(mickey mouse sign)”(见图1、图2),同时,由于中脑被盖部外侧缘凹陷,也可表现为“牵牛花征(morning glory flower signs)”(见图3)[14]。
近年来,各种先进的MRI检测技术如磁共振弥散张量成像(DTI)、弥散张量显微成像跟踪技术(DTT)、基于体素的MRI形态测量法(VBM)及功能磁共振(fMRI)等已经开始应用于PSP以及其他运动障碍疾病的诊断和鉴别诊断中[15]。另外,18FDG-PET显示,PSP患者的额叶大脑皮质、尾状核、中脑、丘脑基础代谢率减退[16]。但由于价格昂贵,目前临床应用仍不广泛。
PSP目前仍无特殊有效治疗,临床上,医生一般根据经验,给予个体化治疗。PSP涉及多种神经递质受损,采用神经递质替代疗法是临床治疗的基础,美多芭是常用药物,但PSP-RS对多巴反应效果差。近年来,随着对PSP发病机制研究的深入探讨,一些新的治疗药物,如线粒体功能稳定药物、tau蛋白激酶抑制剂、tau蛋白聚集抑制剂以及微管稳定剂等正在研发或已开始临床试用[17]。PSP后期主要为对症治疗及康复功能锻炼以改善生存质量,延长生存时间。
:[1]Arena JE,Weigand SD,Whitwell JL,et al.Progressive supranuclear palsy:progression and survival[J].Journal of Neurology,2016,263(2):380-389.
[2]Dickson DW,Ahmed Z,Algom AA,et al.Neuropathology of variants of progressive supranuclear palsy[J].Current Opinion in Neurology,2010,23(4):394-400.
[3]Dickson DW,Rademakers R,Hutton ML.Progressive supranuclear palsy:pathology and genetics[J].Brain Pathology,2007,17(1):74-82.
[4]Stamelou M,de Silva R,Arias-Carrion O,et al.Rational therapeutic approaches to progressive supranuclear palsy[J].Brain:a Journal of Neurology,2010,133(6):1578-1590.
[5]Santacruz P,Uttl B,Litvan I,et al.Progressive supranuclear palsy:a survey of the disease course[J].Neurology,1998,50(6):1637-1647.
[6]Kovacs GG,Milenkovic I,Wohrer A,et al.Non-Alzheimer neurodegenerative pathologies and their combinations are more frequent than commonly believed in the elderly brain:a community-based autopsy series[J].Acta Neuropathologica,2013,126(3):365-384.
[7]dell'Aquila C,Zoccolella S,Cardinali V,et al.Predictors of survival in a series of clinically diagnosed progressive supranuclear palsy patients[J].Parkinsonism & Related Disorders,2013,19(11):980-985.
[8]Compta Y,Valldeoriola F,Tolosa E,et al.Long lasting pure freezing of gait preceding progressive supranuclear palsy:a clinicopathological study[J].Movement Disorders:Official Journal of the Movement Disorder Society,2007,22(13):1954-1958.
[9]Factor SA.The clinical spectrum of freezing of gait in atypical parkinsonism[J].Movement Disorders:Official Journal of the Movement Disorder Society,2008,23(Suppl 2):431-438.
[10]Factor SA,Higgins DS,Qian J.Primary progressive freezing gait:a syndrome with many causes[J].Neurology,2006,66(3):411-414.
[11]Williams DR,Holton JL,Strand K,et al.Pure akinesia with gait freezing:a third clinical phenotype of progressive supranuclear palsy[J].Movement Disorders:Official Journal of the Movement Disorder Society,2007,22(15):2235-2241.
[12]O'Sullivan SS,Massey LA,Williams DR,et al.Clinical outcomes of progressive supranuclear palsy and multiple system atrophy[J].Brain:a Journal of Neurology,2008,131(5):1362-1372.
[13]中华医学会神经病学分会帕金森病及运动障碍学组.中国进行性核上性麻痹临床诊断标准[J].中华神经科杂志,2016,49:4.
[14]Stamelou M,Knake S,Oertel WH,et al.Magnetic resonance imaging in progressive supranuclear palsy[J].Journal of Neurology,2011,258(4):549-558.
[15]Gardner RC,Boxer AL,Trujillo A,et al.Intrinsic connectivity network disruption in progressive supranuclear palsy[J].Annals of Neurology,2013,73(5):603-616.
[16]Zalewski N,Botha H,Whitwell JL,et al.FDG-PET in pathologically confirmed spontaneous 4R-tauopathy variants[J].Journal of Neurology,2014,261(4):710-716.
[17]Boxer AL,Yu JT,Golbe LI,et al.Advances in progressive supranuclear palsy:new diagnostic criteria,biomarkers,and therapeutic approaches[J].The Lancet Neurology,2017,16(7):552-563.

