谷子ABC转运蛋白基因与抗旱关系的研究
张瑞杰,王喆,连卜颖,郭展,魏东,于世慧,李红英,2,3*,刘晓东
(1.山西农业大学 农学院,山西 太谷 030801;2.农业部黄土高原作物基因资源与种质创制重点实验室,山西 太原 030031;3.杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太谷 030801;4.山西省农业科学院 作物科学研究所,山西 太原 030031)
谷子(Setariaitalica),禾本科,狗尾草属,是中国传统的粮食作物,距今已有7500多年的栽培历史[1]。研究表明,谷子具有丰富的营养价值,各种成分均衡、饲草蛋白含量高,且具有很高的水分利用效率、抗旱耐瘠、适应性广等突出特点[2~4]。因此,谷子在我国农业生产中占有举足轻重的地位。在中国,谷子主要分布在北方黄河流域中上游的干旱、半干旱地区。由于地区性降水不均,大部分区域降水较少,干旱成为制约谷子品质与产量提高的主要问题[5]。因此,选育抗旱能力强,适应范围广的谷子品种是目前育种的主要方向之一。
ABC转运蛋白(ATP-binding cassette transporters)是一类跨膜蛋白,广泛存在于自然界生物体中,是目前已知最大、最古老的蛋白家族之一[6],在植物的抗逆胁迫中发挥着重要作用。已有研究证实ABC转运蛋白广泛参与植物的抗逆反应[7],如浮萍中的PDR基因SpTUR2受干旱、ABA、低温和盐的诱导表达[8];拟南芥中AtABCG40基因的表达能够促进植物的抗旱能力以及对金属铅的耐受力[9];在拟南芥中AtABCG36基因过表达可以提高植株对干旱与盐胁迫的抗性,参与植物的抗旱反应[7];AtABCC5、AtABCG31通过调节气孔开闭,增强植物的抗逆性[10,11];水稻中的OsABCG36基因可以对干旱、ABA等胁迫做出应答反应[8];在高盐、干旱等逆境条件下,水稻ABCB基因家族中均有表达[12];小麦中的TaPDR1基因参与植物抗病防御反应[13]。
目前拟南芥、水稻ABC转运蛋白的研究较多,分别有129个和128个ABC转运蛋白基因被发掘[14],而谷子中关于ABC转运蛋白的研究相对较少,对ABC转运蛋白基因与谷子抗旱关系的研究更是微乎其微。为了更好地了解ABC转运蛋白与谷子抗旱的关系,本文根据PEG胁迫处理下的抗旱品种(GG)和干旱敏感品种(JF)的转录组数据,分析了两个品种中与干旱相关的ABC转运蛋白基因的基本信息和表达情况,并利用生物信息学方法,进一步分析了起始密码子上游1 500 bp的启动子顺式作用元件,并构建进化树比较这些基因亲缘关系的远近。初步了解谷子ABC转运蛋白基因与谷子抗旱的关系,并推测Seita.7G176000.1可能是谷子抗旱候选基因,研究结果为后续该蛋白基因的功能鉴定和研究奠定理论基础。
1 材料与方法
1.1 试验材料
研究材料为抗旱品种勾勾母鸡咀(GG)和干旱敏感品种晋汾16(JF16),由山西农业大学提供。将谷子幼苗置于人工气候室,14 h光照28 ℃/10 h黑暗23 ℃培养,出苗后每3天浇一次蒸馏水,培养3周后,釆用20% PEG-6000干旱处理0.5 h,用蒸馏水处理相同时间做对照,每个处理随机选取3株用于RNA提取,进行表达谱测序。
1.2 研究方法
利用Phytozome v 11.0豫谷1号基因组数据库(https://phytozome.jgi.doe.gov/pz/portal.html)进行关键词搜索,获取谷子ABC转运蛋白基因的基本信息;利用网站http://web.expasy.org/compute_pi/在线预测蛋白质分子量和理论等电点理化性质;利用MEGA 7.0进行氨基酸序列比对,构建系统进化树;利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析启动子顺式元件。
2 结果与分析
2.1 谷子ABC转运蛋白基因基本信息及理化性质分析
通过Phytozome v 11.0豫谷1号基因组数据库获取了谷子ABC转运蛋白基因信息并通过网站http://web.expasy.org/compute_pi/在线预测蛋白质分子量和理论等电点,结果如表1所示。4个ABC转运蛋白基因分布在3条不同的染色体上,分别位于1,5,7号染色体的不同位点。不同的基因其基因组序列有很大区别,最长为9 254 bp,而最小的只有3 384 bp;Seita.5G185300.1蛋白最长有1 447个氨基酸,Seita.1G086300.1蛋白最短有457个氨基酸,相对应的蛋白分子量范围在51 195.75~161 579.13Da之间,CDS序列长度在1 374~4 344 bp之间;等电点预测发现,除Seita.1G039400.1的等电点为6.81显酸性外,其他3个基因均显碱性。

表1 谷子部分ABC转运蛋白基因基本信息Table 1 Basic information of some ABC transporter protein genes in foxtail millet
使用GSDS2.0对ABC转运蛋白基因进行基因组结构绘制,结果如图1所示。除Seita.1G086300.1没有内含子以外,其他3个均含有内含子和外显子结构,其中Seita.1G039400.1内含子数目最多(Seita.1G039400.1)为18个,Seita.5G185300.1和Seita.7G176000.1都含有8个内含子;Seita.5G185300.1有较长的上游序列,而Seita.7G176000.1有较长的下游序列。

图1 谷子ABC转运蛋白基因内含子-外显子结构Fig.1 Intron-exonstructures of ABC translocation protein genes in foxtail millet
2.2 谷子ABC转运蛋白基因与其他植物ABC抗逆相关基因系统进化树分析
利用MEGA7.0对4个谷子ABC转运蛋白基因及5个其他植物ABC抗逆相关基因进行系统进化树分析,比较其亲缘关系的远近(图2)。从图2可以看出,Seita.1G039400.1和Seita.7G176000.1亲缘关系最近,其次与AtABCC5亲缘关系较近;Seita.1G086300.1与AtABCG36和AtABCG31亲缘关系较近。
2.3 谷子ABC转运蛋白基因启动子元件分析
谷子ABC基因中与干旱胁迫相关的元件主要有脱落酸响应元件ABRE、水杨酸响应元件TCA-element、热胁迫响应元件HSE、低温响应元件LTR、胁迫响应元件TC-rich repeats以及MYB元件等。以豫谷1号序列为参照,选取起始密码子上游1 500 bp序列为启动子区,利用PlantCARE在线分析这4个ABC转运蛋白基因启动子区元件。将启动子顺式元件归类,进行统计分析(表2)。结果显示,不同基因的调控元件总数不同,Seita.1G039400.1基因的顺式调控元件最多,高达75个,Seita.5G185300.1基因最少,含有51个顺式调控元件;其中只有Seita.1G086300.1基因含有ABRE调控元件,只有Seita.1G039400.1 基因含有水杨酸响应调控元件;Seita.1G039400.1 基因所含的茉莉酸甲酯响应元件最多,高达8个;此外,在这4个ABC转运蛋白基因中,启动子区均含MYB元件,MYB属于转录因子,与干旱、ABA的诱导表达有关。
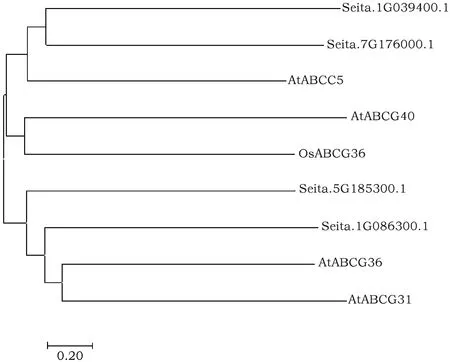
图2 谷子ABC转运蛋白基因与其他植物ABC抗逆相关基因系统进化树分析Fig.2 Phylogenetic tree analysis of ABC translocation protein genes in foxtail millet and ABC tolerance genes in other plants

表2 谷子部分ABC蛋白基因启动子顺式元件预测Table 2 Predicted cis acting elements of partial ABC transporter protein in foxtail millet
注:以上数据不包括基本启动子元件TATA-box和CAAT-box。
Note:The data does not include the basic promoter elements such as TATA-box and CAAT-box.
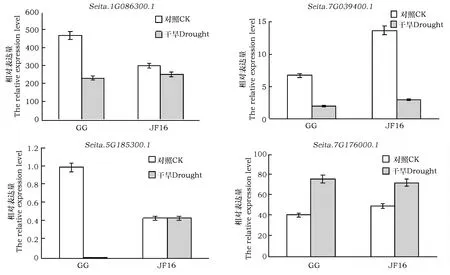
图3 GG和JF16 ABC转运蛋白基因的表达水平Fig.3 Expression levels of expansin ABC transporter genes in GG and JF16
2.4 谷子ABC转运蛋白基因在干旱胁迫下的表达模式分析
用20% PEG-6000模拟干旱胁迫,处理抗旱品种勾勾母鸡咀(GG)和干旱敏感品种晋汾16(JF16),对其ABC转运蛋白基因进行表达谱分析。
由图3可见,GG和JF16基因组中有4个基因(Seita.1G086300.1、Seita.1G039400.1、Seita.5G185300.1、Seita.7G176000.1)均表达。2个品种的Seita.1G086300.1基因在正常浇水与干旱胁迫下均有表达。正常浇水情况下,抗旱品种GG的表达量高于干旱敏感品种JF16;干旱胁迫下,这两个品种的表达量均下调,且GG下调幅度较JF16高。正常浇水情况下,干旱敏感品种JF16的Seita.1G039400.1的表达量高于抗旱品种GG;干旱胁迫下,2个品种的Seita.1G039400.1的表达量均下调,且JF16下调幅度较GG高。在干旱胁迫下,Seita.5G185300.1基因在抗旱品种GG中不表达,但在正常浇水情况下表达水平上调;JF16的Seita.5G185300.1基因在正常浇水与干旱胁迫下都表达,且无明显差异。JF16的Seita.7G176000.1 基因在正常生长条件下表达水平较GG高;在干旱胁迫后表达水平都上调,且GG上调幅度较JF16高。
3 结论与讨论
干旱严重影响着作物的品质与产量[5],谷子作为抗旱作物,研究其抗旱机理对于选育抗旱新品种具有重要的意义。本文通过对谷子中ABC转运蛋白基因进行生物信息学分析以及表达谱分析,初步探讨ABC转运蛋白基因与谷子抗旱的关系。
ABC转运蛋白是植物中重要的抗逆蛋白。通过分析谷子中编码ABC转运蛋白的基因序列,发现其启动子序列中含有许多抗逆相关的元件,如脱落酸响应元件ABRE、水杨酸响应元件TCA-element、热胁迫响应元件HSE、低温响应元件LTR、胁迫响应元件TC-rich repeats以及MYB元件等。谷子具有抗旱耐瘠的特性,结合实际情况,推测其可能参与谷子抗旱调节。
ABRE是ABA合成时所需要的相关元件,ABA与抗旱息息相关。试验发现Seita.1G086300.1含有的ABRE元件最多,另外,系统进化树表明Seita.1G086300.1基因与AtABCG36和AtABCG31亲缘关系较近,已有研究表明在拟南芥中AtABCG36基因的过表达可以提高植株对干旱与盐胁迫的抵抗能力,参与植物的生物胁迫[7]。但是在表达谱分析中,抗旱品种GG在20%PEG处理后Seita.1G086300.1表达量下降,与启动子分析结果以及系统进化树结果不一致。这可能是因为该基因上游含有其他负调控转录因子,使得GG在干旱胁迫处理中Seita.1G086300.1基因表达量下降,有待进一步证实。20%PEG胁迫下(同正常浇水相比),Seita.7G176000.1 基因在抗旱品种GG中表达水平的上调幅度显著大于干旱敏感品种JF16,系统进化树中,Seita.7G176000.1 基因与AtABCC5亲缘关系较近。这可能是由于抗旱品种中Seita.7G176000.1基因的高水平表达,促使植物调节气孔开闭,提高对干旱的抵抗能力,该结果与赵胡等人的研究结果是一致的[10]。
综上所述,本研究通过对谷子ABC转运蛋白基因进行生物信息学分析,并分析干旱处理下其表达情况,初步了解ABC转运蛋白基因与谷子抗旱的关系,并推测Seita.7G176000.1 ABC转运蛋白基因可能为谷子抗旱候选基因,研究结果为进一步探究ABC转运蛋白基因在谷子响应干旱胁迫过程中的作用提供依据。
[1] Doust A N,Kellogg E A,Devos K M,et al.Foxtail millet:a sequence-driven grass model system[J].Plant Physiology,2009,149(1):137-141.
[2] 李顺国,刘猛,赵宇,等.河北省谷子产业现状和技术需求及发展对策[J].农业现代化研究,2012,33(3):286-289.
[3] 张海金.谷子在旱作农业中的地位和作用[J].安徽农学通报,2007,13(10):169-170.
[4] 柴岩.中国小杂粮产业发展报告[M].北京:中国农业科学技术出版社,2007:32-43.
[5] 张锦鹏.谷子在干旱逆境中差异表达基因的分离与表达谱分析[D].北京:中国农业大学,2006.
[6] Verrier P J,Bird D,Burla B,et al.Plant ABC proteins-a unified nomenclature and updated inventory[J].Trends in plant science,2008,13(4):151-159.
[7] 邵若玄,沈忆珂,周文彬,等.植物ATP结合盒(ABC)转运蛋白研究进展[J].浙江农林大学学报,2013,30(5):761-768.
[8] Nagy R,Grob H,Weder B,et al.The Arabidopsis ATP-binding cassette protein At MRP5/AtABCC5 is a high affinity inositol hexakisphosphate transporter involved in guard cell signaling and phytate storage[J].Journal of Biological Chemistry,2009,284(48):33614-33622.
[9] Kang J,Hwang J U,Lee M,et al.PDR-type ABC transporter mediates cellular uptake of the phytohormone abscisic acid[J].Proceedings of the National Academy of Sciences,2010,107(5):2355-2360.
[10] 赵胡,李裕红.植物ABC转运蛋白研究综述[J].海峡科学,2012(2):13-16.
[11] Galbiati M,Simoni L,Pavesi G,et al.Gene trap lines identify Arabidopsis genes expressed in stomatal guard cells[J].Plant Journal for Cell and Molecular Biology,2008,53(5):750-762.
[12] 徐杏,邱杰,徐扬,等.水稻ABCB转运蛋白基因的分子进化和表达分析[J].中国水稻科学,2012,26(2):127-136.
[13] Shang Y,Xiao J,Ma L L,et al.Characterization of a PDR type ABC transporter gene from wheat (Triticumaestivum,L.)[J].Chinese Science Bulletin,2009,54(18):3249-3257.
[14] Schulz B,Kolukisaoglu H Ü.Genomics of plant ABC transporters:the alphabet of photosynthetic life forms or just holes in membranes[J].Febs Letters,2006,580(4):1010-1016.

