玉米籽粒容重QTL定位
郭晋杰,陈景堂
(河北农业大学农学院/国家玉米改良中心河北分中心/河北省作物种质资源实验室,河北 保定 071000)
玉米的容重是国际玉米商品品质的衡量指标。郭淑春等[1]研究表明,不论是什么品种,也不论是哪种粒型,玉米容重都与营养成分成正比,尤其是蛋白质含量,其容重随着蛋白质含量的增加呈上升趋势。所以,容重是最能体现玉米成熟度的指标。为使玉米的商品品质与国际接轨,我国于1999年制定了新的玉米定等标准,以容重作为衡量玉米商品品质好坏的标准。外观品质与容重极显著正相关,籽粒成熟度和饱满度好、角质率高、色泽纯正的品种容重等级高[2]。品种的遗传特性是造成不同类型玉米品种间品质差异的主要原因,不同类型玉米品种的粗蛋白、粗脂肪、粗淀粉、赖氨酸含量、籽粒容重及其产量差异达显著水平[3]。因此,探讨容重的遗传机制具有重要意义。
生物的不同性状之间存在广泛的表型和生理相关。Tuberosa等认为,QTL分析的手段为阐明性状间的相关提供了有用的信息,并提出了性状相关可能存在的4 种原因:(1)控制不同性状的两个基因紧密连锁,分布在染色体的相同或相邻区域;(2)同一个单一功能的基因,对一系列的基因起调控作用;(3)同一个基因能独立控制两个或多个不同的性状;(4)两个紧密连锁的基因同时控制不同的性状[4]。玉米容重是受多基因控制的数量性状,其遗传基础复杂。近年来,随着分子生物学的快速发展,有关玉米穗部性状的基因定位进展也非常迅速,穗部产量性状、株型性状等已经进行多次定位,并获得大量QTLs,而关于玉米容重的QTL定位并不多见。彭勃以齐319×黄早四(Q/H)和掖 478×黄早四(Y/H)构建的两个F2∶3群体为材料,共检测到18个加性QTLs,并且包括1个环境钝感型的QTL,这些QTLs分布于第1、3、4、5、7、8、10条染色体上,其中第1条染色体上6个,第3条1个,第4条5个,第5条1个,第7条1个,第8条2个,第10条2个[5]。本研究以优良自交系农系531和航天诱变后的农系531作亲本构建F2∶3群体为试验材料,采用SSR分子标记构建连锁图谱,利用完备区间作图法(ICIM)对容重进行定位,通过对同一材料的加性QTLs和上位性QTLs进行检验、分析,为挖掘控制玉米容重的主效QTL提供理论依据。
1 材料与方法
1.1 试验材料
以野生型农系531(NX531)为母本、航天诱变后的纯合农系531(M-NX531)为父本构建含有163个家系的F2∶3群体为试验材料。NX531和M-NX531均由河北农业大学国家玉米改良分中心提供。
1.2 田间试验设计
2010年将未诱变亲本NX531与已自交纯化的诱变材料M-NX531进行夏播,杂交后获得 F1代植株和F2代种子;同年于海南进行加代繁殖F2,F2群体单株严格自交获得F2∶3群体,以此为材料进行覆盖全基因组、多态性良好的分子标记引物的筛选。2012年在邯郸农科院试验田进行F2种子的夏播,对F2单株进行严格自交获得F2∶3群体,共163个家系,以此为材料进行性状测定并完成QTL定位。试验采用随机区组设计,2次重复,行长4 m,行宽60 cm,株距25 cm。田间管理标准同普通生产大田一致。
1.3 性状测定
待玉米果穗成熟后,取中间的连续5穗收获,晒干后进行室内考种,脱粒后用容重器测定容重[6]。对所得数据整理后进行正态性检验,并进行方差分析和广义遗传力的计算[7]。广义遗传力的计算公式为:
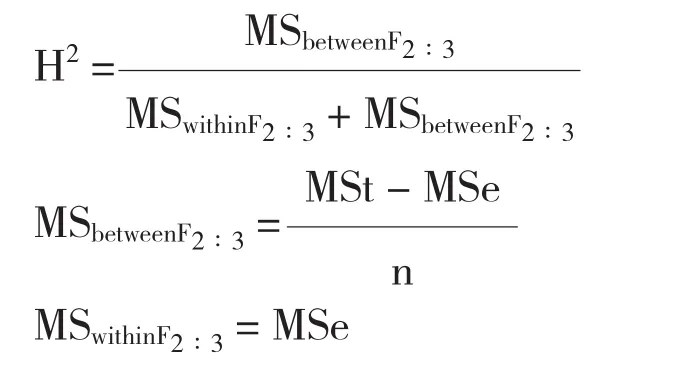
式中,MSbetweenF2∶3为基因型方差,MSwithinF2∶3为环境方差,MSt为家系间方差,MSe家系内方差。
1.4 SSR分析和QTL分析
在苗期分别剪取P1、P2、F1、F2 单株叶片,采用CTAB法抽提叶片DNA[8];参照IBM2 2005 Neighbors 2中发表的SSR分子标记(http// www.maizegdb.org),选择均匀覆盖玉米全基因组的964对引物,在NX531与M-NX531亲本间进行亲本多态性的筛选,挑选能够覆盖全基因组、多态性良好的分子标记[9-10],共获得了亲本间多态性良好的分子标记107对,以此进行作图群体标记带型数据采集,用于连锁图谱的构建和各性状的QTLs分析;以F2单株为作图群体,用Mapmaker 3.0软件进行连锁图谱构建[11-12]。
利用QTL IciMapping3.0,采用完备区间作图法(ICIM),对玉米容重进行QTL加性定位(ICIM-ADD)和QTL上位性定位(ICIMEPI),并确定定位到的QTLs的LOD值,计算每个QTL位点的遗传效应及其对表型的贡献率[13]。
进行加性定位时,确定 L O D的阀值为2.5,作图函数采用Kosambi函数,步长为2.0。加性定位得出结果后,基因的作用方式按Stuber等的标准判定,DR=显性效应值/ 加性效应值,DR= 0~0.20为加性方式,记为A;DR=0.21~0.80为部分显性,记为PD;DR=0.81~1.20为显性方式,记为D;DR>1.20为超显性方式,记为OD[9]。
进行上位性定位时,确定LOD的阈值为5.0,作图函数采用Kosambi函数,步长为2.0,显著性水平为0.001[9]。
2 结果与分析
2.1 表型数据分析
玉米籽粒收获后进行容重测量和数据筛选,对其进行方差分析,结果(表1)显示,组间方差为604.92,组内方差为197.29,P值为1.7E-12,可见组间差异极显著。依照所列公式,计算F2∶3的广义遗传力为50.81%。

表1 表型性状分析结果
2.2 组合NX531×M-NX531的遗传连锁图谱

图1 F2∶3群体遗传图谱
选择均匀分布于玉米10条染色体964对引物,在NX531与M-NX531亲本间进行亲本多态性的筛选,获得亲本间多态性良好的分子标记107对,进行F2分离群体单株基因型的鉴定,最终构建出整合了107对SSR引物位点的NX531×M-NX531 的遗传连锁图(图1)。从图1可以看出,10条染色体上的107对引物在染色体上的分布如下:第1条染色体的引物数为34对,第2条和第10条染色体上的引物数为4对,第3条染色体上引物数为8对,第4条和第5条染色体上的引物数为5对,第6条和第7条染色体上的引物数为12对,第8条染色体上的引物数为13对,第9条染色体上的引物数为3对。从第1~10条染色体标记间平均距离分别为7.57、5.30、10.83、18.2、10.9、15.66、17.69、11.87、18.33、10.33。染色体长度范围21.2~257.4 cM,标记位点个数为3~34个,总的遗传长度为1 179.8 cM,约占玉米全基因组的85.76%,标记间的平均距离为11.91 cM。
2.3 容重QTL定位加性位置分析
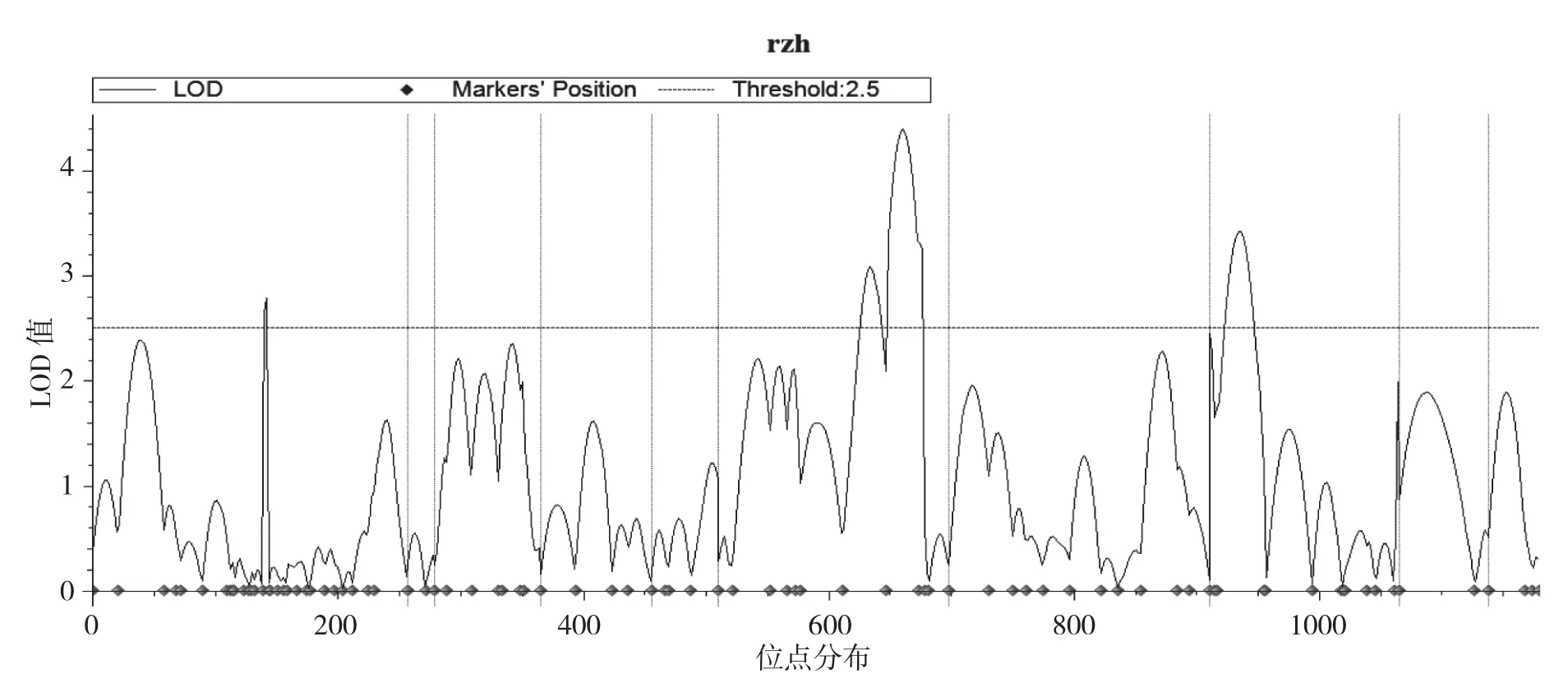
图2 容重QTL在染色体上的分布及LOD值
利用QTL定位软件QTL IciMapping3.0,选择利用完备区间作图法(ICIM)作图,确定以LOD的阀值为2.5,即某位点的LOD≥2.5时认定该位点存在与标记连锁的QTL。对容重加性效应进行QTL定位的结果见图2和表2。由图2可以得到,玉米10条染色体各位点的LOD值大于2.5的共有3个,分别位于第1、6、8条染色体上。因此,此次容重QTL加性定位共检测到3个QTLs,分别命名为qBD1、qBD2和qBD3。从表2可以看出,qBD1位于Ch1上的bnlg2238和bnlg1866之间,其位点在Ch1的142.0 cM 处,与其上一个连锁标记bnlg2238的遗传距离为3.2 cM,与其下一个连锁标记bnlg1866的遗传距离为1.8 cM;qBD2位于Ch6上的umc1520和umc1462之间,其位点在Ch7的150.0 cM处,与其上一个连锁标记umc1520的遗传距离为13.9 cM,与其下一个连锁标记umc1462的遗传距离为12.7 cM;qBD3位于Ch8上的phi080和umc2361之间,其位点在Ch1的24.0 cM处,与其上一个连锁标记phi080的遗传距离为17.7 cM ,与其下一个连锁标记umc251的遗传距离为14.3 cM。

表2 QTLs位点在染色体上的位置
2.4 容重QTL定位遗传分析
利用QTL定位软件QTL IciMapping3.0,对容重上位性效应进行QTL定位的结果见表3。从表3可以看出,位于Ch1上的qBD1的LOD阀值为2.79,对表型的贡献率为6.90%,基因的作用方式为加性,在该位点对加性效应增效作用的亲本为NX531;位于Ch6上的qBD2的LOD阀值为4.39,对表型的贡献率为9.24%,基因的作用方式为显性,在该位点对加性效应起增效作用的亲本为NX531;位于Ch8上的qBD3的LOD阀值为3.43,对表型的贡献率为4.15%,基因的作用方式为显性,在该位点对加性效应起增效作用的亲本为NX531。
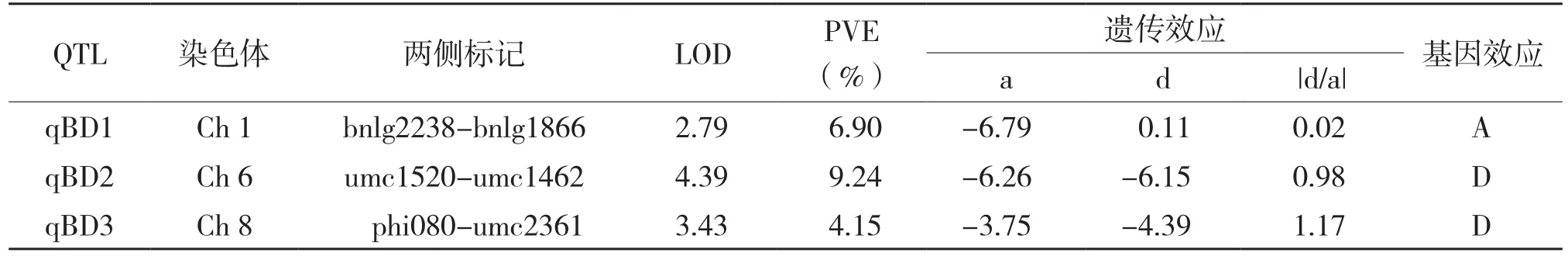
表3 容重的QTL分析结果
2.5 容重QTL定位上位性分析
利用QTL定位软件QTL IciMapping3.0,选择利用完备区间作图法(ICIM)作图,确定以LOD的阀值为5.0,定位结果如图3和表4所示。从图3和表4可以看出,共检测到3对上位性QTLs,涉及包括第1、3、4、10条共4条染色体的6个区段,不存在显著性位点。按照互作QTL涉及的2个基因座是否存在显著效应,本试验检测到的互作QTL只有1种类型,即NN类型(无显著效应基因座与无显著效应基因座之间的互作)共3对,分别为:Ch1上的umc2217-umc1169和Ch3上的bnlg1047-umc2266,最显著的上位性效应为DD,表型贡献率为14.92%;Ch3上的umc2266-umc2166和Ch4上的umc1808-umc1559,最显著的上位性效应为DD,表型贡献率为27.34%;Ch3上的umc1229-umc1520和Ch10上的umc2265-dupssr5,最显著的上位性效应为AD,表型贡献率为24.82%。上位性QTL对容重的遗传贡献率范围为14.92%-27.34%,共解释67.08%表型遗传变异。
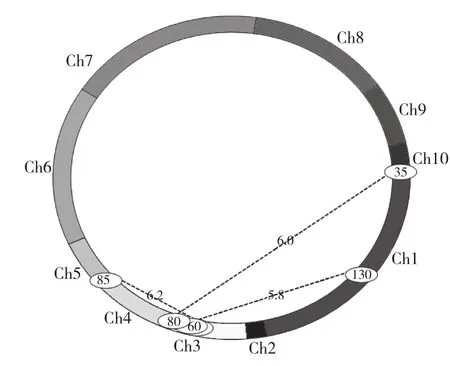
图3 容重QTL上位性互作结果
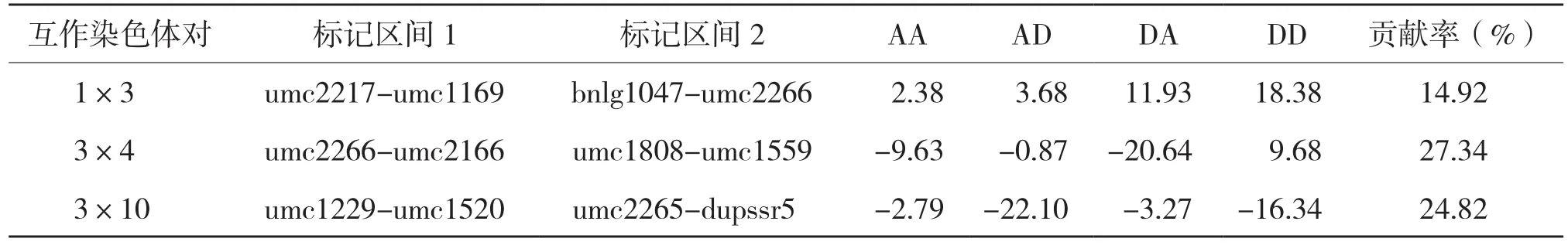
表4 容重QTL上位性互作结果
3 讨论
在检测主效QTL 时,可能会犯两类的错误:第一类是检测到假阳性QTL,第二类是真实存在的QTL没有被检测到[11]。对于第二类的错误,一般通过加大分离群体的数量及提高遗传图谱的标记密度予以降低;对于第一类的错误,一般通过界定适当的LOD阈值来予以降低。本试验中,所得遗传图谱总长度为1 179.8 cM,约占玉米染色体总长度的85.76%,染色体上的多态性良好的标记为107个,第1~10条染色体标记间平均距离分别为7.57、5.30、10.83、18.2、10.9、15.66、17.69、11.87、18.33、10.33。其中第6、7和9号染色体上标记间的距离较大,易发生第二类错误,漏掉真实存在的标记;其余染色体标记距离较近,减少了第二类错误的概率。但本试验中确定的LOD=2.5较经验值3.0偏小,可能因此造成检测到假阳性的QTL。
本试验中,在qBD1、qBD2、qBD3等3个位点起增效作用的亲本均为NX531。但以往的众多QTL定位试验已证明,对相同性状的不同的QTL位点起增效作用的可能是双亲中的任何一个。由于增效等位基因可能同时来自双亲,所以在聚合创制优良育种新材料时,双亲材料的遗传贡献均应当引起重视[14]。Song等[11]将这种亲本的增效作用称为隐蔽基因效应(cryptic gene effect),认为某些等位基因在亲本中被紧密连锁的其它基因所隐盖,发生重组后可被检测到[15]。
目前国内关于玉米容重QTL定位的试验报道尚不多见,因此定位到的QTL数量很少[16-17]。彭勃[5]对容重进行QTL定位,在不同试验地区共检测到18个QTL位点,其中位于Ch1上的位点位置分别为148、180、214、234、236、410 cM,位于Ch8上的位点位置分别为134和0cM,没有位于Ch6上的位点。而本试验检测出的3个QTLs分别位于Ch1的142.00 cM处、Ch6的150.00 cM处和Ch8的24.00 cM处。许理文等[18]利用先玉335的DH系群体和SNP标记定位玉米容重QTL,在不同年份和地点定位到5个QTL位点分布在第1、4、8、9号染色体上。许蒙蒙等[19]利用农大108的RIL群体定位了动态的玉米容重QTL,本试验中位于Ch1上142.00 cM处的位点与彭勃[5]位于148 cM处的位点接近,可看做相同QTLs。因此,本试验与前人试验检测到一个相同位点,其余的位点均为新发现标记。
本试验中3个位点的基因作用方式分别为A、D、D,而前人研究结果指出容重的性状遗传力较高,主要受加性效应控制[17-18]。
存在不同位点和不同基因作用方式现象的原因可能包括:(1)不同的亲本组配出的不同群体在基因型上存在较大差别;(2)QTL易受环境条件的影响,表现不稳定;(3)试验中大多数QTL定位的平均分子标记密度都在10 cM以上,因此定位精度不高;(4)检测过程中假阳性标记和真实存在的却未被检测到的标记偏多会造成位点错开。
上位性在复杂数量性状的遗传和杂种优势的形成中起着重要的作用。上位性在不同性状之间的互作位点、作用方式不尽相同,但其在玉米穗部性状中普遍存在,是不能被忽略的,在遗传中可能有着与玉米主效QTL同样重要的作用[20]。在本研究中,本群体检测到3对上位性QTL,这3对上位性互作QTLs为非显著QTL位点间的互作,即当这些上位性QTLs单独存在时,对表型性状的作用很小,只有与其他位点发生互作时才能影响表型性状。这也说明除了加性效应和显性效应外,上位性效应也是容重的重要遗传基础。
[1]郭淑春,吴月红,钱丽燕.用容重评定玉米质量方法的研究[J].粮食储藏,1996(5):33-34.
[2]苏义臣,金明华,苏桂华.玉米容重的相关性分析[J].吉林农业科学,2007,32(3):4-16.
[3]李建奇.不同类型品种对春玉米产量、品质的影响[J].种子,2006,25(12):58-60.
[4]Tuberosa R,Salvi S,Sanguineti M,et al.Mapping QTLs regulating morphophysiological traits and yield:case studies,short comings and perspectives in drought stressed maize[J].Ann Bot ,2002,89(7):941-963.
[5]彭勃.玉米籽粒产量及其相关性状遗传基础的研究[D].北京:中国农业科学院,2010.
[6]张静,王彩红,赵永锋,等.玉米种质资源子粒容重和品质性状差异分析[J].植物遗传资源学报,2016,17(5):832-839.
[7]任安然,武丽芬,关红辉,等.不同种植密度下玉米茎秆纤维性状和抗倒性相关分析[J].植物遗传资源学报,2017,18(4):653-664.
[8]王芳,王化俊,王汉宁.玉米基因组DNA的提取及SSR分析[J].玉米科学,2006,14(2):30-32.
[9]Stuber C W,Edwards M D,Wendel J F.Molecular marker- facilitated investigations of quantitative trait loci in maize,Factors influencing yield and its component traits[J].Crop Science,1987,27:639- 648.
[10]Liu Y,Guo J J,Zhang D M,et al.Genetic diversity and linkage disequilibrium estimation among the maize breeding germplasm for association mapping[J].International Journal of Agriculture and Biology,2014,16(5):851-861.
[11]Zeng Z B.Precision mapping of quant itative trait loci[J].Genetics,1994,136(4):1457-1468.
[12]邢光南,赵团结,盖钧益.关于Mapmaker遗传作图中标记分群和排序操作技术的讨论[J].作物学报,2008,34(2):217-223.
[13]李慧慧,张鲁燕,王建康.数量性状基因定位研究中若干常见问题的分析与解答[J].作物学报,2010, 36(6):918-93
[14]陈天青.玉米穗尖扁平及相关穗部性状的QTL分析[D].重庆:西南大学,2007.
[15]Song K,Slocum M K,Osbom T C.Molecular marker analysis of genes encoding morphological variation inBrassica rapa(syn.campestris)[J].Theor Appl Genet,1995,90(1):1-10.
[16]宋锡章,张宝石.春玉米主要穗部性状配合力及遗传参数分析[J].中国农学通报,2007,23(6):245-249.
[17]柯永培,石海春,牛应泽,等.玉米营养品质性状的遗传与配合力分析[J].四川大学学报,2006,43(5):1148-1153.
[18]许理文,段民孝,田红丽,等.基于SNP标记的玉米容重QTL分析[J].玉米科学,2015,23(5):21-25.
[19]许蒙蒙,秦永田,陈永强,等.玉米籽粒容重动态变化的QTL分析[J].中国农业科学,2016,49(23):4480-4487.
[20]谭巍巍,王阳,李永祥,等.不同环境下多个玉米穗部性状的QTL分析[J].中国农业科学,2011,44(2):233-244.

