脑微出血与急性缺血性卒中溶栓后出血转化的相关性研究
薛静,王昊,高培毅,祁宇,郝丽娜
急性缺血性卒中溶栓治疗后伴发的症状性出血转化(hemorrhage transformation,HT)是溶栓治疗的严重并发症,并与患者不良预后相关[1-2]。经过研究证实的具有临床意义的出血转化危险因素包括溶栓治疗、溶栓药物剂量、治疗前头部计算机断层扫描(computed tomography,CT)显示的水肿及占位效应、卒中严重程度和患者年龄,其他的危险因素包括高血糖、合并使用肝素、治疗时间及血管重建治疗成功的时间[3-4]。
脑微出血(cerebral microbleeds,CMBs)是指在梯度回波成像(gradient-recalled echo,GRE)或磁敏感加权成像(susceptibility weighted imaging,SWI)上2~5 mm的圆形低信号影,边界清楚,周围无水肿,并排除苍白球钙化及动脉流空信号影[5],病理学是指脑小血管周围少量出血形成含铁血黄素沉积,CMBs提示脑内微血管出现玻璃样变和淀粉样变。有研究表明,CMBs的出现会增加原发性脑出血及缺血性卒中患者自然病程下的出血转化风险[6-7]。那么,CMBs阳性的患者是否可以接受溶栓治疗,是卒中医师一直关注的问题。Charidimou等[8]关于脑微出血和溶栓治疗后出血转化的关系的meta分析结果表明,CMBs虽然可以增加HT的风险,但不应作为溶栓治疗的禁忌证,由此需要对CMBs和HT的相关性进行进一步的细化研究。本研究通过评估CMBs阳性组和阴性组患者溶栓治疗后出血转化的情况,以及CMBs部位分组和数量分级与HT的关系,探讨脑微出血与急性缺血性卒中溶栓后出血转化的相关性,为静脉溶栓治疗提供参考依据。
1 对象与方法
1.1 研究对象 连续选择2012年1月-2015年6月在首都医科大学附属北京天坛医院经急诊绿色通道接受溶栓治疗并符合入选标准的急性缺血性卒中患者。所有患者或家属均签署知情同意书,本研究经北京天坛医院伦理委员会批准。
入选标准:①年龄8~18岁;②基线磁共振成像(magnetic resonance imaging,MRI)检查在卒中发病后6 h内进行;③临床症状、体征、影像表现符合缺血性卒中的诊断;④基线和随访MRI均完成SWI检查序列,且图像可用于评估(无明显运动伪影等)。排除既往卒中遗留明显后遗症[改良Rankin量表(modified Rankin Scale,mRS)评分>2分]的患者。所有患者记录基线美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分、高血压、糖尿病、吸烟史。
1.2 影像学检查 采用德国Siemens Magnetom 3.0T MRI仪进行MRI检查。基线和溶栓(24±12)h后随访MRI检查成像序列,包括弥散加权成像(diffusion weighted imaging,DWI)、磁共振血管成像(magnetic resonance angiography,MRA)和SWI等序列。DWI采用多层单发射回波平面成像(single-shot echo-planar imaging,SS-EPI)序列,层厚5 mm,采集19~23层覆盖全脑,b(弥散敏感系数)值分别为0和1000 s/mm2。b=1000异常区域用来表征梗死核心灶。SWI序列重复时间(repetition time,TR)28 ms,回波时间(echo time,TE)20 ms,翻转角150,层厚1.2 mm,间距0,层数72,视野19 cm×23 cm,采集矩阵320×220。MRA采用三维时间飞跃法(three dimension time of flight,3D-TOF),TR 20 ms,TE 3.2 ms,视野24 cm×24 cm,采集矩阵320×224。
1.3 图像评估
1.3.1 CMBs的评估和分组 根据是否存在CMBs将患者分为CMBs阳性组和CMBs阴性组。
CMBs阳性判定标准:SWI图像上,脑实质内2~5 mm的圆形低信号影,边界清楚,周围无水肿,并排除苍白球钙化及血管流空信号影[5]。
同时根据CMBs病灶的部位和数量对患者进行分组和分级。CMBs部位分组:L1组,CMBs主要位于深部白质组(基底节区、丘脑、脑干、小脑半球);L2组,CMBs主要位于脑叶组;L3组,CMBs累及此次发病责任病灶区域。CMBs的数目分级,按照CMBs总的个数分为4级:0级:无;1级:1~5个;2级:6~10个;3级:>10个[9]。
1.3.2 急性缺血性卒中溶栓后HT的判定和分组标准 本研究结合DWI图像,在SWI图像上评估HT情况。参照欧洲协作性急性卒中研究Ⅱ(European Cooperative Acute Stroke Study Ⅱ,ECASS Ⅱ),将HT分为四类:①出血性梗死Ⅰ型(hemorrhagic infarction,HI-Ⅰ),梗死灶边缘的小斑点状出血(图1D);②出血性梗死Ⅱ型(HI-Ⅱ),梗死区域内融合的斑点状出血,无明显占位效应;③脑实质血肿Ⅰ型(parenchymal hematoma,PH-Ⅰ),血肿体积≤30%梗死体积伴轻微的占位效应;④脑实质血肿Ⅱ型(PH-Ⅱ),血肿体积>30%梗死体积伴明显的占位效应,或梗死灶外出血(图2D)[10]。
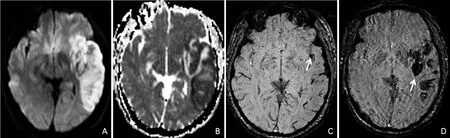
图2 脑微出血阳性/HT-II型
临床随机对照试验结果显示,HI-Ⅰ、HI-Ⅱ和PH-Ⅰ型多为无症状性HT,而PH-Ⅱ型多为症状性HT,后者和不良预后相关[10-11]。故本研究将HT分型进行改良分型,将入组患者分为:HT阴性组(图3D),HT-Ⅰ型(包括HI-Ⅰ、HI-Ⅱ和PH-Ⅰ型)(图1D)和HT-Ⅱ型(PH-Ⅱ型)(图2D)。
上述图像由两名高年资神经放射科医生进行评价,并达成一致。
1.4 统计学方法 采用SPSS 19.0统计软件。CMBs阳性和阴性组组间基线资料比较采用Mann-WhitneyU检验,应用行×列资料的χ2检验对CMBs阳性组和阴性组中的HT分型情况、CMBs阳性患者中不同发生部位的HT分型情况、CMBs不同数目分级的HT分型差别进行统计学分析,P<0.05为差异有显著性。
2 结果
2.1 患者基本资料 共有80例患者符合纳入标准,其中男58例,女22例,平均年龄(56±12)岁。CMBs阳性患者占31.3%(25/80);溶栓后HT阴性患者占55%(44/80),HT-Ⅰ型占34%(27/80),HI-Ⅱ型占11%(9/80)。
其中,CMB阳性组患者中,HT阴性组12例(48%),HT-Ⅰ型9例(36%),HI-Ⅱ型4例(16%);CMBs阴性患者55例(68.7%),其中HT阴性组32例(58.1%),HT-Ⅰ型18例(32.7%),HI-Ⅱ型5例(9.1%)。CMBs阳性组和阴性组患者在性别、高血压、糖尿病史、吸烟史、NHISS评分等方面比较,差异均无显著性(P>0.05),而年龄差异具有显著性(Z=-2.393,P=0.017)。CMBs阳性组患者平均年龄(59.9±13.3)岁高于CMBs阴性组(56.5±12.1)岁。
2.2 CMBs阳性组和阴性组HT分型的比较 采用行×列资料的χ2检验对CMBs阳性组和阴性组中的HT分型情况进行比较,结果表明差异无显著性(χ2=1.108,P=0.575),但CMBs阳性组中HI-Ⅱ型的比例(16%)高于CMBs阴性组(9.1%)(表1)。
2.3 CMBs发生的部位分组与HT分型比较
CMBs阳性的25例患者中,L1组13例,L2组5例,L3组7例。对CMBs阳性患者中不同发生部位的HT分型情况进行比较,结果表明差异无显著性(χ2=4.930,P=0.295)(表2)。
2.4 CMBs的数目分级与HT分型比较 CMBs阳性的25例患者中,按照数目分级,1级21例,2级2例,3级2例。对CMBs的不同数目分级的HT分型差别进行统计学分析,差异无显著性(χ2=5.886,P=0.208)(表3)。
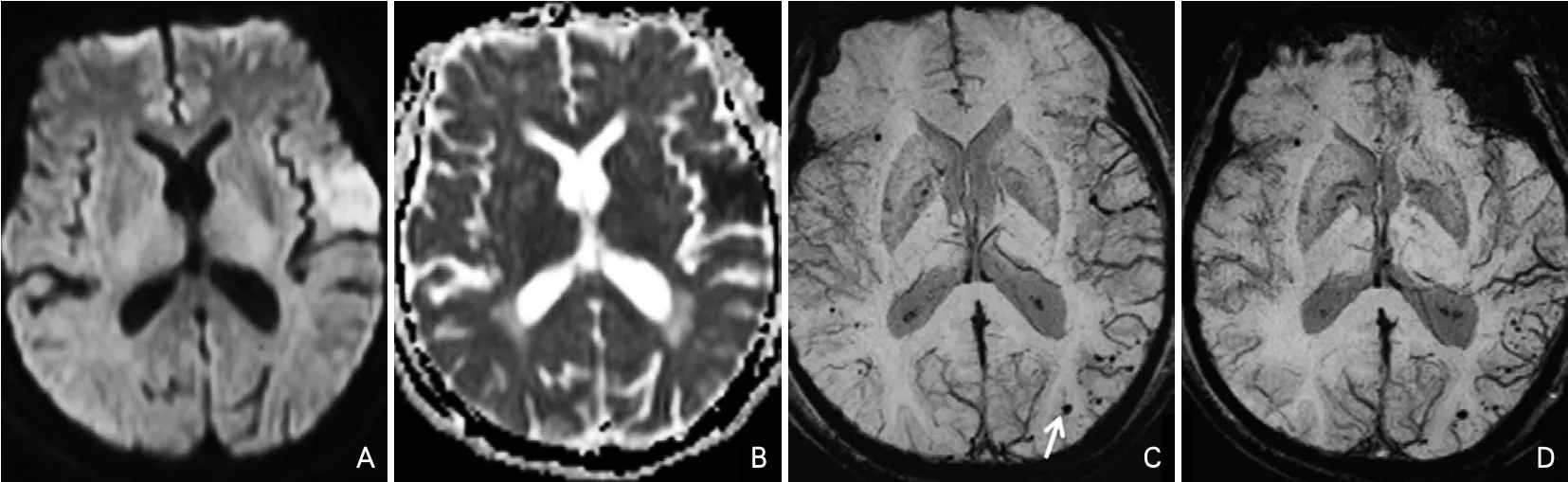
图3 脑微出血阳性/HT阴性
3 讨论
循证医学证据表明重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)溶栓治疗是急性缺血性卒中最为有效的治疗方法,而血栓溶解可导致治疗24~36 h内发生颅内出血,早期的症状性HT是最为严重的溶栓治疗并发症,可以增加患者的致残率和死亡率[1]。CMBs与脑出血高度相关,被认为是脑小血管病的标志[5],CMBs在缺血性卒中患者中的发病率约29%[12],本研究连续纳入发病6 h内的经rt-PA溶栓治疗的急性缺血性卒中患者,基线SWI显示CMBs阳性患者占31.3%。CMBs阳性组和阴性组患者在年龄上差异具有显著性,CMBs阳性组患者平均年龄高于CMBs阴性组。对于合并CMBs的急性期缺血性卒中患者,能否进行溶栓治疗目前还没有公认指南。

表1 脑微出血阳性组和阴性组HT分型的比较
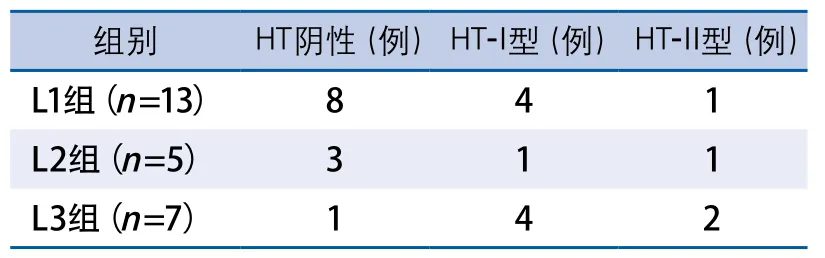
表2 脑微出血阳性组中不同分布部位HT分型的比较

表3 脑微出血阳性组中不同数目分级HT分型的比较
HT的基本机制是血-脑通透性屏障的破坏,即由内皮细胞紧密连接及细胞外基质蛋白构成的基底膜的破坏导致[13]。血液外渗通过机械性压迫、缺血及血液成分毒性作用引起脑实质损伤。关于引起HT的生物化学途径,证据表明缺血和再灌注过程中产生的自由基可能导致分子重叠改变,从而激活炎症细胞释放致炎因子,直接或间接地破坏基底膜和内皮细胞紧密连接。同时,蛋白水解酶的激活也可以降解基底膜[14],高水平的基质金属蛋白酶(matrix metalloproteinases,MMPs)可以独立预测进行和未进行溶栓治疗患者的出血转化[15]。CMBs是一种亚临床的微小血管病变导致的含铁血黄素沉积[16],小血管管壁脂质玻璃样变性、血管炎、淀粉样变性、内皮细胞和平滑肌病变等均可导致血脑屏障破坏,血管壁通透性增高,红细胞渗出进入血管周围。依病变的新旧,血管周围可见新鲜红细胞,或含铁血黄素颗粒沉积,或为吞噬含铁血黄素的巨噬细胞;而后两种改变可以在梯度回波序列(gradient echo,GRE)或SWI图像上被识别。
关于CMBs和急性缺血性卒中溶栓治疗后HT的相关性,即对CMBs阳性患者的溶栓治疗尚存在争议[8,17-18]。Hermier等[19]学者认为CMBs的存在增加了急性缺血性卒中患者溶栓治疗后出血转化的风险,多发CMBs是缺血性卒中患者发病后发生HT和溶栓后出血的危险因素,大量的CMBs代表微血管病变较严重,容易发生更大的血管壁损伤。随着其他临床试验的进展,部分学者认为急性缺血性卒中伴CMBs患者接受溶栓治疗导致的风险很低[20]。这种研究结果的差异性,与入组患者的类型及CMBs的诊断标准有关。CMBs检出率极易受成像参数影响,在低场强、层厚过大、存在层间距、短回波时间等条件下,检测的敏感性与特异性降低。本组研究选择了单中心病例,统一成像参数进行SWI成像。患者溶栓后HT阴性患者占55%,HT-Ⅰ型占34%,HI-Ⅱ型占11%。对CMBs阳性组和阴性组中的HT分型情况进行比较,结果显示差异无显著性,但CMBs阳性组中HI-Ⅱ型的比例高于CMBs阴性组。与Charidimou等[8]关于脑微出血和溶栓治疗后出血转化的关系的meta分析结果一致,表明CMBs可以增加HT的风险,但不应作为溶栓治疗的禁忌证。
本研究对CMBs阳性患者中不同发生部位的HT分型情况进行比较,结果表明差异无显著性(P>0.05)。对CMBs的不同数目分级的HT分型差异进行统计学分析,结果显示差异无显著性(P>0.05)。但由于本研究为单中心研究,纳入病例数目较少,今后的研究我们将进一步关注梗死灶内发生CMBs和数目较多的患者溶栓治疗后HT的发生情况。
CMBs是一种脑微小血管病变导致的亚临床的形态学改变,是脑小血管病的影像学标记物之一,但其不是急性缺血性卒中患者静脉溶栓治疗的绝对禁忌之一。CMBs可以作为缺血性卒中溶栓后HT的一个参考的预测指标,尤其是如果梗死灶内出现多发CMBs,则发生症状性HT的概率增加。因此,SWI技术下检出CMBs对缺血性卒中患者的治疗有一定指导价值。
1 Peña ID,Borlongan C,Shen G,et al. Strategies to extend thrombolytic time window for ischemic stroke treatment:an unmet clinical need[J]. J Stroke,2017,19:50-60.
2 von Kummer R. Brain hemorrhage after thrombolysis:good or bad?[J]. Stroke,2002,33:1446-1447.
3 薛静,高培毅. 急性缺血性卒中溶栓治疗伴随的颅内出血的研究进展[J]. 中国卒中杂志,2007,2:873-878.
4 Terao T,Misshina M,Takumi I,et al. Early computed tomography signs as early predictors of hemorrhagic transformation under heparinization in patients with cardiogenic embolism[J]. Geriatr Gerontol Int,2012,12:418-424.
5 Lee SH,Kwon SJ,Kim KS,et al. Cerebral microbleeds in patients with hypertensive stroke. Topographical distribution in the supratentorial area[J]. J Neurol,2004,251:1183-1189.
6 Fiehler J. Cerebral microbleeds:old leaks and new haemorrhages[J]. Int J Stroke,2006,1:122-130.
7 Song TJ,Kim J,Song D,et al. Total cerebral smallvessel disease score is associated with mortality during follow-up after acute ischemic stroke[J]. J Clin Neurol,2017,13:187-195.
8 Charidimou A,Shoamanesh A,Wilson D,et al. Cerebral microbleeds and postthrombolysis intracerebral hemorrhage risk updated meta-analysis[J].Neurology,2015,85:927-934.
9 Imaizumi T,Horita Y,Hashimoto Y,et al. Dotlike hemosiderin spots on T2*-weighted magnetic resonance imaging as a predictor of stroke recurrence:a prospective study[J]. J Neurosurg,2004,101:915-920.
10 Hacke W,Kaste M,Fieschi C,et al. Randomised double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke (ECASS Ⅱ). Second European-Australasian Acute Stroke Study Investigators[J]. Lancet,1998,352:1245-1251.
11 Larrue V,von Kummer RR,Müller A,et al. Risk factors for severe hemorrhagic transformation in ischemic stroke patients treated with recombinant tissue plasminogen activator:a secondary analysis of the European-Australasian Acute Stroke Study (ECASSⅡ)[J]. Stroke,2001,32:438-441.
12 Han J,Gao P,Lin Y,et al. Three-tesla magnetic resonance imaging study of cerebral microbleeds in patients with ischemic stroke[J]. Neurol Res,2009,31:900-903.
13 Wang X,Lo EH. Triggers and mediators of hemorrhagic transformation in cerebral ischemia[J].Mol Neurobiol,2003,28:229-244.
14 Gasche Y,Copin JC,Sugawara T,et al. Matrix metalloproteinase inhibition prevents oxidative stressassociated blood-brain barrier disruption after transient focal cerebral ischemia[J]. J Cereb Blood Flow Metab,2001,21:1393-1400.
15 Castellanos M,Leira R,Serena J,et al. Plasma metalloproteinase-9 concentration predicts hemorrhagic transformation in acute ischemic stroke[J].Stroke,2003,34:40-46.
16 Kim BJ,Lee SH. Cerebral microbleeds:their associated factors,radiologic fi ndings,and clinical implications[J]. J Stroke,2013,15:153-163.
17 Lee SH,Bae HJ,Kwon SJ,et al. Cerebral microbleeds are regionally associated with intracerebral hemorrhage[J]. Neurology,2004,62:72-76.
18 Malhotra K,Khunger M,Ouyang B,et al.Interaction of incidental microbleeds and prior use of antithrombotics with early hemorrhagic transformation:Causative or protective?[J]. Ann Indian Acad Neurol,2016,19:467-471.
19 Hermier M,Nighoghossian N. Contribution of susceptibility-weighted imaging to acute stroke assessment[J]. Stroke,2004,35:1989-1994.
20 Fiehler J,Albers GW,Boulanger JM,et al. Bleeding risk analysis in stroke imaging before thromboLysis(BRASIL):pooled analysis of T2*-weighted magnetic resonance imaging data from 570 patients[J]. Stroke,2007,38:2738-2744.