门冬氨酸钾减轻大鼠可控性皮质打击伤引起的脑损伤
顾漪,赵育梅,苏玉金
创伤性脑损伤(traumatic brain injury,TBI)是年轻人群死亡和致残的主要原因之一[1]。创伤性脑损伤引起的功能缺损可由原发性损伤和继发性损伤导致。原发性损伤主要来自直接的生物机械外力;继发性损伤则持续发展数小时到数天,并且是复杂的病理生理学事件的结果,最终导致神经元死亡[2]。这些病理生理学事件包括线粒体功能障碍、离子稳态失衡和脑水肿。线粒体功能障碍会引起氧化磷酸化减少和三磷腺苷(adenosine triphosphate,ATP)水平下降[3]。ATP的逐渐下降干扰了离子泵的活性,如钠钾ATP酶。TBI后钠钾ATP酶活性下降导致细胞体积和渗透性失调,并引起细胞毒性脑水肿,使星形胶质细胞和神经元肿胀[4]。对创伤性脑损伤后有效的治疗可能需要考虑多个病理生理学事件的影响。
门冬氨酸钾(potassium aspartate,PA)作为一种电解质补充剂,在临床上广泛使用。钾是细胞内的一种重要的阳离子,参与大量酶促反应。门冬氨酸是体内草酰乙酸的前体,在三羧酸循环中起重要作用,并参与ATP的生成。门冬氨酸对细胞有很强的亲和力,能增加钾离子内流[5]。过度的钾离子外流和细胞内钾离子缺失是凋亡的早期关键性步骤。前期研究发现PA在脑缺血/再灌注大鼠中对细胞凋亡有神经保护作用[6]。尽管缺血性卒中和TBI源自完全不同的原发性损害,但其参与损伤过程的机制有许多相似之处[7],其中之一便是脑血流量减少,导致微血管循环障碍和组织的氧糖剥夺。因此,本研究想了解PA是否能通过增加ATP水平,提高钠钾ATP酶活性和降低脑水肿,改善脑血流量,对TBI具有神经保护作用。有许多模型可用于创伤性脑损伤研究,本实验选择了可控性皮质打击伤(controlled cortical impact,CCI)作为创伤性脑损伤模型来研究。与其他模型相比,CCI模型有许多优势,如更加准确,易于控制,并且更为重要的是,其诱导的TBI与人类的脑损伤相似[8]。
1 材料与方法
1.1 研究对象与分组 本研究经北京市神经外科研究所实验动物伦理委员会审查通过。所有动物实验过程均按照研究用动物在体实验报告(Animals in Research: Reporting In Vivo Experiments,ARRIVE)指南执行[9]。研究采用雄性Sprague-Dawley(SD)大鼠,体重300~330 g[3月龄,SPF级,由北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2013-0001];PA:原料药,每瓶5 g(批号100602,辽宁药联制药有限公司提供)。
将大鼠随机分为三组,每组10只,模型组大鼠造模全部成功,无死亡:①假手术组:给予生理盐水(批号1508406,国药集团容生制药有限公司),1 ml/kg;②溶剂对照组:生理盐水,1 ml/kg;③门冬氨酸钾组:62.5 mg/kg剂量的PA,在CCI造模后30 min腹腔注射给予各组药物。
1.2 制模方法 采用颅脑打击器制备大鼠CCI模型[10]。大鼠以400 mg/kg剂量腹腔注射10%水合三氯乙醛麻醉,俯卧位放置在37℃恒温板上。头皮以正中线切开,去除骨膜,充分暴露颅骨,以前囟后2 mm,旁开2.5 mm为圆点,开一直径为2.5 mm骨窗,保持硬脑膜完整。将大鼠固定在脑立体定位仪上(#68508,深圳瑞沃德生命科学有限公司),调整PinPointTM颅脑打击器(PCI3000,美国Hatteras公司),将撞击杆的头端与硬膜接触,设定打击条件:打击速度2 m/s,打击深度2.5 mm,撞击杆直径4 mm,持续时间85 ms。打击完成后,从立体定位仪上取下大鼠,填回颅骨并缝合头皮。
1.3 实验方法
1.3.1 脑血流灌注量监测 以大鼠前囟后1 mm,右侧旁开2.5 mm处为圆点,开一直径4 mm的骨窗,保持硬脑膜完整,于CCI打击前,打击后即刻,打击后30、60、90和120 min,采用激光微循环血流监测动态视频系统(Pericam PSI HR,瑞典Perimed AB)对三组大鼠分别进行脑血流灌注量监测,每次监测记录1 min,计算1 min内的平均脑灌注量。
1.3.2 神经功能行为评分 在CCI打击前和打击后4、24、72 h,采用Chen等[11]的改良神经功能缺损评分表(modified Neurological Severity Score,mNSS)对三组大鼠进行神经功能行为评分,该评分包括一些特定反射的存在以及完成运动和行为学任务,如木板行走试验,木板平衡试验和自主运动试验,总分为18分。该评分由一位分组盲法的实验者完成。
1.3.3 皮质损伤体积的测量 皮质损伤体积采用苏木精-伊红(hematoxylin-eosin,HE)染色法描记后测量。在CCI后72 h,各组大鼠以水合氯醛麻醉后,经心灌注生理盐水和4%多聚甲醛,组织脱水、石蜡包埋后,从前囟前1.2 mm到前囟后4.8 mm进行冠状切片,切片厚度5 μm,间隔500 μm[12],每个标本共获得12张切片,进行HE染色。所有切片用正置显微镜照相(DM4000B LED,德国莱卡),采用Image J软件(NIH,1.48v)进行分析,计算皮质损伤体积,假手术组大鼠不进行皮质损伤体积测量。
1.3.4 脑组织水含量测定 采用脑水含量测定法来评价脑水肿情况。用干湿称重法测量损伤同侧半球的水含量[13],方法如下:大鼠在CCI后24 h以水合氯醛麻醉后处死,取出损伤侧半球组织,称重,该数据为组织湿重,然后在120℃烤箱内放置24 h。烤干后冷却的组织再次称重,所得数据为组织干重。组织水含量的计算公式为:(湿重-干重)/湿重×100%。
1.3.5 脑组织ATP、乳酸含量和钠钾ATP酶活性测定 CCI打击后24 h,大鼠麻醉并处死,损伤侧半球被取出,加入匀浆缓冲液(0.01 mol/L三羟甲基氨基甲烷,0.0001 mol/L乙二胺四乙酸,0.01 mol/L蔗糖,0.9%氯化钠,pH=7.4)用于制备10%组织匀浆液。匀浆液在以3500 r/min于4℃离心10 min,收集上清液,用相应的试剂盒(南京建成生物工程研究所)测定ATP,乳酸含量和钠钾ATP酶的活性。
1.4 统计方法 神经功能行为评分结果以中位数和四分位数表示,其他数据以均值±标准误表示。使用SPSS 19.0软件,神经功能行为评分数据用非参数Kruskal-Wallis分析,脑血流灌注量结果采用重复测量方差分析和LSD检验,其余各组之间比较采用独立样本t检验或单因素方差分析以及LSD检验。P<0.05为差异有显著性。
2 结果
2.1 门冬氨酸钾改善大鼠CCI后脑组织血流灌注量 大鼠CCI打击前,打击后即刻,打击后30、60、90和120 min的脑血流灌注量结果见表1。重复测量方差分析结果显示,不同测量时间的脑血流灌注量差异有显著性(P=0.001),不同测量时间和不同分组间无交互作用(P=0.145),三组之间测量结果比较,差异有显著性(P<0.001)。
2.2 门冬氨酸钾改善大鼠CCI后的神经功能评分 大鼠CCI打击前,打击后4、24和72 h的神经功能评分结果见表2。假手术组大鼠表现为正常的神经功能评分,三组大鼠打击后的神经功能评分存在显著性差异(KW=80.34,P<0.001)。与假手术组相比,溶剂对照组大鼠在打击后4、24和72 h的评分明显升高(D=-63.75,P<0.001;D=-57.05,P<0.001;D=-55.40,P<0.001),门冬氨酸钾组大鼠打击后4 h的神经功能评分也明显升高(D=-39.10,P<0.05);与溶剂对照组相比,打击后24和72 h门冬氨酸钾组大鼠的神经功能评分明显改善(D=37.95,P<0.05;D=39.65,P<0.05)。
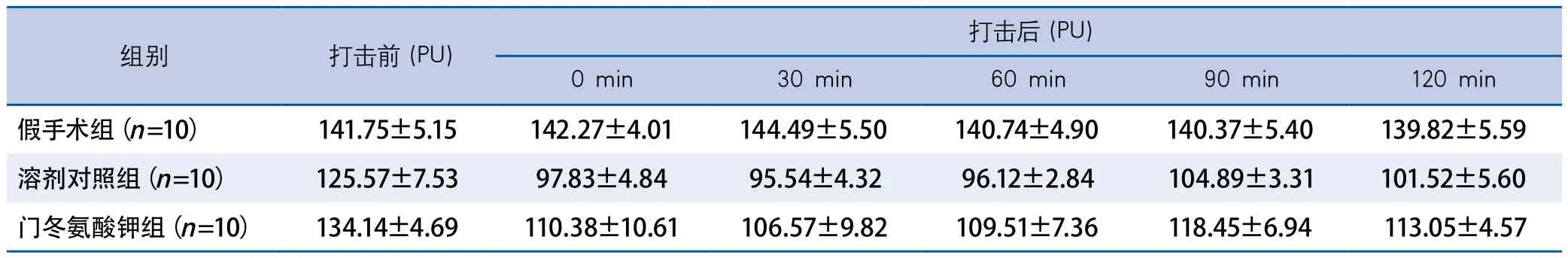
表1 门冬氨酸钾对大鼠CCI后脑血流灌注量的影响
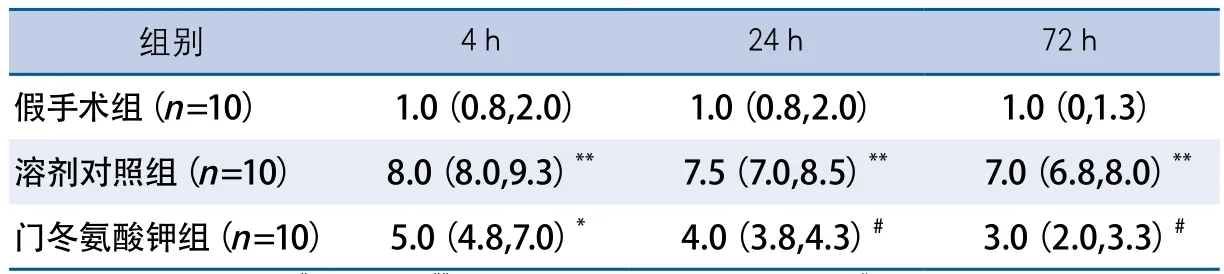
表2 门冬氨酸钾对大鼠CCI后神经功能评分的影响
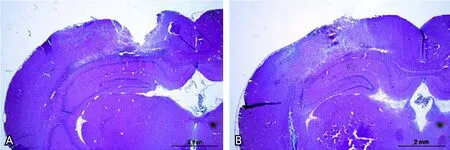
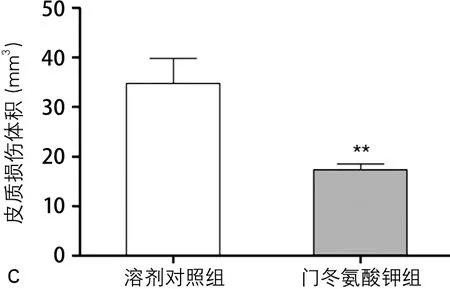
图1 门冬氨酸钾对大鼠CCI后皮质损伤体积的影响
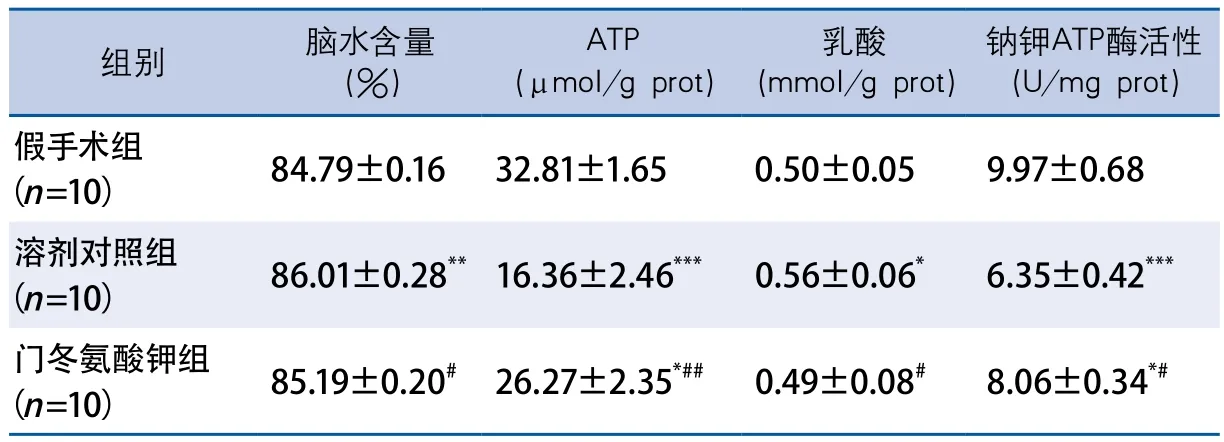
表3 门冬氨酸钾对大鼠CCI后脑水含量、ATP和乳酸水平及钠钾ATP酶活性的影响
2.3 门冬氨酸钾降低大鼠CCI后脑皮质损伤体积 CCI打击后72 h,溶剂对照组和门冬氨酸钾组大鼠的HE染色结果和皮质损伤体积见图1,两组大鼠的平均损伤体积分别为(34.8±4.98)mm3和(17.3±1.23)mm3(图1A),门冬氨酸钾治疗后能显著降低大鼠的皮质损伤体积(t=3.419,P=0.007)。
2.4 门冬氨酸钾减轻大鼠CCI后脑水肿,增加脑ATP,降低乳酸水平并增加钠钾ATP活性 大鼠脑水含量测定结果显示,CCI打击后溶剂对照组和门冬氨酸钾组的脑水含量明显增加(F=7.928,P=0.002);与溶剂对照组相比,62.5 mg/kg剂量的门冬氨酸钾治疗显著减少脑水含量(q=2.622,P<0.05)。
三组大鼠脑组织ATP含量,乳酸水平和钠钾ATP酶活性之间差异有显著性(F=14.42,P<0.001;F=3.628,P=0.040;F=13.11,P<0.001);与溶剂对照组比较,门冬氨酸钾处理后能显著提高脑组织的ATP含量,降低乳酸水平并增加钠钾ATP酶活性(q=4.544,P<0.01;q=3.513,P<0.05;q=3.409,P<0.05)(表3)。
3 讨论
门冬氨酸钾的保护作用可能与钾离子和门冬氨酸有关。以往的研究证实TBI可以引起钾离子传导的丧失,导致钾离子稳态失衡,最终促使神经功能异常[14-15]。Filippidis等[16]发现了创伤引起的显著的钠离子下降和细胞外钾离子升高,而钾离子外流会导致突发的神经元去极化。门冬氨酸具有很强的细胞亲和力,能够增加钾离子内流。因此,门冬氨酸钾可以通过调节钾离子稳态平衡来降低TBI损伤。此外,门冬氨酸参与能量代谢,提高ATP的生成,这可能与其神经保护作用相关。
门冬氨酸钾治疗作用的研究中发现门冬氨酸钾在大鼠的半数致死剂量为1250 mg/kg,因此本研究选择的62.5 mg/kg剂量应在安全范围内。结果显示,大鼠脑创伤后急性给予62.5 mg/kg剂量的门冬氨酸钾能显著提高CCI后24和72 h的神经功能评分,并明显降低CCI后72 h大鼠的皮质损伤体积。该结果与以前在脑缺血模型中得出的结果相似,提示门冬氨酸钾对大鼠创伤性脑损伤有神经保护作用。
有研究发现TBI与卒中风险增加有关[17],TBI引起脑血管系统损伤后,血供不足,从而诱发卒中;另外,脑外伤引起凝血级联反应的改变和血管剥离,都会增加卒中风险[18]。因此,不同于以往对脑损伤治疗效果的研究都只观察神经功能缺损评分和损伤体积的测量[13,19],本研究增加了对脑组织血流灌注量指标的观察。影响脑血流量的因素主要是脑动脉压、静脉压和脑血管的阻力,而脑血管对脑内化学环境变化,神经元信号和血管内压力的变化具有迅速适应和反应的能力[20]。本研究中,影响脑血流变化的主要因素应该是脑血管阻力的变化。实验结果显示,不同时间点大鼠的脑灌注量有显著差异,这应该是皮质打击引起的,打击即刻对脑皮质的机械损伤直接导致脑灌注量下降,而这一变化在打击后30 min最为明显:此时已出现一系列继发性损伤事件,包括兴奋毒性作用、凋亡、线粒体损伤、内质网应激和神经炎症反应等[21],这些继发损伤都会对脑血管内压力产生影响,造成脑灌注量下降。随着时间的进展,在打击后90和120 min测量的脑灌注量有上升的趋势,推测可能与脑血流的自动调节功能有关。组间比较显示,溶剂对照组和门冬氨酸钾组的脑灌注量单位明显下降,提示CCI模型制作成功,但两组大鼠的脑灌注量之间差异无显著性,可能是门冬氨酸钾对血流变化没有明显作用。
Klatzo[22]在1967年就提出了脑水肿的两种主要形式:细胞毒性水肿或血管源性水肿,分别由细胞损伤或血脑屏障降解产生的细胞内或细胞外水聚集。第三种形式称为间质水肿,在1992年由Milhorat[23]提出。细胞毒性水肿的特点是血脑屏障完整,但细胞膜上的钠钾泵功能障碍,导致水由间质进入细胞内和从血液进入脑实质[24]。结果,大量的钠离子在细胞内聚集,由于渗透压的改变,细胞摄入水分后随即肿胀。门冬氨酸钾能降低大鼠CCI后的脑水含量,应该与其改善钠钾ATP酶活性,增加钾离子进入细胞内,从而减轻细胞毒性水肿有关。
脑组织损伤后组织ATP含量的迅速下降并引起继发性脑损伤已被证实[25]。门冬氨酸能形成草酰乙酸,参与三羧酸循环和尿素循环,生成ATP,为机体供能。在本研究中,门冬氨酸钾能减少CCI后大鼠的ATP下降,这可能与门冬氨酸的作用有关。同时,结果显示,与假手术组比较,溶剂对照组的乳酸含量明显增加,而给予门冬氨酸钾治疗后乳酸水平较溶剂对照组下降,这是因为缺氧条件下,糖酵解产生的丙酮通过乳酸途径进一步上升,因此在损伤组织中,乳酸含量应该上升。该结果也与ATP含量结果一致,证实了门冬氨酸钾在能量代谢过程中起到的供能作用。
ATP的缺失可以引起能量依赖的膜离子泵功能障碍,如钠钾ATP酶。钠钾ATP酶是一种广泛存在的血浆膜蛋白,在细胞内电解质稳态平衡的维持中起关键作用[26]。有研究证实TBI能损伤钠钾ATP酶的活性,并且提高该酶的活性对TBI的治疗是有益的[27-29]。本研究结果证实CCI引起钠钾ATP酶活性下降,并且门冬氨酸钾治疗改善了这一酶活性,因此,门冬氨酸钾对钠钾ATP酶活性的提高可能是其神经保护作用的治疗机制之一。
门冬氨酸钾对大鼠脑损伤的研究在国内外鲜有报道,本研究在门冬氨酸钾对大鼠局灶性脑缺血再灌注损伤和可控性皮质打击伤方面均做了初步探索,获得了门冬氨酸钾对大鼠脑损伤的有效治疗剂量。此外,该研究对门冬氨酸钾在临床的应用有一定指导作用,如果脑损伤的患者需要使用钾补充剂时,可以考虑使用门冬氨酸钾,因其改善钠钾ATP酶的活性在补钾的同时也具有神经保护作用。但本研究仍有不足之处,本研究为急性脑损伤的机制研究,而TBI的长期预后是一个重要的公共卫生问题,对其恢复期持续症状的产生,如脑灌注量下降,认知功能受损等没有良好的神经生物学解释[30-31];在今后的研究中,应该观察门冬氨酸钾对脑损伤的长期作用效果,并增加认知功能方面的评价,以更加完善其作用机制的研究。
1 Hirst TC,Watzlawick R,Rhodes JK,et al. Study protocol - A systematic review and meta-analysis of hypothermia in experimental traumatic brain injury:Why have promising animal studies not been replicated in pragmatic clinical trials?[J]. Evid Based Preclin Med,2016,3:e00020.
2 Cheng G,Kong RH,Zhang LM,et al. Mitochondria in traumatic brain injury and mitochondrial-targeted multipotential therapeutic strategies[J]. Br J Pharmacol,2012,167:699-719.
3 Shultz SR,McDonald SJ,Vonder Haar C,et al. The potential for animal models to provide insight into mild traumatic brain injury:Translational challenges and strategies[J]. Neurosci Biobehav Rev,2016 Sep 19.[Epub ahead of print]
4 Winkler EA,Minter D,Yue JK,et al. Cerebral edema in traumatic brain injury:pathophysiology and prospective therapeutic targets[J]. Neurosurg Clin N Am,2016,27:473-488.
5 石奇龙. 天冬氨酸钾镁的药理作用[J]. 湖南医学,1990,7:57-58.
6 顾漪,赵育梅,龚磊,等. 门冬氨酸钾对局灶性脑缺血再灌注大鼠的保护作用研究[J]. 中国卒中杂志,2014,9:100-105.
7 Bramlett HM,Dietrich WD. Pathophysiology of cerebral ischemia and brain trauma:similarities and differences[J]. J Cereb Blood Flow Metab,2004,24:133-150.
8 Osier ND,Dixon CE. The controlled cortical impact model:applications,considerations for researchers,and future directions[J]. Front Neurol,2016,7:134.
9 NC3Rs Reporting Guidelines Working Group. Animal research:reporting in vivo experiments:the ARRIVE guidelines[J]. J Physiol,2010,588:2519-2521.
10 Kobeissy FH. Brain Neurotrauma:Molecular,Neuropsychological,and Rehabilitation Aspects[M].Boca Raton (FL):CRC Press/Taylor & Francis,2015,Chapter 16.
11 Chen J,Sanberg PR,Li Y et al. Intravenous administration of human umbilical cord blood reduces behavioral de fi cits after stroke in rats[J]. Stroke,2001,32:2682-2688.
12 诸葛启钏. 大鼠脑立体定位图谱[M]. 3版. 北京:人民卫生出版社,2005:85-190.
13 Sun M,Zhao Y,Gu Y,et al. Protective effects of taurine against closed head injury in rats[J]. J Neurotrauma,2015,32:66-74.
14 D’Ambrosio R,Maris DO,Grady MS,et al. Impaired K(+) homeostasis and altered electrophysiological properties of post-traumatic hippocampal glia[J]. J Neurosci,1999,19:8152-8162.
15 Armstead WM,Riley J,Vavilala MS. TBI sex dependently upregulates ET-1 to impair autoregulation,which is aggravated by phenylephrine in males but is abrogated in females[J]. J Neurotrauma,2012,29:1483-1490.
16 Filippidis AS,Liang X,Wang W,et al. Real-time monitoring of changes in brain extracellular sodium and potassium concentrations and intracranial pressure after selective vasopressin-1a receptor inhibition following focal traumatic brain injury in rats[J]. J Neurotrauma,2014,31:1258-1267.
17 Lee YK,Lee CW,Huang MY,et al. Increased risk of ischemic stroke in patients with mild traumatic brain injury:a nationwide cohort study[J]. Scand J Trauma Resusc Emerg Med,2014,22:66.
18 Burke JF,Stulc JL,Skolarus LE,et al. Traumatic brain injury may be an independent risk factor for stroke[J].Neurology,2013,81:33-39.
19 Gu Y,Zhao Y,Qian K,et al. Taurine attenuates hippocampal and corpus callosum damage,and enhances neurological recovery after closed head injury in rats[J]. Neuroscience,2015,291:331-340.
20 Donnelly J,Budohoski KP,Smielewski P,et al.Regulation of the cerebral circulation:bedside assessment and clinical implications[J]. Crit Care,2016,20:129.
21 Laskowitz D,Grant G. Translational Research in Traumatic Brain Injury[M]. Boca Raton (FL):CRC Press/Taylor and Francis Group,2016,Chapter 5.
22 Klatzo I. Neuropathological aspects of brain edema[J].J Neuropathol Exp Neurol,1967,26:1-14.
23 Milhorat TH. Classi fi cation of the cerebral edemas with reference to hydrocephalus and pseudotumor cerebri[J].Childs Nerv Syst,1992,8:301-306.
24 Tang G,Yang GY. Aquaporin-4:a potential therapeutic target for cerebral edema[J]. Int J Mol Sci,2016,17. pii:E1413.
25 Li T,Wang N,Zhao M. Neuroprotective effect of phosphocreatine on focal cerebral ischemia-reperfusion injury[J]. J Biomed Biotechnol,2012,2012:168 756.
26 Holm TH,Lykke-Hartmann K. Insights into the pathology of the α3 Na(+)/K(+)-ATPase ion pump in neurological disorders; lessons from animal models[J].Front Physiol,2016,7:209.
27 Dvela-Levitt M,Ami HC,Rosen H,et al. Ouabain improves functional recovery following traumatic brain injury[J]. J Neurotrauma,2014,31:1942-1947.
28 Silva LF,Hoffmann MS,Rambo LM,et al. The involvement of Na+/K+-ATPase activity and free radical generation in the susceptibility to pentylenetetrazol-induced seizures after experimental traumatic brain injury[J]. J Neurol Sci,2011,308:35-40.
29 Gerbatin RD,Cassol G,Dobrachinski F,et al.Guanosine protects against traumatic brain injuryinduced functional impairments and neuronal loss by modulating excitotoxicity,mitochondrial dysfunction,and in fl ammation[J]. Mol Neurobiol,2016 Nov 9.[Epub ahead of print]
30 Barlow KM,Marcil LD,Dewey D,et al. Cerebral Perfusion Changes in Post-Concussion Syndrome:A Prospective Controlled Cohort Study[J]. J Neurotrauma,2017,34:996-1004.
31 Eme R. Neurobehavioral Outcomes of Mild Traumatic Brain Injury:A Mini Review[J]. Brain Sci,2017,7:46.