棉花过表达超氧化物歧化酶基因对植株耐盐性的影响
胡根海,张晓红,付远志,董 娜,王清连
(河南科技学院 生命科技学院,现代生物育种河南省协同创新中心,河南 新乡 453003)

1 材料和方法
1.1 棉花胞质Cu/Zn SOD基因的克隆及载体构建
根据笔者克隆的棉花胞质Cu/Zn-SOD基因的ORF(GenBank注册号:DQ445093),利用基因的开放阅读框设计引物,在起始密码子ATG前增加BamHⅠ位点,在终止密码子UAG处增加SacⅠ位点,上游,5′-GTCGCGGATCCATGGTGAAGGCCGTTGCCG-3,下游:5′-GCGACGAGCTCCAGACCAATAATACCGCAAG-3′;扩增上述基因得到约480 bp长的基因片段,片段回收后进行 pUCm-T连接后,转化JM109,获得的阳性克隆经测序(上海生工生物工程有限公司)验证无误后进行BamH Ⅰ和SacⅠ双酶切,回收目的基因编码框DNA,与相同限制性内切酶消化表达载体pCAMGBIA2300回收的大片段连接,构建融合 pCAMGBIA-SOD目的基因的表达载体。
1.2 陆地棉遗传转化
采用农杆菌介导的棉花腋芽遗传转化技术(ZL20130634992.9),利用 pCAMGBIA-SOD表达载体质粒转化感受态农杆菌LBA4404,潮霉素筛选获得阳性克隆。挑取阳性克隆菌落在28 ℃下于LB培养基中振荡培养至OD600= 0.4,配制浸染液对2片子叶张开真叶没有出现的苗进行遗传转化。新芽再生后,以非转基因材料为对照,对叶片进行潮霉素涂抹验证,获得转基因阳性植株。
1.3 转基因系PCR鉴定和Southern Blotting分析
采用CTAB法提取对照和转基因阳性植株叶片DNA。采用特异引物扩增潮霉素基因的方法对转化材料进行PCR检测。上游引物:5′-CGCGGATCCATGAAAAAGCCTGAA-3′,下游引物:5′-CCCAAGCTTTCTATTTCTTTGCCCTC-3′,PCR反应条件为:98 ℃变性3 min 1个循环;94 ℃变性30 s,60 ℃退火40 s,72℃延伸1 min 20 s,30个循环;72 ℃延伸10 min,4 ℃保存结束。PCR产物在1%的琼脂糖凝胶检测。提取阴性对照及转基因植株的基因组DNA,BamHⅠ和SacⅠ双酶切基因组DNA序列后,经1%琼脂糖电泳分离后转至尼龙膜上,用DIG 探针合成试剂盒( Roche 公司) 标记上述扩增到潮霉素基因序列DNA,以标记潮霉素基因为探针,按照试剂盒描述的步骤进行Southern 杂交,检测尼龙膜上的基因组酶切产物。
1.4 转基因植株的种子萌发分析和生理指标测定
收获T0转基因阳性植株的种子,采用毛巾卷法[12],在150 mmol/L NaCl溶液中做发芽期耐盐性比较试验[13],在种子发芽后第7天测定棉苗芽长、主根长度和侧根数量;取转基因植株及其对照叶片,采用NBT光下还原法测定SOD活性[14],以抑制光反应50%为一个酶活力单位,酶活力单位为U/g。采用磺基水杨酸提取茚三酮显色法测定脯氨酸(Pro)含量[14],采用硫酸蒽酮比色法测定可溶性糖含量[14],采用硫代巴比妥酸比色法测定丙二醛(MDA)含量[14]。
1.5 转基因植株实时荧光定量PCR反应
以His3作为棉花内参基因,利用ABI实时荧光定量PCR仪(7500型)扩增分析,反应体系含2.0 μL 10×PCR Buffer、0.5 μL 10 mmol/L dNTP Mix、1.0 μL cDNA 第一链模板、10 μmol/L引物各0.5 μL (内标引物序列His3F:5′-CGGTGGTGTAAGAAGCCTCAT-3′,His3R:5′-AATTTCACGAACAAGCCTCTGGAA-3′;qRT-PCR分析引物:GhsodF:5′-GATGGAGAAAGAGGGA
CT-3′,GhsodR:10 μL 2×SYBR (Roche)溶液和0.1 μL高保真Taq酶(5 U/μL),加无菌超纯水至20 μL反应组分。扩增条件为95 ℃ 3 min;94 ℃30 s,50~52 ℃30 s,72 ℃ 40 s,40个循环;72 ℃ 10 min,以熔解曲线结束。采用2-ΔCt法进行数据的相对定量分析[15],计算公式如下,目的基因相对表达量=2-ΔCt;ΔCt=Ct目的基因-CtHis 3。
2 结果与分析
2.1 棉花胞质Cu/Zn-SOD基因的载体构建
在棉花胞质Cu/Zn-SOD的起始密码子和终止子的位置设计了特异引物,按照表达载体引物设计要求在起始密码子和终止子碱基前增加酶切位点和保护碱基,以确保酶切成功并保证装入表达载体后基因不会移码突变,由于起始密码子和终止子处所用酶切位点不同,保证了载体构建过程的基因方向性。重组载体经提取质粒后,以提取质粒为模板,利用特异引物扩增得到了480 bp的基因片段,测序验证序列正确,没有发生变异(图1)。证明已经构建了含有目的基因pCAMGBIA-SOD的表达载体。

1.标准分子量;2.载体扩增检验。1.The molecular weight of the standard;2.Test of carrier amplification.
2.2 转基因植株的获得及其PCR验证
使用农杆菌介导的棉花腋芽遗传转化技术处理100株,待T0长出新叶使用200 mg/L的潮霉素溶液涂抹T0植株叶片,5 d后产生烧灼斑的为阴性未转化成功植株,未有烧灼斑的为阳性转基因植株。经潮霉素抗性筛选共获得25株遗传转化植株。随机选8株转基因阳性材料的叶片为材料,提取DNA,利用潮霉素特异引物扩增8株材料均得到大约500 bp条带,该条带大小与预期潮霉素的基因片段相近,证明所得材料均为含有目的转化基因的植株(图2),报告基因潮霉素基因已经进入转化材料,间接证明胞质Cu/Zn-SOD转入棉花植株。

M.标准分子量;1.阴性植株;2.重组质粒;3.蒸馏水;4~11.转基因阳性植株。M.The molecular weight of the standard;1.The negative plants;2.Recombinant plasmid;3.Distilled water;4-11.Positive transgenic plants.
为进一步阐明转入的基因是否整合到棉花基因组,对PCR验证呈阳性的材料进行Southern Blotting检测,图3是8份转基因棉花植株总DNA的Southern Blotting分析结果,将提取的棉花基因组DNA 经BamHⅠ和SacⅠ双酶切,以潮霉素抗性基因编码区的DNA片段为探针进行Southern Blotting,转基因株系都能检测到潮霉素抗性基因的存在,说明在转基因棉花植株中目标已经整合到受体基因组中。

1.阴性对照;2~9.转基因阳性植株。1.Negative control;2-9.Transgenic lines.
2.3 NaCl胁迫对转基因植株生长的影响
在转基因和非转基因材料耐盐性发芽试验结束时,测定材料芽长,结果显示,非转基因对照材料平均芽长2.63 cm,转基因材料平均芽长4.58 cm;转基因主根长度平均6.85 cm,非转基因对照平均3.56 cm;侧根数量转基因材料平均7.23个/株,非转基因对照平均4.21个/株。结果表明,转基因材料与其未转基因对照比较,在相同盐胁迫浓度下,转基因植株耐盐性增强,证明Cu/Zn-SOD在T1苗期得到表达。
2.4 转基因植株的生理指标比较分析
在转基因和非转基因对照种子耐盐性萌发试验结束时,测定植株叶片的SOD活性结果显示,在非胁迫情况下,转基因与非转基因植株的SOD活性达到显著差异(P<0.05),非转基因材料均值为756 U/g ,而转基因材料均值为1 014 U/g 。这说明转基因材料的SOD活性因新拷贝增加而表达量明显增加;盐胁迫下非转基因材料SOD活性均值为914 U/g ,转基因材料为2 215 U/g ,表明非转基因和转基因材料在逆境诱导下,SOD都被诱导表达,但转基因材料的表达量更高(图4)。叶绿素含量的观测结果显示,对照棉苗的叶片严重失绿,逆境胁迫下总叶绿素含量仅为0.81 mg/g 。转基因棉苗株系的叶片颜色基本正常,总叶绿素含量均值为4.56 mg/g 比对照高出5.6倍(图5);MDA是植物体产生的主要的膜脂过氧化产物之一,能够与细胞内各种成分发生强烈反应,从而引起酶和膜的严重损伤,其含量基本反映了植物遭受胁迫的程度。测定转基因和对照的MDA结果显示:在清水对照下,转基因材料MDA含量略低于对照,在盐胁迫下转基因材料具有较低MDA含量(图6),说明转基因材料具有更强清除质膜过氧化物的能力。Pro含量变化反映了植物受胁迫后的渗透调节能力,从图7可以推知,转基因和对照材料之间在清水处理中几乎没有差异,在盐胁迫下转基因材料的Pro含量略低,这可能是因转基因SOD活性增强,导致盐胁迫危害减轻所致。
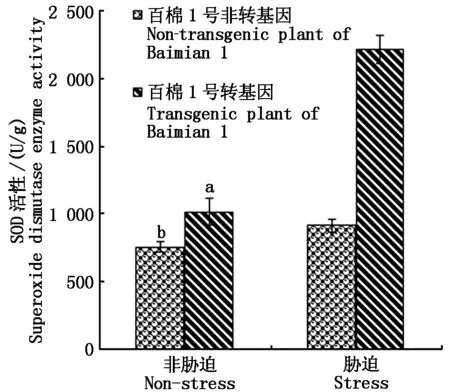
图4 转基因对SOD活性的影响 Fig.4 Genetically modified on the activity of superoxide dismutase
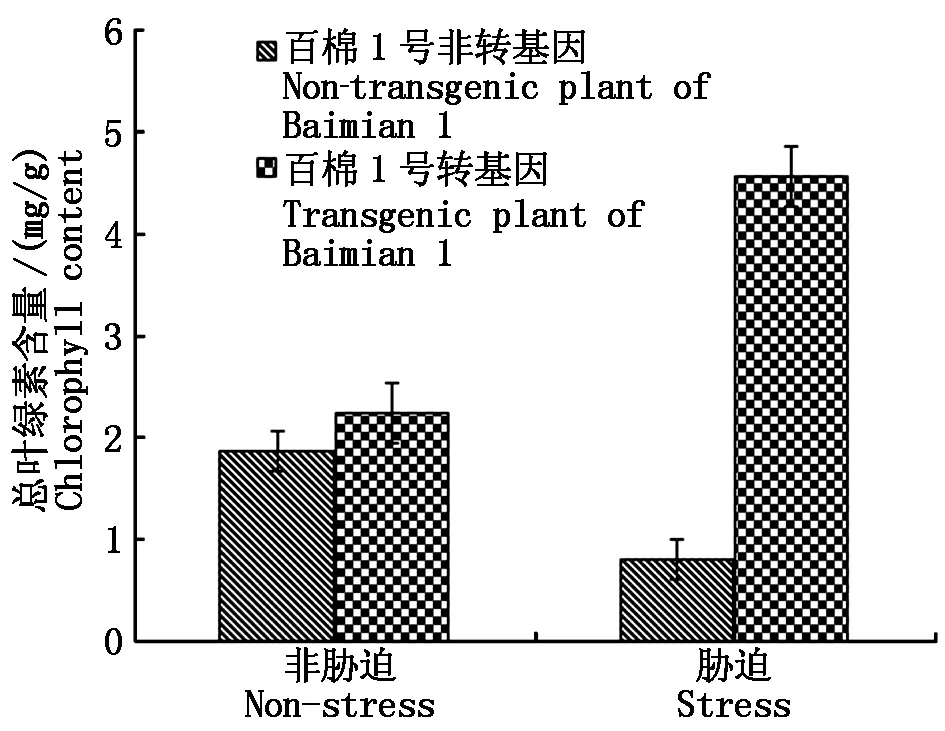
图5 转基因对棉苗叶片叶绿素含量的影响Fig.5 Genetically modified on the chlorophyll content

图6 转基因对棉苗叶片MDA含量的影响Fig.6 Genetically modified on the MDA content
2.5 转基因植株中Cu/Zn-SOD基因的表达
利用qRT-PCR定量分析8株阳性转基因棉花和阴性对照苗中Cu/Zn-SOD的表达水平,结果表明,Cu/Zn-SOD基因在转基因苗叶片中表达水平较高,是非转基因阴性对照的2.5~3.1倍,转基因苗的Cu/Zn-SOD基因表达均高于阴性非转基因对照(图8),因为试验处理条件一致,因此,可以认为转基因材料Cu/Zn-SOD表达量增加是新转入拷贝表达的结果。表明已经得到超表达的转基因材料。

图7 转基因对棉苗叶片游离Pro含量的影响Fig.7 Genetically modified on the proline content

图8 转基因棉花植株中的Cu/Zn-SOD表达水平Fig.8 Expression level of Cu/Zn-SOD in transgenic cotton lines
3 结论与讨论
已有研究显示,植物在盐碱、干旱、水涝等非生物逆境胁迫下,体内产生过量的活性氧类物质对植物造成伤害;植物通过提高体内抗氧保护酶SOD活性增强对多种氧化胁迫的抗性[16-21]。在其他作物中遗传转化SOD基因改良抗逆性的研究已有报道,发现在玉米中超表达小麦Mn-SOD基因,转基因植株抗氧化能力较未转基因的对照显著增强[22];用烟草Mn-SOD基因遗传转化玉米后,玉米叶片具有明显增强的抗氧化能力[23];拟南芥 Fe-SOD基因、番茄和豌豆Cu/Zn-SOD基因遗传转化烟草后,转基因烟草植株抵御干旱逆境能力明显提高[24];张海娜等[25]在烟草中过量表达小麦SOD基因,烟草的抗盐能力有明显增强;马淑娟等[11]将棉花叶绿体Cu/Zn-SOD基因导入烟草,利用百草枯处理转化材料,发现转基因烟草比非转基因烟草对百草枯的耐性有所增强。陆燕元等[26]将Cu/Zn-SOD基因导入甘薯后,甘薯干旱忍耐性增强,这些试验都证实转基因过表达可以增强植物的抗逆性。
本研究对棉花胞质Cu/Zn-SOD基因进行了表达载体构建,获得了过表达转基因植株;因为棉花植株本身含有胞质Cu/Zn-SOD基因,转基因材料验证使用了载体报告基因潮霉素;利用潮霉素进行转基因材料验证准确,没有假阳性。潮霉素对T0的涂抹验证有效验证了遗传转化新基因的表达。若直接对Cu/Zn-SOD进行Southern Blotting验证,理论上仅仅是基因拷贝数的差异,容易产生误差,使用潮霉素基因探针杂交,有效避免了基因组原有基因的影响。转基因T1耐盐性发芽试验表明,在盐胁迫下,转基因材料的主根平均长度、芽长平均长和侧根平均数量均大于阴性对照;进一步测定材料叶片的SOD活性显示非胁迫下,转基因材料高于阴性对照,说明新转入的基因增加SOD基因的基础表达量,在盐胁迫诱导下,阴性对照比其非胁迫下SOD活性也有增加,但转基因材料的酶活性增加倍数更多。进一步分析抗逆相关生理指标,结果显示,转基因植株叶绿素含量高于阴性对照,这可能是因为转化新拷贝基因的表达增加材料的抗氧化能力,使叶绿素更加稳定;MDA是植物细胞膜过氧化产物的反映,MDA的含量降低说明转基因材料与对照相比,转基因材料的抗氧化能力增强,从而导致细胞膜被保护,表现MDA含量降低;Pro是逆境下渗透调节的形式,在清水处理时,因为没有外部胁迫,所以转基因材料与阴性对照没有差别,在胁迫处理时,转基因材料的Pro含量低于阴性对照,可能是转基因材料的抗氧化能力强,导致植株内部胁迫减轻,从而使渗透调节减轻造成的。荧光定量显示转基因植株转Cu/Zn-SOD获得组成性表达,但转基因材料表达量存在差异,其详细机制有待探讨。
在棉花中过量表达胞质Cu/Zn-SOD基因,能增加植株SOD活性,减轻盐分胁迫造成的细胞膜质过氧化,增强植株抵御盐分胁迫的能力。
[1] 马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传,2003,25(2):225-231.
[2] 宋美珍, 喻树迅, 范术丽,等. 短季棉早熟不早衰生化性状的遗传分析[J].西北植物学报,2005,25(5): 903-910.
[3] 沈法富,尹承佾.盐胁迫对棉花幼苗子叶超氧化物歧化酶(SOD)活性的影响[J].棉花学报,1993,5(1):39-44.
[4] 丁锦平,张庆琛,魏 理,等.黄萎菌诱导棉花活性氧及保护酶系的变化研究[J].河南农业科学,2012,41(7):84-87.
[5] 李 丹,吐尔迪·吐尼亚孜,王丽丽,等.棉花抗黄萎病性与叶片保护酶活性和丙二醛含量的关系[J].新疆农业大学学报,2014,37(2):131-136.
[6] 穆西玉,张海艳,赵延明.粗缩病对不同抗性玉米品种叶片生理特性的影响[J].植物生理学报,2014,50(6):801-804.
[7] 陈展宇,李大勇,刘国宁,等.不同产量水平大豆叶片保护酶活性的比较[J].西北农林科技大学学报:自然科学版,2012,40(6):99-103.
[8] 贺 杰,王 伟,胡海燕,等.小麦种子活力与其保护酶活性关系的研究[J].天津农业科学,2012,18(2):17-19.
[9] HU GenHai,YU ShuXun,FAN ShuLi,et al.Cloning and expression of the chloroplast copper/zinc-superoxide dismutase gene in upland cotton (GossypiumhirsutumL.)[J].Journal of Plant Physiology and Molecular Biology,2007,33 (3):197-204.
[9] Hu G H,Yu S X,Fan S L,et al.Cloning and expression of the chloroplast Copper/zinc-superoxide dismutase gene in upland cotton (GossypiumhirsutumL.)[J].Journal of Plant Physiology and Molecular Biology,2007,33(3):197-204.
[10] Hu G H,Yu S X,Fan S L,et al.Cloning and expressing of a gene encoding cytosolic Copper/Zinc superoxide dismutase in the upland cotton[J].Journal of Integrative Agriculture,2007,6(5):101-105.
[11] 马淑娟,喻树迅,范术丽,等.转棉花叶绿体Cu/Zn-SOD基因烟草的获得及其功能的初步验证[J].分子植物育种,2007,5(3):319-323.
[12] 吴振良,刘丽英,戴茂华.利用毛巾卷盐胁迫法快速评价棉花品种的耐盐性[J].河北农业科学,2011,15(10):26-28.
[13] 张国伟,路海玲,张 雷,等.棉花萌发期和苗期耐盐性评价及耐盐指标筛选[J].应用生态学报,2011,22(8):2045-2053.
[14] 张志良,瞿伟菁.植物生理学实验指导[M].3版.台北县:艺轩图书出版社,2009.
[15] Livak K J,Schmittgen T D.Analysis of relative gene expression data using Real-time quantitatve PCR and the 2(-delta deltaC(t))method[J].Method,2001,25(4):402-408.
[16] 刘凯文,苏荣瑞,朱建强,等.棉花苗期叶片关键生理指标对涝渍胁迫的响应[J].中国农业气象,2012,33(3):442-447.
[17] 陈 露,李卓夫,王晓楠,等.低温下冬小麦SOD及APX酶相关基因的表达分析[J].麦类作物学报,2016,36(8):982-988.
[18] 罗桑卓玛,辛福梅,杨小林,等.干旱胁迫对香柏幼苗生长和生理指标的影响[J].西北农林科技大学学报:自然科学版,2015,43(5):51-57,70.
[19] 任学敏,朱 雅,王长发,等.花生生理和农艺性状对冠层温度的影响[J].西北农林科技大学学报:自然科学版,2014,42(10):81-86.
[20] 李晓林,白志元,杨子博,等.黄淮麦区部分主推冬小麦品种越冬及拔节期的抗寒生理研究[J].西北农林科技大学学报:自然科学版,2013,41(1):40-48.
[21] 马宝鹏,逯明辉,巩振辉.辣椒幼苗对高温胁迫的生长生理响应[J].西北农林科技大学学报:自然科学版,2013,41(10):112-118.
[22] Wu G,Wilen R W,Robertson A J,et al.Isolation,chromosomal localization,and differential expression of mitochondrial manganese superoxide dismutase and chloroplastic Copper/Zinc superoxide dismutase genes in wheat[J].Plant Physiology,1999,120(2):513-520.
[23] Van Breusegen F,Slooten L,Stassart J,et al.Effects of over production of tobacco Mn SOD in maize chloroplasts on foliar tolerance to cold and oxidative stress[J].J Exp Bot,1999,50(330):71-78.
[24] Simontacchi M,Caro A,Fraga C G,et al.Oxidative stress affects[alpha]- tocopherol content in soybean embryonic Axes upon imbibition and following germination[J].Plant Physiology,1993,103(3):949-953.
[25] 张海娜,李小娟,李存东,等.过量表达小麦超氧化物歧化酶(SOD)基因对烟草耐盐能力的影响[J].作物学报,2008,34(8):1403-1408.
[26] 陆燕元,邓西平.转入Cu/ZnSOD和APX基因对甘薯旱后复水的恢复作用[J].西北农林科技大学学报:自然科学版,2010,38(1):67-74.

