黄瓜种子采前发芽性状的数量遗传分析
曹明明 王惠哲 邓 强杨瑞环 李淑菊
(天津科润黄瓜研究所,蔬菜种质创新国家重点实验室,天津 300192)
种子是植物重要的生殖器官。种胚发育完成后,不经过或经过极为短暂的休眠期就在母体植株上萌动发芽的现象被称为采前发芽(pre-harvest sprouting,PHS)。在小麦(巨伟 等,2015)、水稻(张静 等,2013)、玉米(余庆茹,2010)等大田作物中,采前发芽现象一般被称为穗发芽,严重威胁作物种子的产量与品质。目前,针对大田作物穗发芽性状的研究深入而广泛(Groos et al.,2002;Imtiaz et al.,2008;Kulwal et al.,2012;Albrecht et al.,2015;Shu et al.,2015)。 黄 瓜(Cucumis sativusL.)种子也存在采前发芽的现象,并且在品种间存在极大差异(曹明明 等,2016)。发生采前发芽的黄瓜种子混入商品用种后会造成种子发芽率显著降低,出苗不齐,幼苗畸形,严重降低种用价值(庞金安 等,2002)。在黄瓜种子生产中,一般通过提前采收的方法避免采前发芽,但是提前采收的黄瓜种子饱满度不足,并且部分种子可能发育不全,降低了种子产量和发芽率。
黄瓜种子采前发芽会同时受到环境条件和内部因素的影响,但起决定性作用的是内因,即遗传基因(庞金安 等,2002)。因此,从遗传角度出发,分析遗传规律,揭示采前发芽性状的遗传与发生的机制,有望找到避免黄瓜种子采前发芽的方法。本试验以极具代表性的黄瓜自交系Q12和P60为亲本,通过6世代家系群体构建,利用植物数量性状主基因+多基因混合遗传模型分析方法,获得黄瓜种子采前发芽性状的遗传规律,为黄瓜抗种子采前发芽育种材料改良和品种选育提供了理论依据,对加快黄瓜抗种子采前发芽新品种选育,促进我国黄瓜产业发展具有重要意义。
1 材料与方法
1.1 试验材料
以黄瓜自交系Q12(P1)和P60(P2)为亲本构建6世代家系群体,其中Q12不发生种子采前发芽,P60极易发生种子采前发芽,性状表现稳定(图1)。试验材料由天津科润黄瓜研究所育种一室提供。
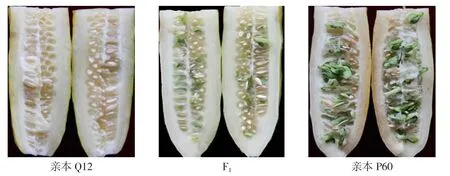
图1 亲本Q12、P60及其F1种子发生采前发芽情况
1.2 试验方法
1.2.1 材料种植与性状调查 试验材料种植于天津科润黄瓜研究所武清试验场塑料大棚中,双行高畦播种,滴灌灌溉,田间常规管理。
2015年春季播种亲本P1、P2,自交并杂交配制 F1(P1×P2)。2015 年 秋 季 播 种 P1、P2、F1,F1分别与双亲 P1、P2杂交获得 B1〔(P1×P2)×P1〕、B2〔(P1×P2)×P2〕。双亲自交留种,F1自交获得F2。2015年11月收获各群体种子。
2016 年春季播种 P1、P2、B1、B2、F2,其中 P1种植150株,P2种植60株,B1、B2各种植120株,F2种植 350 株。自交授粉获得 P1、P2、B1:2、B2:2、F2:3种子,P1与P2杂交,获得F1群体种子,统计各群体种子采前发芽率。不同群体随机区组种植,授粉时挂牌标记授粉时间;单株坐瓜2条,保证群体单株间黄瓜果实大小一致;选取同一日授粉的种瓜,于授粉后45 d采种并统计瓜内种子采前发芽率。黄瓜种子采前发芽率=采前发芽种子数/种子总数×100%。各世代群体采前发芽率利用Excel 2010软件进行反正弦平方根转换后用于数据分析。
1.2.2 数据处理与分析 利用植物数量性状主基因+多基因混合遗传模型的多世代联合分析方法(盖钧镒 等,2003),对6个家系世代种子采前发芽率数据进行分析。通过极大对数似然值及AIC值的比较选取备选遗传模型,并进行适合性检验,获得最优遗传模型。利用最小二乘法估算一阶遗传参数,进而估算出主基因及多基因方差、遗传率等二阶遗传参数。数据分析采用盖钧镒等(2003)的计算软件进行分析。
2 结果与分析
2.1 黄瓜种子采前发芽率的次数分布
黄瓜种子采前发芽率的次数分布如表1所示,亲本P1种子不发生采前发芽,亲本P2平均采前发芽率为65.11%,且呈现偏正态单峰分布,F1种子平均采前发芽率低于中亲值,为13.96%。F1、B1:2为偏正态单峰分布,B2:2与 F2:3为双峰分布,呈现主基因+多基因遗传特征,说明黄瓜种子采前发芽性状属于数量性状,需要进一步进行数量遗传分析。
2.2 遗传模型的选择与适合性检验
比较1对主基因(A)、2对主基因(B)、多基因(C)、1对主基因+多基因(D)、2对主基因+多基因(E)共计5大类24种遗传模型的极大对数似然值和AIC值(表2),D-1、D-3和D-4遗传模型的AIC值相对较小,分别为4 990.380、4 989.533和4 995.189,依据AIC值较小的原则可选作备选模型。通过备选模型的适合性检验,选择统计量达到差异显著水平的个数最少的模型作为最佳遗传模型。从表3可以看出,备选模型D-1、D-3、D-4达到显著性差异的个数分别为7、11、12个。虽然D-1模型的AIC值略高于D-3,但是D-1模型的统计量显著性差异个数最少。D-4模型的AIC值和显著性差异个数在3个模型中最大。因此D-1模型,即1对加性-显性主基因+加性-显性多基因混合遗传为黄瓜种子采前发芽性状遗传的最适模型。
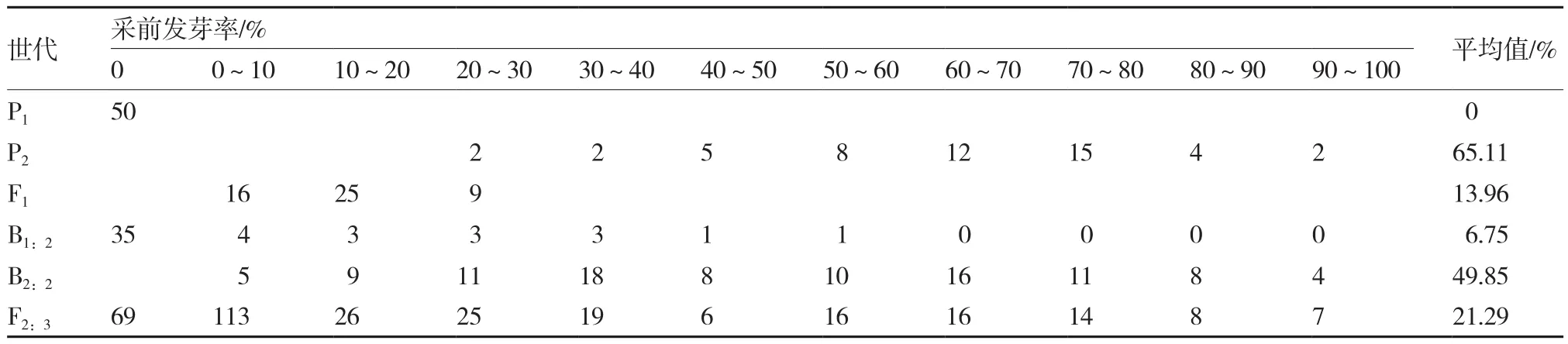
表1 6世代家系黄瓜种子采前发芽率的次数分布

表2 黄瓜种子采前发芽性状遗传模型的极大对数似然值和AIC值
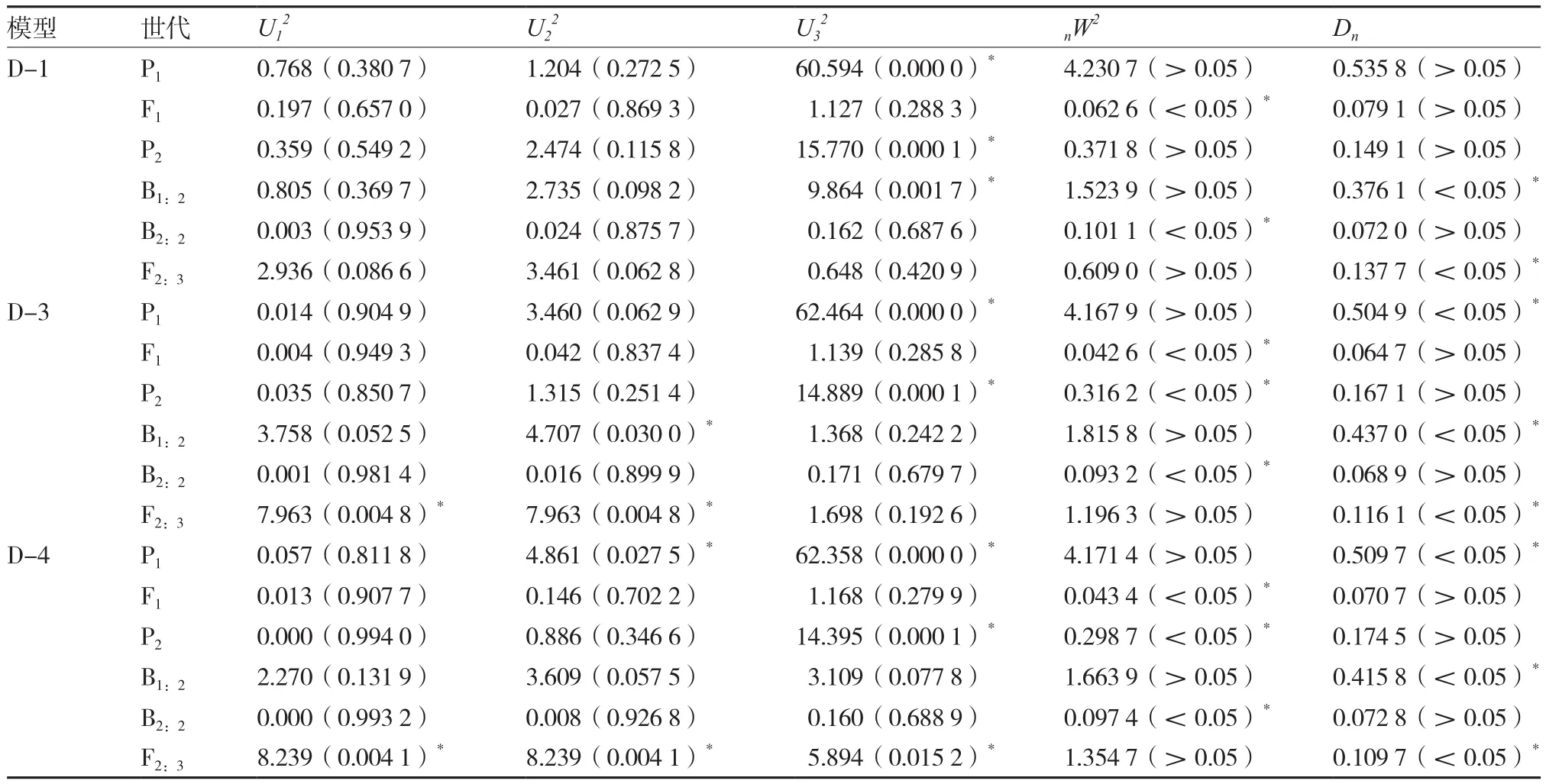
表3 黄瓜种子采前发芽性状备选遗传模型适合性检验
2.3 黄瓜种子采前发芽性状的遗传参数估计
利用最小二乘法估算出D-1模型下黄瓜种子采前发芽性状的一阶遗传参数和二阶遗传参数。如表4所示,遗传主基因加性效应d为负值,显性效应h为正值,说明黄瓜种子采前发芽性状会同时受到主基因加性负效应和显性正效应的控制。遗传多基因加性效应〔d〕和显性效应〔h〕均为负值,表明采前发芽性状会同时受到多基因加性负效应和显性负效应的控制。主基因的显性正效应对种子发生采前发芽性状有促进作用,同时,主基因和多基因的加性负效应及多基因的显性负效应均有抑制黄瓜种子采前发芽的作用。
在B1:2和F2:3家系世代中,主基因的遗传率分别为76.38%、87.54%,多基因的遗传率分别为3.12%、3.36%,主基因遗传率明显高于多基因遗传率,说明主基因对黄瓜种子采前发芽性状起主要的控制作用。但B2:2家系世代的主基因与多基因的遗传率较接近。3个家系群的主基因+多基因的遗传率较高,表明黄瓜种子采前发芽性状主要受遗传基因的控制。

表4 D-1遗传模型下黄瓜种子采前发芽性状的遗传参数估计
3 结论与讨论
种子休眠性与采前发芽性状存在极大相关性(Shu et al.,2015),笔者从多年的黄瓜育种经验总结发现:种子休眠性强的黄瓜品种一般不会发生采前发芽,休眠性弱的黄瓜品种容易发生采前发芽。但是,黄瓜种子休眠性与采前发芽性状的遗传存在一定差异,唐慧珣和司龙亭(2013)通过测定采收干燥后的黄瓜种子发芽率,分析黄瓜种子休眠性遗传规律,发现黄瓜种子休眠性遗传符合1对加性-显性主基因+加性-显性-上位性多基因模型(D-0)。本试验结果显示,黄瓜种子采前发芽性状遗传符合D-1模型,即1对加性-显性主基因+加性-显性多基因混合遗传。
为保证黄瓜种子在瓜腔内充分发芽,本试验控制黄瓜采种时间为授粉后45 d,种子能够发育成熟,采前发芽种子在瓜腔内均匀分布,尽量避免了环境因素的影响。在同一条种瓜内,同时存在采前发芽和不发芽的种子,黄瓜种子采前发芽性状表现出受种胚基因型控制。在F2群体中,单株自交获得F3种子并统计采前发芽率,采前发芽率的差异能够表现出 F2群体的遗传分离。在 B1:2、B2:2、F2:3群体中,黄瓜种子采前发芽性状的主基因+多基因遗传率分别为79.49%、86.77%、90.90%,表明采前发芽性状主要受遗传基因的控制,这与庞金安等(2002)的报道相一致。植物数量性状的分离分析方法是依据数量性状的特点建立的一种基本假设,主基因+多基因混合模型分析与利用分子检测的QTL存在必然的对应关系(殷剑美 等,2003)。因此本试验对后续进行黄瓜种子采前发芽性状的QTL定位提供了技术指导。
我国是世界上黄瓜栽培面积最大的国家,优质的黄瓜种子是我国黄瓜生产栽培的重要保证。天津科润黄瓜研究所从事黄瓜育种工作30余年,多个黄瓜品种存在采前发芽问题,如津优48号、津优12号、津优335号等,在种子繁育过程中,常常因为采前发芽问题,种子质量不合格,严重限制了黄瓜品种的销售与推广。揭示黄瓜种子采前发芽性状的遗传规律,能为黄瓜育种材料筛选及杂交组合选配提供理论依据。同时本试验结果为揭示采前发芽性状的遗传与发生机制奠定了基础,对加快黄瓜抗种子采前发芽新品种选育,促进我国黄瓜产业发展具有重要意义。
曹明明,管炜,王惠哲,邓强,李淑菊,杨瑞环.2016.黄瓜种子采前发芽的研究进展.天津农业科学,22(2):127-130.
盖钧镒,章元明,王建康.2003.植物数量性状遗传体系.北京:科学出版社.
巨伟,郭玉平,樊梅,田汝美,吕娟,栗红梅,张友秋.2015.小麦抗穗发芽研究进展.种子世界,(1):22-24.
庞金安,李怀智,马德华.2002.蔬菜作物种子采前发芽研究进展.天津农业科学,8(3):42-46.
唐慧珣,司龙亭.2013.黄瓜种子休眠性的数量遗传分析.园艺学报,40(3):549-554.
殷剑美,武耀廷,朱协飞,张天真.2003.陆地棉产量与品质性状的主基因与多基因遗传分析.棉花学报,15(2):67-72.
余庆茹.2010.利用基因芯片技术研究玉米穗发芽基因差异表达〔硕士论文〕.成都:四川农业大学.
张静,林泽川,曹立勇,沈希宏.2013.水稻种子穗发芽与休眠性遗传研究进展.核农学报,(8):1136-1142.
Albrecht T,Oberforster M,Kempf H,Ramgraber L,Schacht J,Kazman E,Zechner E,Neumayer A,Hartl L,Mohler V.2015.Genome-wide association mapping of preharvest sprouting resistance in a diversity panel of European winter wheats.Journal of Applied Genetics,56(3):1-9.
Groos C,Gay G,Perretant M R,Gervais L,Bernard M,Dedryver F,Charmet G.2002.Study of the relationship between preharvest sprouting and grain color by quantitative trait loci analysis in a whitexred grain bread-wheat cross.Theoretical Applied Genetics,104(1):39-47.
Imtiaz M,Ogbonnaya F C,Oman J,van Ginkel M.2008.Characterization of quantitative trait loci controlling genetic variation for preharvest sprouting in synthetic backcross-derived wheat lines.Genetics,178:1725-1736.
Kulwal P,Ishikawa G,Benscher D,Feng Z,Yu L X,Jadhav A,Mehetre S,Sorrells M E.2012.Association mapping for preharvest sprouting resistance in white winter wheat.Theoretical &Applied Genetics,125(4):793-805.
Shu K,Meng Y J,Shuai H W,Liu W G,Du J B,Liu J,Yang W Y.2015.Dormancy and germination:how does the crop seed decide?Plant Biology,17(6):1104-1112.

