海洋沉积物中产酶酵母的分离筛选
周治东,骆巧琦,李海平,张跃平,连张飞,张丽艳
(1.福建海洋研究所,福建 厦门 361013;2.福建省海陆界面生态环境联合重点实验室,福建 厦门 361005;3.福建省海岛与海岸带管理技术研究重点实验室,福建 厦门 361013)
海洋沉积物中产酶酵母的分离筛选
周治东1,2,骆巧琦1,2,李海平1,3,张跃平1,2,连张飞1,张丽艳1,3
(1.福建海洋研究所,福建 厦门 361013;2.福建省海陆界面生态环境联合重点实验室,福建 厦门 361005;3.福建省海岛与海岸带管理技术研究重点实验室,福建 厦门 361013)
随着我国水产养殖业的不断发展,传统饲料受成本高、品质不稳定等因素的影响已经不能满足发展需求,因而对水产微生物制剂等新型养殖饲料的开发迫在眉睫。筛选能够分泌胞外消化酶的酵母菌株对水产养殖饲料的开发应用具有重要意义。本研究以海洋沉积物为载体,从中分离筛选出能够分泌胞外消化酶的酵母菌株44株。其中能够分泌淀粉酶的有15株,能够分泌蛋白酶的有12株,能够分泌胞外脂肪酶的有21株,能够分泌纤维素酶的有14株,而有两株酵母HY-27与HY-37能够分泌全部四种消化酶。笔者对这两株酵母进行了初步鉴定,鉴定结果分别为Sporidioboluspararoseus与Sporobolomycespatagonicus,并将之作为开展微生物制剂后续研发工作的重点突破对象。
酵母;淀粉酶;蛋白酶;脂肪酶;纤维素酶;水产养殖
我国的水产养殖总产量已连续多年居世界第一,而水产饲料的供应水平是水产养殖的必要条件和物质基础,被称作水产养殖业的粮草。因此,水产养殖行业的发展一直依赖于饲料行业的发展水平。水产动物对饲料蛋白质水平的要求较高,一般要求占配方的25%~50%,为畜禽的2~4倍,甚至更多。饲料中蛋白质的含量与品质不仅决定了饲养动物的生长速度与健康状况,而且也是水产养殖经济效益的重要影响因素之一。因此,蛋白质来源的成本是水产养殖饲料成本的重要组成部分。传统的鱼粉,由于过度捕捞致使多种用于鱼粉和鱼油生产的水生动物供应数量急剧下降,加上产品质量参差不齐,远远不能满足我国饲料工业发展的需求,因此,探索开发新型饲料迫在眉睫。单细胞微生物因蛋白质含量高,必需氨基酸含量丰富且组成均衡,正日益成为饲料工业的研究热点[1-3]。
益生菌(Probiotics)包括酵母培养物、活菌制剂、微生态制剂等产品。益生菌具有促进生长、提高饲料利用率、提高抗病力和改善肉质等作用,同时又具备无毒副作用、无残留、不产生抗药性、不污染环境等抗生素药物所不具备的优点,因此,其被广泛用作添加剂、水质改良剂[4-7]。为提高水产养殖饲料的利用率及养殖对象的生长效率,研究筛选出能够分泌淀粉酶、蛋白酶、脂肪酶和胞外纤维素酶的酵母菌株,对水产养殖饲料的应用开发具有重要意义。
1 材料与方法
1.1 海洋沉积物
本文所用海洋沉积物均为笔者所在团队出海时于福建周边海域利用采泥器采样所得。采样方法参照《海洋调查规范 第6部分:海洋生物调查》[8]。
1.2 培养基
1.2.1 分离纯化基础培养基
YPD培养基(W/V):分别称取1%酵母提取物、2%胰蛋白胨、2%葡萄糖,加经过滤的海水配制,121℃高压灭菌20 min。若配制固体培养基,则加入1.5%琼脂。
1.2.2 淀粉酶筛选培养基
淀粉酶筛选培养基(W/V):分别称取1%酵母提取物、2%胰蛋白胨、2%可溶性淀粉、1.5%琼脂,用过滤海水配制,121℃高压灭菌20 min。
碘原液:分别称取0.5 g碘结晶和5.0 g碘化钾加蒸馏水溶解并定容至100 mL。
1.2.3 蛋白酶筛选培养基
蛋白酶筛选培养基(W/V):分别称取1%酵母提取物、2%脱脂奶粉、1.5%琼脂,用过滤海水配制,121℃高压灭菌20 min。
1.2.4 脂肪酶筛选培养基
脂肪酶筛选培养基(W/V):取1%酵母提取物、2%胰蛋白胨、2%吐温80、1.5%琼脂,用过滤海水配制,121℃高压灭菌20 min。
1.2.5 纤维素酶筛选培养基
纤维素酶筛选培养基(W/V):取1%酵母提取物、2%胰蛋白胨、2%羧甲基纤维素钠(CMC-Na),用过滤海水配制,121℃高压灭菌20 min。
刚果红溶液配制:配制质量浓度为10 mg/mL的刚果红溶液,灭菌后,按照每200 mL培养基加入1 mL的比例加入刚果红溶液,混匀后倒平板。
1.3 实验方法
1.3.1 菌株的分离纯化
采用稀释涂布平板法,分别称取1.0 g沉积物样品,以10 mL无菌海水悬浮混匀,取100 μL混匀液均匀涂布于YPD培养基平板上。于28℃培养7~15 d后,根据菌落形态进行简单归类,挑取不同类型菌落划线纯化至形态单一后,保种。
1.3.2 产酶菌株筛选
将待测酵母菌株在YPD 培养基上活化后,用牙签挑取单菌落画小圆圈接种于相应筛选培养基上,28℃培养7~15 d后,观察形成透明圈的情况或是加入特定试剂进行显色实验。
1.3.3 菌株鉴定
酵母菌于YPD平板28℃培养48 h,采用CTAB法提取酵母菌DNA[9],扩增ITS序列,引物选用ITS5(5’- GGAAGTAAAAGTCGTAACAAGG -3’)和ITS4(5’-TCCTCCGCTTA TTGATATGC-3’)[10]。反应在50 μL体系中进行,体系含有 10×buffer 5 μL、 MgCl22 mmol/L、dNTP 400 μmol/L、ITS5 10 pmol、ITS4 10 pmol、DNA模板2 μL(约50~200 ng)、Taq聚合酶4 U,以及ddH2O 23.2 μL。反应程序为:95℃预变性4.0 min,进入循环,95℃变性1.5 min,52℃退火1.5 min,72℃延伸1.5 min,36个循环,最后72℃延伸10 .0 min,4℃保存。用吸附柱式PCR产物回收试剂盒(OMEGA公司)纯化PCR产物,纯化的PCR产物在上海美吉公司测序。
1.3.4 系统进化树分析
测得的序列去除载体后用BLASTn在NCBI数据库中的序列进行比对。把ITS同源性≥98% 的序列归为一个种系型(Nilsson等报道子囊菌ITS 序列的种间差异为1.96%[11]),每种种系型选择一个序列作为代表,用 Clustal X 软件[12]进行完全比对。利用 MEGA(Molecular evolutionary genetics analysis[13])软件的邻位加入法(Neighbor-joining method,NJ)建立系统进化树,同时使用1 000次重复的自展分析(Bootstrap analysis,BA)来检验系统发育树的可信度。
2 结果与讨论
2.1 沉积物样品中酵母菌的分离纯化
对海洋沉积物样品进行酵母菌的分离培养实验,划线纯化后共得到不同形态的酵母菌株44株(表1)。

表1 酵母菌株分离纯化信息汇总
2.2 淀粉酶筛选结果
采用淀粉酶筛选培养基对44株酵母菌接种培养7~15 d,用碘液进行显色反应后,筛选出15株酵母可分泌体外淀粉酶(表2)。其中HY-33、HY-27、HY-28、HY-21四株酵母菌产生的透明圈较大。部分产淀粉酶菌株实验效果如图1所示。

表2 淀粉酶分泌菌株筛选结果

续表2
注:透明圈直径与菌体直径差值1~5 mm范围内用+;5~10 mm范围内用++;>10 mm范围用+++。
Notes:The difference between transparent circle diameter and the cell diameter in the range of 1~5 mm used +, 5~10 mm used++,range for>10 mm used +++.

注:a为产淀粉酶菌株HY-21,其实验结果显示阳性;b为不产淀粉酶菌株,显示阴性。
Notes:Picture a was strain HY-21 producing amylase,and its experimental result was positive.Picture b was a strain not producing amylase,showing negative result.
2.3 蛋白酶筛选结果:
采用蛋白酶筛选培养基对44株酵母菌进行培养7~15 d,发现有12株酵母能够分泌胞外蛋白酶(表3),观察可知菌株HY-27与HY-39产生的透明圈较大。图2列举了部分产蛋白酶菌株的实验效果。

表3 蛋白酶分泌菌株筛选结果
注:透明圈直径与菌体直径差值1~5 mm范围内用+;5~10 mm范围内用++;>10 mm范围用+++。
Notes:The difference between transparent circle diameter and the cell diameter in the range of 1~5 mm used+, 5~10 mm used++,range for>10 mm used+++.

注:a图为产蛋白酶菌株(箭头指向菌株HY-27水解圈外缘),b图箭头指向不产蛋白酶菌株。
Notes:Picture a was strains HY-27 producing protease(arrow pointing to the outer hydrolysis ring),arrow of picture b pointing to the strain which couldn’t produce protease.
2.4 脂肪酶筛选结果:
采用脂肪酶筛选培养基对44株酵母菌培养7~15 d,发现有21株酵母能够分泌胞外脂肪酶(表4),观察可知HY-10、HY-32、HY-13、HY-15四株产淀粉酶浑浊圈较大。部分产脂肪酶菌株实验效果如图3所示。

表4 脂肪酶分泌菌株筛选结果
注:浑浊圈直径与菌体直径差值1~5 mm范围内用+;5~10 mm范围内用++;>10 mm范围用+++。
Notes:The difference between turbid circle diameter and the cell diameter in the range of 1~5 mm used+, 5~10 mm used++,range for>10 mm used+++.
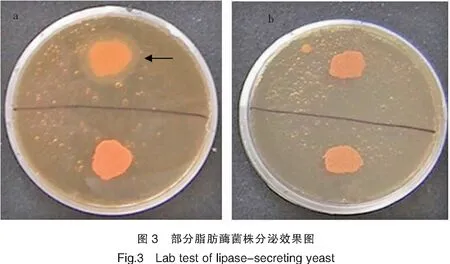
注:a图箭头指向产酶菌株HY-10混浊圈外缘,b图为不产淀粉酶菌株。
Notes:Arrow of picture a was pointing to the turbid ring edge of strain HY-10 producing enzyme,picture b was a strain not producing amylase.
2.5 纤维素酶筛选结果:
采用脂肪酶筛选培养基对44株酵母菌进行培养7~15 d,观察可知有14株酵母能分泌胞外纤维素酶(表5),测量发现菌株HY-39与HY-29产生的透明圈较大。图4显示了部分菌株的筛选实验结果。
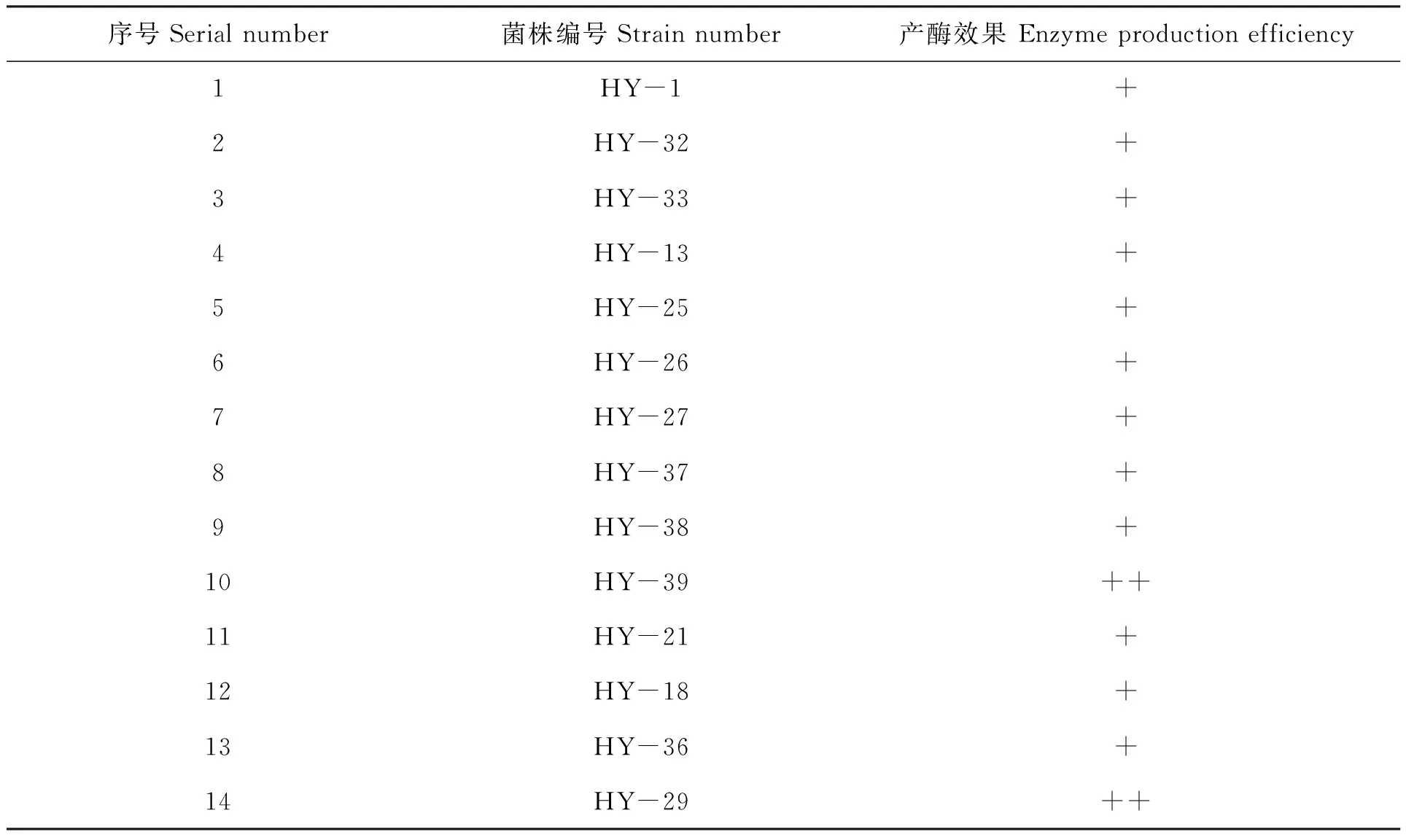
表5 纤维素酶分泌菌株筛选结果
注:透明圈直径-菌体直径差值1~5 mm范围内用+;5~10 mm范围内用++;>10 mm范围用+++。
Notes:The difference between transparent circle diameter and the cell diameter in the range of 1~5 mm used+, 5~10 mm used++,range for>10 mm used+++.

注:a图中箭头所指向菌落为产胞外纤维素酶菌株HY-26,b图箭头指向不产胞外纤维素酶菌株。
Notes:Arrow of picture a was pointing to the enzyme producing strain HY-26,picture b was a strain not producing extracellular cellulase.
2.6 四种消化酶酶筛选结果汇总
对消化酶筛选实验的结果进行汇总,统计显示所纯化出的酵母菌株中有2株能够分泌4种消化酶,8株可分泌3种消化酶,7株可分泌2种酶,其中 HY-27和HY-37可分泌四种酶(表6)。

表6 分泌两种以上消化酶菌株筛选结果汇总
注:透明圈(浑浊圈)直径-菌体直径差值1~5 mm范围内用+;5~10 mm范围内用++;>10 mm范围用+++;-表示阴性。
Notes:The transparent circle(turbid ring)diameter and the cell diameter difference in the range of 1~5 mm used+, 5~10 mm used++,range for>10 mm used+++,enzyme producing negative used -.
2.7 对HY-27与HY-37的菌种初步鉴定
经引物扩增两株目标菌种的ITS序列后测序,测得的序列去除载体后用BLASTn在NCBI数据库中的序列进行比对,从中选出同源性较高的菌株序列构建系统发育树(图5)。通过系统发育树比较,HY-27与Sporidioboluspararoseus聚为同一分支,且相似度高达100%;HY-37与Sporobolomycespatagonicus聚为同一分支,相似度高达99%。因此,可将HY-27初步鉴定为Sporidioboluspararoseus,HY-37初步鉴定为Sporobolomycespatagonicus。

3 讨论
众所周知,我国水产养殖业发展迅速,集约化养殖规模不断扩大。为了防止养殖过程中病害的暴发,抗生素被大量使用。但是抗生素导致耐药性的产生及残留药物通过食物链影响人类健康等问题日益突出。因此,寻找新型环保的抗生素替代品成为了当下的研究热点[14-16]。益生菌作为替代抗生素成为新型的饲料添加剂,受到人们的广泛关注。研究表明,益生菌具有增强养殖动物免疫力、促进饵料的消化吸收、改善养殖环境等作用。益生菌本身无毒无害,不残留,不产生抗药性,是未来水产养殖产业的应用研究重点[6,16-19]。酵母作为益生菌的一种,已广泛应用于生产实践当中。酵母培养物是一种酵母发酵产品,包括酵母菌细胞、代谢产物和培养基三个组成部分,含有丰富的营养物质。酵母培养物可作为一种微生态制剂,用来调节水产动物肠道的微生态平衡,从而提高水产动物的生产性能。如酵母菌的细胞壁(β-葡聚糖和甘露寡糖)与胞溶性物质(蛋白质、维生素、核酸、消化酶、促生长因子和较齐全的氨基酸)具有良好的适口性和免疫促生长作用,对水产动物来说是集营养、防御病害为一体的饲料添加剂。已有研究表明酵母可以促进虹鳟的生长发育和免疫保护[20];促进罗非鱼的生长、提高存活率和免疫力[21]。酵母,一方面可以作为饲料提供营养,也叫饲料酵母;另一方面可以改善宿主肠道内消化酶活性,帮助消化。酵母在液态培养基中大量生长繁殖,生产单细胞蛋白。酵母细胞中富含蛋白质、核酸、维生素、多种消化酶,能促进动物的消化吸收,提高饲料利用率,促进生长。
为了提高水产养殖中饲料的利用率及养殖对象生长效率,研究筛选能够分泌淀粉酶、蛋白酶、脂肪酶以及胞外纤维素酶的酵母菌株,这对水产养殖饲料的应用开发具有重要意义。本文以福建省近海沉积物为来源,分离纯化出44株不同形态的酵母菌株,并对所得菌株体外消化酶(淀粉酶、蛋白酶、脂肪酶、纤维素酶)分泌情况进行了筛选,发现两株酵母(HY-27与HY-37)具有分泌全部四种酶的能力。对这两株酵母菌株扩增ITS序列并测序后构建系统进化树,将HY-27与HY-37初步鉴定为Sporidioboluspararoseus和Sporobolomycespatagonicus。接下来的工作还将结合生产,对产酶菌株与宿主之间的作用机制进行进一步地探索,了解菌株在养殖实践中的实际作用效果,从而达到将之应用于生产实践的最终目的。
[1]冷向军.浅谈我国的水产饲料行业标准[J].饲料工业,2009,30(10):55-58.
[2]麦康森.中国水产养殖与水产饲料工业的成就与展望[J].科学养鱼,2010,(11):1-2.
[3]刘建静,杨曙明.单细胞蛋白质饲料的开发与利用[J].黑龙江畜牧兽医,2008,(4):21-22.
[4]王祥红,李军,纪伟尚,等.有益微生物在水产养殖中的应用[J].海洋湖沼通报,1998,(1):33-39.
[5]韩士群,刘海琴,周建农,等.有益微生物饲料添加剂对水体生态和鱼生长的影响[J].江苏农业科学,2005,(2):91-94.
[6]彭运平,何小雄.益生菌与益生元[J].食品工业,2003,(2):40-41.
[7]王艳池,王宇.有益微生物在水产养殖中的应用[J].河北渔业,2011,(10):60-61.
[8]中华人民共和国国家质量监督检验检疫局,中国国家标准化管理委员会.GB/T 12763.6—2007海洋调查规范 第6部分:海洋生物调查[S].北京:中国标准出版社,2007
[9]Lee S B,Taylor J W.34-Isolation of DNA from fungal mycelium and single spores[M].Polymer-ase Chain Reaction Protocols,1990:282-287.
[10]White T J,Bruns T D,Lee S B,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M].Polymerase Chain Reaction Protocols,1990:315-322.
[11]Nilsson R H,Kristiansson E,Ryberg M,et al.Intraspecific ITS variability in the kingdom Fungi asexpressed in the international sequence databases and its implications for molecular species identific-ation[J].Evolutionary bioinformatics online,2008,4:193-201.
[12]Tang Z,Blacquiere G,Leus G.Clustal W and Clustal X version 2.0[J].Bioinformatics,2007,23(21):2947-2948.
[13]Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular biology and evolution,2014,28(10):2731-2739.
[14]孟小亮,陈昌福,高宇,等.一株黄颡鱼肠道益生菌的筛选与鉴定[J].华中农业大学学报,2010,29(2):208-212.
[15]杨志平,孙飞雪,刘志明,等.刺参肠道潜在产酶益生菌的筛选与鉴定[J].大连海洋大学学报,2013,28(1):17-20.
[16]邵虎.不同分类鉴定方法在益生菌菌株研究中的应用[J].农业科技与装备,2010,(7):27-30.
[17]文国樑,袁翠霖,李卓佳,等.罗非鱼养殖系统中蛋白酶产生菌株的筛选与鉴定[J].中国渔业质量与标准,2014,4(1):38-42.
[18]张磊,赵志刚.益生菌在水产养殖中的应用[J].北京水产,2006,(2):52-56.
[19]周国勤,陈树桥,茆建强,等.益生菌在水产养殖方面的研究进展[J].安徽农业科学,2006,34(11):2421-2425.
[20]Barnes M E,Durben D J,Reeves S G,et al.Dietary yeast culture supplementation improves initial rearing of McConaughy strain rainbow trout[J].Aquaculture Nutrition,2006,12(5):388-394.
[21]Yao Z Z F.The effect of dietary saccharoculture on growth performance,non-specific immunity and autochthonous gut microbiota of gibel carpCarassiusauratus[J].Journal of Aquaculture & Research Development,2012,s1(8):499-507.
Screeningofmarineenzymeproducingyeastanditsapplicationinaquaculture
ZHOU Zhidong1,2, LUO Qiaoqi1,2,LI Haiping1,3,ZHANG Yueping1,2,LIAN Zhangfei1,ZHANG Liyan1,3
(1.Fujian Institute of Oceanology,Xiamen 361013,China;2.Fujian Provincial Key Laboratory of Coastal Ecology and Environmental Studies,Xiamen 361005,China;3.Fujian Provincial Key Laboratory of Coast and Island Management Technology Study,Xiamen 361013,China)
With the continuous development of aquaculture in our country,the traditional feed have been unable to meet the development needs of aquaculture due to its high cost,unstable quality and other factors.It is urgent to develop new type feed for aquaculture microorganism preparation.Screening yeast strains which are capable of secreting extracellular digestive enzymes are of great significance for the development and application of aquaculture.In this study,44 strains of yeast strain which cowld secrete extracellular digestive enzymes were isolated and screened from marine sediments.Among them,there were 15 strains which could produce amylase,12 strains could secrete protease,21 strains could secrete extracellular lipase,and 14 strains could secrete cellulase.It was worth mentioning that there were two yeast of HY-27 and HY-37 could secrete all four digestive enzymes,then the author conducted a preliminary identification of the two strains of yeast.the identification results wereSporidioboluspararoseus(HY-27) andSporobolomycespatagonicus(HY-37).
yeast;amylase;protease;lipase;cellulase;aquiculture
2017-09-15
福建省公益类科研院所专项(2014R1006-7、2015R1006-3);福建省海洋经济创新发展区域示范项目(2014FJ-16);“十三五”厦门市海洋经济创新发展示范项目(16PZY002SF-18).
周治东(1985-),男,辽宁省辽阳市人,助理研究员,硕士,从事海洋生物学研究.E-mail:nirvananan@163.com
周治东,骆巧琦,李海平,等.海洋沉积物中产酶酵母的分离筛选[J].渔业研究,2017,39(6):444-454.
Q933
A
1006-5601(2017)06-0444-11

