PEDF、END在UUO肾组织的表达及ADSCs对其的影响*
吕春燕,杨天林,李进辉,吴程,王丽,陈昌金,赵梓亦
(成都中医药大学临床医学院 1.病理科,2.中心实验室,四川 成都 610072)
PEDF、END在UUO肾组织的表达及ADSCs对其的影响*
吕春燕1,杨天林1,李进辉1,吴程1,王丽1,陈昌金2,赵梓亦2
(成都中医药大学临床医学院 1.病理科,2.中心实验室,四川 成都 610072)
目的动态观察大鼠单侧输尿管梗阻(UUO)肾组织中色素上皮衍生因子(PEDF)及内皮抑素(END)的变化,以及脂肪干细胞(ADSCs)对其的影响。方法复制UUO动物模型,以ADSCs进行干预,选取UUO术后第3、7和14天为时间点,观察大鼠在UUO后肾损伤及纤维化的进程,以及PEDF和END蛋白的表达变化。结果肾损伤、纤维化程度及PEDF的表达随梗阻时间延长而加重或增加。END在术后先增加后降低,但仍高于对照组。ADSCs干预在各个时间点均能使END和PEDF的表达降低。结论UUO后PEDF和END蛋白表达上调可能是梗阻后微血管损伤、血管生成调节异常介导的微血管闭塞产生的重要机制之一。ADSCs干预可通过抑制PEDF和END的表达,促进损伤血管的修复和新生血管的生成。
色素上皮衍生因子;内皮抑素;表达;脂肪干细胞;影响
结石、肾盂输尿管狭窄及肿瘤压迫等梗阻性因素导致的肾积水是肾纤维化的常见病因。单侧输尿管结扎是上述疾病特征性的动物模型。梗阻所致的管周微血管损伤及血管生成调节异常是纤维化进程的重要表现之一[1-2]。色素上皮衍生因子(pigment epitheliumderived factor,PEDF)和内皮抑素(Endostatin,END)是血管生成抑制因子,在血管生成调节异常中发挥一定作用。本研究结扎单侧输尿管复制肾纤维化动物模型,通过检测PEDF和END的表达,探讨PEDF和END在肾纤维化进程中的可能机制,以及脂肪干细胞(adipose-derived stem cells,ADSCs)对其表达的影响。
1 材料与方法
1.1 实验动物和分组
雄性SD大鼠70只(成都中医药大学实验动物中心提供),无特定病原体条件饲养,体重(250±20)g。随机分为对照组(10只)、单侧输尿管梗阻(unilateral ureter obstruction,UUO)组(30只)、干预组(30只),UUO组和干预组又分为UUO后第3、7和14天组,每组10只。
1.2 主要试剂和仪器
抗END、PEDF抗体(武汉博士德公司),免疫组织化学二抗为羊抗大鼠免疫球蛋白G(美国Invitrogen公司)。
1.3 UUO模型的复制及干预
1.3.1 UUO模型UUO组以10%水合氯醛腹腔注射麻醉后,常规消毒铺巾及剔毛,手术切开左侧腹皮肤至腹腔,游离左肾及输尿管,在左侧输尿管近肾盂处和输尿管上1/3处用1号丝线完全结扎离断输尿管,逐层连续缝合皮肤[3]。对照组手术方式同UUO组,进腹腔后仅将输尿管游离但不结扎离断。
1.3.2 ADSCs的制备与注射分离、培养ADSCs,收集第4代细胞,用PBS洗涤ADSCs 3次。每只大鼠于UUO模型复制成功后24 h经尾静脉注射ADSCs和PBS悬液(3×106个/100 g)[4]。
1.3.3 肾组织形态学检测取左肾腹侧组织,以乙醇-乙酸-甲醛固定液固定24 h,石蜡包埋切片,苏木精-伊红染色(hematoxylin-eosin staining,HE)及Masson氏染色观察肾纤维化程度。采用金瑞日等[5]的方法进行半定量分析,即在400倍镜下每张切片随机采集10个不重叠视野,将呈现为绿色的纤维区域(去除肾小球和大血管)视作阳性目标,以阳性面积与整个视野总面积的比值作为肾小管间质纤维化指数(tubulointerstitial fibrosis index,TFI),取其平均值作为每例切片的TFI。
1.3.4 免疫组织化学法采用免疫组织化学SP法检测PEDF、END的表达,用PBS代替一抗作阴性对照,用已知阳性片作阳性对照。在光镜下进行PEDF、END定位及分布检查。用专业图像分析软件Image-Pro Plus 6.0进行积分光密度分析。200倍光镜下随机选取除大血管外10个皮质及外髓视野并拍照,应用Image-Pro Plus 6.0图像分析软件分析棕黄色阳性染色所占面积的百分比,取其均值作为该例组织的阳性单位值。
1.4 统计学方法
数据分析釆用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,用方差分析,两两比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 肾脏大体改变
对照组肾脏大小正常,包膜光滑,切面肾盂肾盏无分离,皮髓质分界清楚。UUO组和干预组肾脏体积不同程度增大,包膜紧张,术后第3天可见肾盂肾盏分离,并随梗阻时间延长而扩张,分离增加,皮髓质逐渐分界不清。见图1。

图1 肾脏大体改变
2.2 肾脏组织学改变
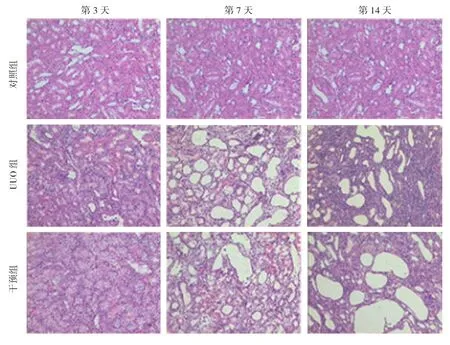
图2 各组大鼠第3、7和14天肾脏组织学形态 (HE染色×10)
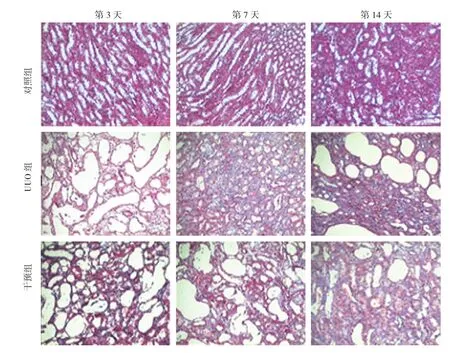
图3 各组大鼠第3、7和14天胶原改变 (Masson染色×10)
镜下见对照组肾小球、肾小管形态及数量基本正常,间质不扩张,偶见个别淋巴细胞浸润[TFI为(0.023±0.001)]。UUO组、干预组第3和7天肾小球无明显变化,第14天肾小球略萎缩减少;第3天可见肾小管变性,个别集合管扩张;第7和14天肾小管变性增加,可见坏死后再生,远端小管、近端小管及集合管均有不同程度扩张,部分伴有萎缩;第14天偶见蛋白管型;第3天间质略充血;第7和14天充血、水肿增加,淋巴细胞为主的炎症细胞浸润逐渐增强;第14天可见纤维母细胞聚集,伴胶原纤维沉积。干预组肾小球、肾小管及间质的改变与UUO组相似,但程度和范围较UUO组减轻。见图2、3。
2.3 各组大鼠TFI比较
UUO组、干预组及对照组大鼠第3、7和14天TFI水平比较,经方差分析,差异有统计学意义(P<0.05);第3天,干预组与UUO组比较,差异无统计学意义(P>0.05),而第7和14天干预组与UUO组比较,差异有统计学意义(P<0.05)。见表1。
表1 3组大鼠各时间点肾纤维化指数比较 (±s)

表1 3组大鼠各时间点肾纤维化指数比较 (±s)
组别 第3天 第7天 第14天对照组 0.02±0.003 0.02±0.003 0.02±0.003 UUO组 0.13±0.019 0.31±0.017 0.65±0.012干预组 0.12±0.005 0.23±0.005 0.53±0.013 F值 26.138 215.186 1 051.973 P值 0.009 0.002 0.000
2.4 PEDF蛋白表达变化
各组肾组织PEDF均有一定表达。细胞定位为细胞浆。对照组PEDF在肾小球血管球、肾小管及间质均呈弱阳性表达。第3、7、14天表达无区别。UUO模型组PEDF表达增强,除在肾小球血管网阳性表达外,在皮髓质交界及部分髓质肾小管上皮细胞、管周及肾间质均呈强阳性表达。各时间点比较,PEDF表达随梗阻时间延长而表达增加。干预组肾小管上皮细胞及肾间质也有明显表达,但各时间点PEDF表达强度及范围较UUO组窄,染色深度较UUO组淡。同一时间点组间比较,差异有统计学意义(P<0.05)。术后第3天,干预组与UUO组比较,差异无统计学意义(P>0.05),术后第7和14天,干预组与UUO组比较,差异有统计学意义(P<0.05)。见表2和图4。
表2 各组大鼠各时间点PEDF光密度值比较 (±s)
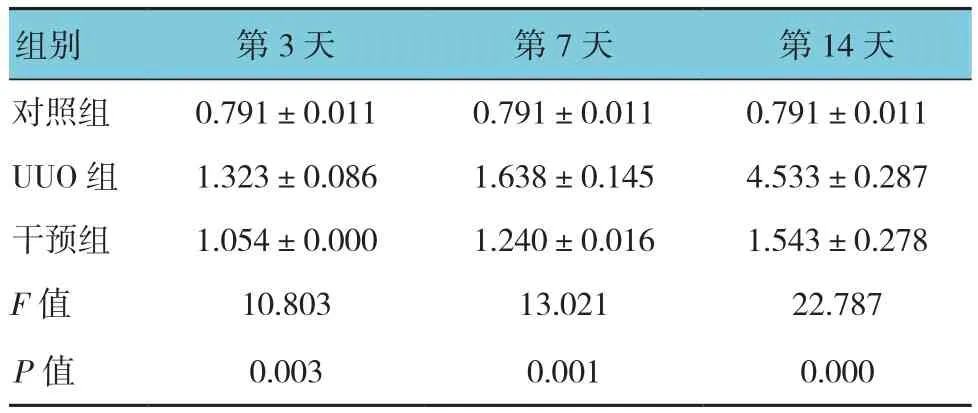
表2 各组大鼠各时间点PEDF光密度值比较 (±s)
组别 第3天 第7天 第14天对照组 0.791±0.011 0.791±0.011 0.791±0.011 UUO组 1.323±0.086 1.638±0.145 4.533±0.287干预组 1.054±0.000 1.240±0.016 1.543±0.278 F值 10.803 13.021 22.787 P值 0.003 0.001 0.000
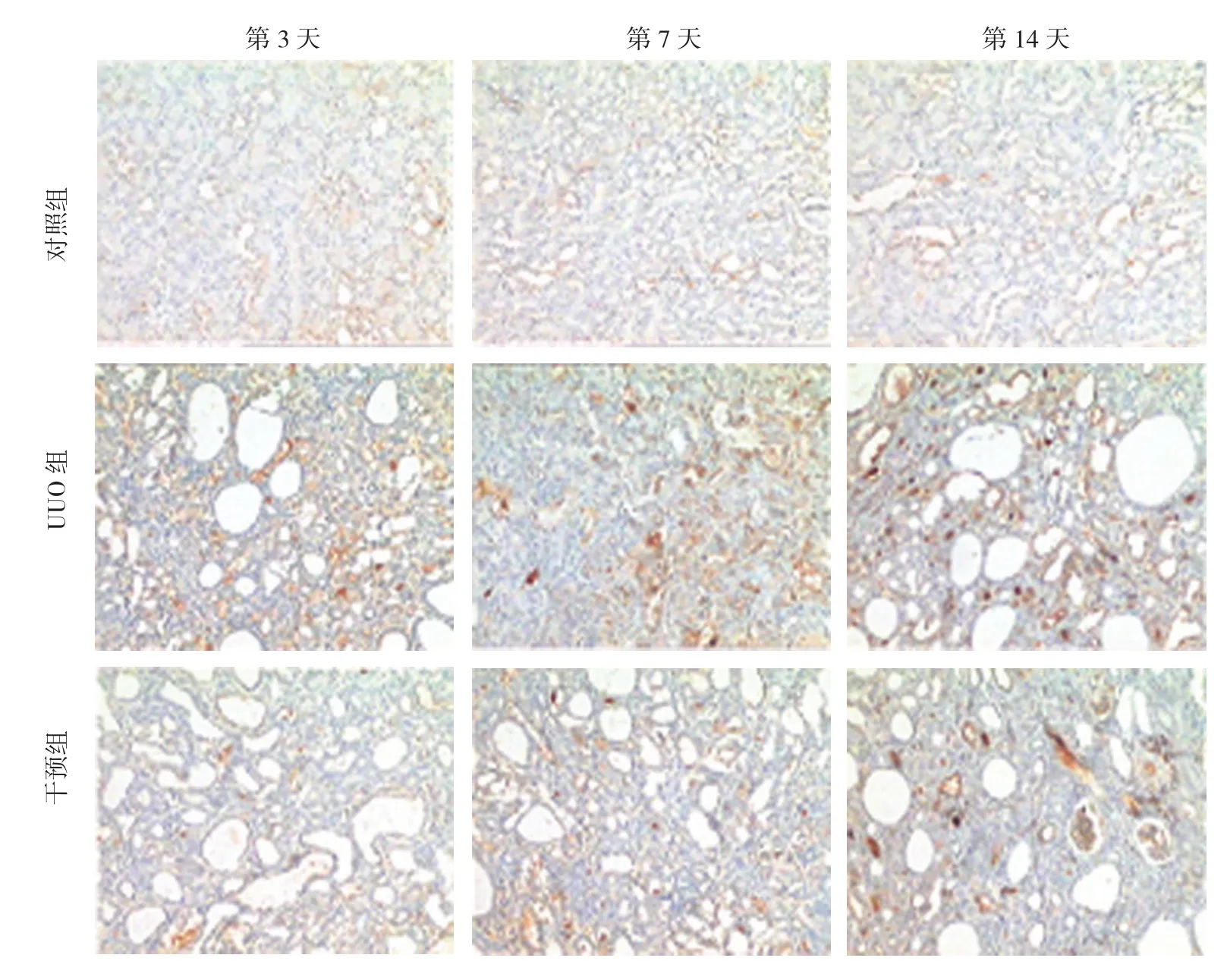
图4 各组大鼠第3、7和14天肾脏PEDF改变 (SP×10)
2.5 END蛋白表达变化
END表达于细胞浆。对照组个别肾小球弱表达END,肾小管及间质几乎无表达。UUO组肾小管上皮细胞及灶区间质表达END,术后第7天表达最强,几乎所有肾小管均呈阳性表达,在间质呈片状表达。术后第14天,肾小管及间质表达减弱,但较第3天强。术后第3、7和14天,UUO组与对照组比较,差异有统计学意义(P<0.05)。干预组相应时间点表达强度及范围均较UUO组减少;第3天仅个别肾小管上皮细胞弱阳性表达;第7天时也仅约1/2呈中等强度阳性表达,第3和14天,干预组与UUO组比较,差异无统计学意义(P<0.05);术后第7天,干预组与UUO比较,差异有统计学意义(P<0.05)。见表3和图5。
表3 各组大鼠各时间点END光密度值比较 (±s)

表3 各组大鼠各时间点END光密度值比较 (±s)
组别 第3天 第7天 第14天对照组 2.040±0.059 2.040±0.059 2.040±0.059 UUO组 3.347±0.317 16.400±1.586 5.508±0.292干预组 3.220±0.193 5.446±0.079 4.309±0.369 F值 11.014 35.490 38.822 P值 0.001 0.000 0.000

图5 各组大鼠第3、7和14天END改变 (SP×10)
3 讨论
血管生成是指从原先存在的毛细血管中形成新生血管的过程,包括选择性降解血管基底膜及其周围的细胞外基质,内皮细胞的分裂、转移和增殖,管腔结构及血管外膜的形成等过程。这些过程可能被特定的分子如成纤维细胞生长因子、血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素、转化生长因子、干扰素、肿瘤坏死因子及血小板源性生长因子等启动;此外,血管增生也能被某些血管生成抑制性分子调节,如血管抑素、END、血小板反应素、抗凝血酶-3及PEDF等。其互相及其他自然存在的刺激因子和抑制因子之间的平衡密切调控正常血管系统的静默状态。当促血管新生因子增加和/或抑制血管新生因子减少时,正常血管系统的静默状态失衡,导致血管增生[6]。血管生成与抑制所致的血管生成调节障碍在肾纤维化的形成中发挥重要作用。目前对于上述启动因子已有较多研究,而对于抑制性分子的研究还很少,探讨血管生成抑制因子,有利于该类药物的开发研究;目前国内外尚未见ADSCs对血管生成抑制性因子影响的研究,本研究是ADSCs治疗早期肾纤维化形成机制的一个有力补充。
PEDF是近年来发现的一种重要的天然的新生血管抑制因子,属于丝氨酸蛋白酶抑制剂超基因家族,包含2个相应的功能抗原决定簇,34肽和44肽。34肽是负责抗血管生成方面的作用,能抑制VEGF诱导的血管生成,并且诱发内皮细胞凋亡[7]。目前,人们对PEDF的研究大多集中于其与糖尿病增殖性视网膜病变的关系[8-10],而关于PEDF与肾纤维化关系的研究甚少。本研究发现,在正常大鼠的肾脏中有PEDF表达,主要分布于肾小管上皮细胞和肾小管间质,少量分布于肾小球。当发生输尿管梗阻时,PEDF表达增加,通过阻断细胞增殖、迁移,并诱导内皮细胞凋亡,抑制损伤血管的修复,从而加强肾纤维化的发生。而ADSCs可以抑制PEDF的表达,抑制梗阻所致的管周微血管损伤与闭塞,从而减轻肾纤维化。
END是第XⅧ胶原C-末端的一个片段,可特异性抑制内皮细胞增殖、迁移、侵袭和血管形成[11]。李爱军等[12]研究发现,在缺血损伤的肾脏肾小球及肾小管细胞内表达增加。吕临静等[13]研究发现,END蛋白在幼年单侧输尿管梗阻大鼠肾脏表达,术后1d即出现增强,随着实验时间的延长,病变的加重,上述表达趋势明显加强,7d时表达最强,然后随病变的发展表达反而较前下降。本研究也发现,END随梗阻时间而变化,先增强后减弱,但总体高于对照组。与MACIEL等[14]的研究结果一致。ADSCs在各个时间点均可降低END的表达,从而减轻肾间质微血管损伤,减轻肾间质纤维化。
干细胞是目前生命科学和再生医学研究领域的热点[15],ADSCs由于其免疫原性低、取材方便,可以塑形等优点,成为干细胞研究领域的热点。干细胞对早期肾纤维化形成的防治作用已有报道[16-18]。其作用方式多样,对血管生成的调节作用,目前尚未见报道,本研究发现,ADSCs可以降低UUO大鼠肾各个时间点PEDF和END的表达,减轻其抑制血管修复作用,促进血管生成,改善肾间质血供,从而影响纤维化的进程。
总之,几乎所有慢性肾脏疾病进展到终末阶段均表现为共同的病理变化—肾间质纤维化。近年来开始重视肾间质微血管病变在间质纤维化中的作用,END和PEDF作为抗血管增殖蛋白,在肾间质微血管损伤中具有重要作用。ADSCs可通过降低END和PEDF的表达,影响肾纤维化的进程。
[1]CINAd P, XU H, LIU L, et al. Renal tubular angiogenicdysregulation in anti-Thy1.1 glomerulonephritis[J]. Am J Physiol Renal Physiol, 2011, 300(2): F488-F498.
[2]VASKO R, XAVIER S, CHEN J, et al. Endothelial sirtuin 1deficiency perpetrates nephrosclerosis throughdownregulation of matrix metalloproteinase-14: relevance to fibrosis of vascular senescence[J]. J Am Soc Nephrol, 2014, 25(2): 276-291.
[3]吕春燕, 李娟. 干细胞治疗梗阻性肾病: 研究现状与存在问题[J]. 中国组织工程研究, 2014, 18(50): 8184-8188.
[4]吕春燕, 陈高莉, 杨玲, 等. 大鼠脂肪干细胞分离培养及细胞表型的研究[J]. 海南医学, 2014, 25(9): 1256-1259.
[5]金瑞日, 鲍晓荣. 活性维生素d3对大鼠肾小管间质纤维化的影响及其机制研究[J]. 中国临床医学, 2015, 22(6): 722-726.
[6]CARMELIET P. Angiogenesis in health anddisease[J]. Nat Med, 2003, 9(6): 653-660.
[7]LOEGL J, NUSSBAUMER E, HIDEN U, et al. Pigment epithelium-derived factor (PEDF): a novel trophoblast-derived factor limiting feto-placental angiogenesis in late pregnancy[J]. Angiogenesis, 2016, 19(3): 373-388.
[8]关清华, 旷劲松, 程岚, 等. 糖尿病视网膜病变患者氧化应激状态及炎症因子的临床研究[J]. 中国现代医生, 2015, 53(35): 29-31.
[9]刘晓. 臭氧治疗对糖尿病视网膜病变大鼠视网膜组织中细胞凋亡、血管新生的影响[J]. 海南医学院学报, 2016, 22(10): 937-940.
[10]XIE T Y, ZHANG C L, CHEN X Y. VEGF, HIF-1α and PEDF in the retina of streptozotocin-induceddiabetics rats treated with ozone[J]. Int Eye Sci, 2016, 16(2): 195-200.
[11]KANBAY M, AFSAR B, SIRIOPOLd, et al. Endostatin in chronic kidneydisease: associations with in flammation, vascular abnormalities, cardiovascular events and survival[J]. Eur J Intern Med, 2016, 33: 81-87.
[12]李爱军, 喻俊峰, 孙德明, 等. 缺血后处理对大鼠肾缺血再灌注损伤后及表达的影响[J]. 临床泌尿外科杂志, 2015, 30(5): 452-455.
[13]吕临静, 马宏, 郭晓媛, 等. 内抑素组织表达趋势与肾间质微血管损伤的相关性研究[J]. 中国药物与临床, 2011, 11(3): 271-274.
[14]MACIEL T T, COUTINHO E L, SOARESd, et al. Endostatin, an antiangiogenic protein, is expressed in the unilateral ureteral obstruction mice model[J]. J Nephrol, 2008, 21(5): 753-760.
[15]朱理辉, 罗勇, 张琍, 等. 人脐带血干细胞经外周静脉、肝动脉移植治疗失代偿期肝硬化的患者近期疗效观察[J]. 中国现代医学杂志, 2016, 26(2): 47-50.
[16]苏冬娜, 吴诗品. 修饰的骨髓间充质干细胞对肝硬化大鼠治疗及其机制研究[J]. 中国免疫学杂志, 2016, 32(5): 692-696.
[17]AL-HUSSEINY F, SOBH M A, ASHOUR R H, et al. Amniotic fluid-derived mesenchymal stem cells cut short the acuteness of cisplatin-induced nephrotoxicity in sprague-dawley rats[J]. Int J Stem Cells, 2016, 9(1): 70-78.
[18]ELHUSSEINI F M, SAAD M A, ANBER N, et al. Long term study of protective mechanisms of human adiposederived mesenchymal stem cells on cisplatin induced kidney injury in sprague-dawley rats[J]. J Stem Cells Regen Med, 2016, 12(1): 36-48.
Expressions of PEDF and endostatin in rat kidney after unilateral ureteral obstruction and effect of adipose-derived stem cells on them*
Chun-yan Lü1, Tian-lin Yang1, Jin-hui Li1, Cheng Wu1, Li Wang1, Chang-jin Chen2, Zi-yi Zhao2
(1.department of Pathology, 2. Central Laboratory, the Aff i liated Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu, Sichuan 610072, China)
ObjectiveTo observe thedynamic changes of pigment epithelium-derived factor (PEDF) and endostatin (END) expressions in renal tissues 3, 7 and 14days after unilateral ureteral obstruction (UUO) in rats and the expression changes after the intervention of adipose-derived stem cells, so as to explore the possible mechanism of PEDF and END in UUO and the relationship between them and the effect of adipose-derived stem cells on the expressions of PEDF and END in the course of UUO.MethodsSeventy healthy adult male SD rats were randomlydivided into sham operation control group (10 rats), UUO group (30 rats) and intervention group (30 rats). The UUO model was produced by unilateral ureteral obstruction and the rats in the intervention group were injected with adipose-derived stem cells in 24 hours. On the 3rd, 7th and 14thday after ureteral obstruction, the progression of renal injury and fibrosis and the expressions of PEDF and END in rats were observed.ResultsThe renal injury and fibrosis got more severe with the prolongation of the time of obstruction, the expressions of PEDF and END in the UUO group were higher than those of the control group at each time point. The expressions of END and PEDF weredecreased at all time points after intervention by adipose-derived stem cells.ConclusionsThe upregulation of PEDF and END after UUO may be one of the important mechanisms of microvascular occlusion mediated by regulation abnormality of microvascular injury and angiogenesis. Intervention of adipose-derived stem cells can promote the repair of vascular injury and angiogenesis by inhibiting the expressions of PEDF and END.
pigment epithelium-derived factor; endostatin; expression; adipose-derived stem cell; effect
10.3969/j.issn.1005-8982.2018.02.004
1005-8982(2018)02-0020-06
R692
A
2016-08-08
四川省卫生厅项目(No:110520);四川省成都市卫生局项目(No:2014004)
(童颖丹 编辑)

