胃癌并发出血的危险因素分析
李勇 赵群 范立侨 袁虎方 檀碧波 张志栋 赵雪峰 刘羽 王冬
·论 著·(腹部血管外科和上消化道出血专题)
胃癌并发出血的危险因素分析
李勇 赵群 范立侨 袁虎方 檀碧波 张志栋 赵雪峰 刘羽 王冬
目的分析胃癌合并出血病人的危险因素。方法回顾收集2000~2012年期间就诊于河北医科大学第四医院的胃癌病人。根据病人发病过程中是否并发出血,将病人分为出血组和非出血组。比较两组的临床基线资料、入院时辅助检查资料、手术相关资料和住院期间的主要情况。使用Logistic回归分析胃癌合并出血的危险因素。结果累计入选病人7 919例,其中合并出血病例316例,未并发出血的胃癌病人7 603例。出血组病人男性比例高于非出血组(69.3%比60.3%,P=0.001)。与非出血组相比,出血组病人高血压、糖尿病比例高(均P<0.001)。出血组病人吸烟比例较非出血组低(32.0% 比39.8%,P=0.005)。与非出血组相比,出血组病人并发梗阻的比例较高(P=0.002),两组病人合并消化道穿孔的比例相似。出血组病人入院时便潜血比例较高(P<0.001),血红蛋白、总蛋白和白蛋白水平低于对照组(均P<0.001),两组病人天冬氨酸转氨酶和丙氨酸转氨酶水平相似(均P>0.05)。两组病人在肿瘤浸润深度和肿瘤TNM分期方面存在明显差异(均P<0.05),两组病人M分期情况和术后并发症无明显差异。Logistic回归分析发现,男性、高血压、糖尿病、合并消化道穿孔、肿瘤浸润深度、肿瘤TNM分期、术前白蛋白和总蛋白水平以及入院时便潜血阳性是胃癌合并出血的危险因素(均P<0.05)。结论胃癌合并出血的危险因素包括:男性、高血压、糖尿病、合并消化道穿孔、肿瘤TNM分期、术前白蛋白和总蛋白水平以及入院时便潜血阳性。
胃癌; 出血; 危险因素; Logistic回归分析
胃癌是中国最常见的恶性肿瘤,也是世界范围内癌症的第二大死亡原因[1-2]。上消化道出血是指屈氏韧带以上的消化道出血,是临床常见急重症,也是胃癌最常见的并发症之一。胃癌合并出血主要是癌肿表面损伤、糜烂、感染、炎症、溃疡及创面渗血所致[3]。当胃癌病人有较大癌灶坏死,迅速侵犯较大血管或较多新生血管时则可引起大出血,这是胃癌合并大出血的主要原因[4]。上消化道出血一般起病急、变化快,严重者可危及生命,影响胃癌病人的治疗效果和临床预后。早期识别易并发出血的胃癌高危病人,有助于早期给予药物和内镜等治疗[4],减少胃癌围术期并发症,提高胃癌的手术治疗效果和病人的临床预后[5]。但是目前尚缺乏针对胃癌合并出血的高危因素分析研究。本研究的目的是通过回顾性研究的方式,分析胃癌合并出血病人的高危因素,为临床工作提供参考。
资料与方法
一、研究对象
回顾收集2000~2012年期间就诊于河北医科大学第四医院的胃癌病人。入选标准:①经病理确诊为胃癌;②住院期间行手术治疗。除外标准:①病理检查确诊为其他类型的胃部肿瘤;②临床资料不完整,病史记述不详。
二、研究方法
根据病人发病过程中是否并发出血,将病人分为出血组和非出血组。记录和比较以下资料:
1.两组的临床基线资料 包括:年龄、性别、高血压、糖尿病、冠心病、腹部手术史、其他肿瘤病史和烟酒嗜好和胃癌并发症(梗阻、穿孔)。
2.入院时辅助检查资料 包括:便潜血、血红蛋白(Hb)、总蛋白、白蛋白、天冬氨酸转氨酶(AST)和丙氨酸转氨酶水平(ALT)。
3.手术相关资料 包括两组病人胃癌分期、浸润深度和其他脏器受侵情况。
4.住院期间的主要情况 包括:术后并发症以及两组病人的住院时间。上消化道出血定义为屈氏韧带以上的消化道出血,表现为呕血和(或)黑便。胃癌的分期:本研究使用日本研究协会推荐的分类方法进行胃癌的分期[6],早期胃癌局限于黏膜或黏膜下,进展期胃癌侵透肌层或更深层。淋巴结转移的分期使用国际抗癌联盟(Union for International Cancer Control,UICC)推荐的TNM分期方法[7-8],pN0:无淋巴结转移;pN1:1~2个阳性淋巴结;pN2:3~6个阳性淋巴结;pN3a:7~15个阳性淋巴结;pN3b:15个以上阳性淋巴结。
三、统计学分析
结 果
2000~2012年,我中心行胃部肿瘤手术11 929例,除外其他病理类型的胃部肿瘤2 160例,除外临床资料不完整的病例1 850例,累计入选病人7 919例,其中合并出血病例316例,未合并出血的胃癌病人7 603例。
一、两组病人临床资料比较
两组病人年龄、冠心病史、腹部手术史和饮酒史方面差异无统计学意义(均P>0.05)。出血组病人男性比例高于非出血组(69.3%比60.3%,P=0.001)。与非出血组相比,出血组病人高血压、糖尿病病史比例高(均P<0.001)。出血组病人吸烟比例较低(32.0%比39.8%,P=0.005)。与非出血组相比,出血组病人并发梗阻的比例较高(P=0.002);两组病人合并消化道穿孔的比例相似。出血组病人入院时便潜血比例较高(P<0.001);血红蛋白、总蛋白和白蛋白水平低于对照组(均P<0.001);两组病人AST和ALT水平相似(均P>0.05)。(表1)
二、两组病人手术资料比较
两组病人在肿瘤浸润深度和肿瘤分期方面存在明显差异(均P<0.05),两组病人脏器受侵情况和术后并发症无明显差异。(表2)
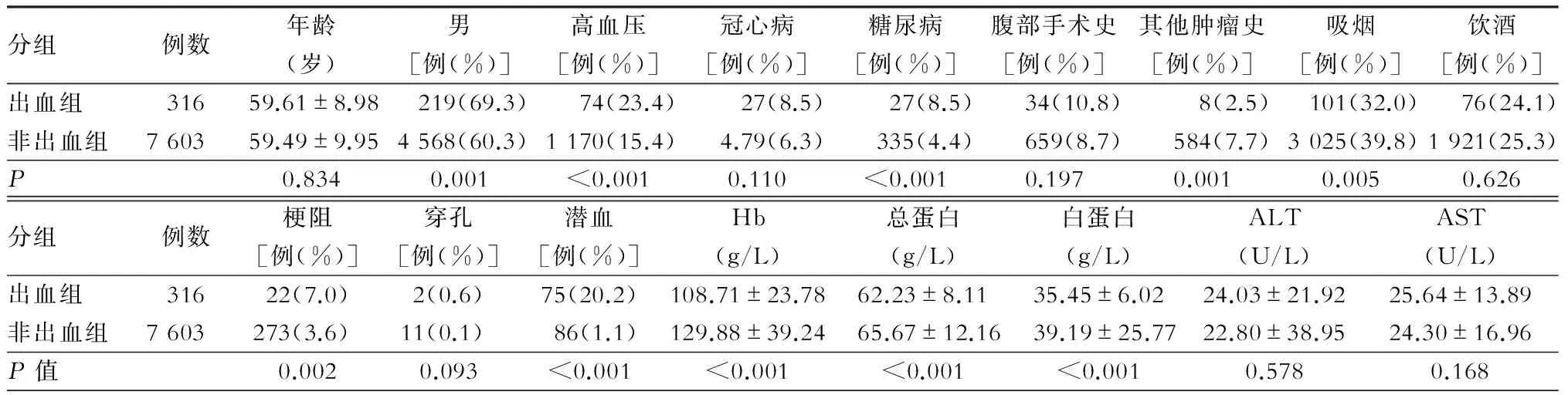
表1 两组病人临床基线资料比较
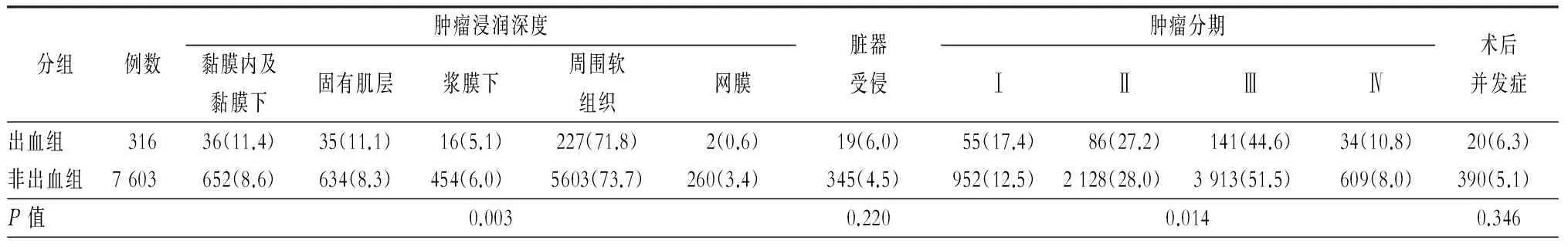
表2 两组病人手术资料比较[例(%)]
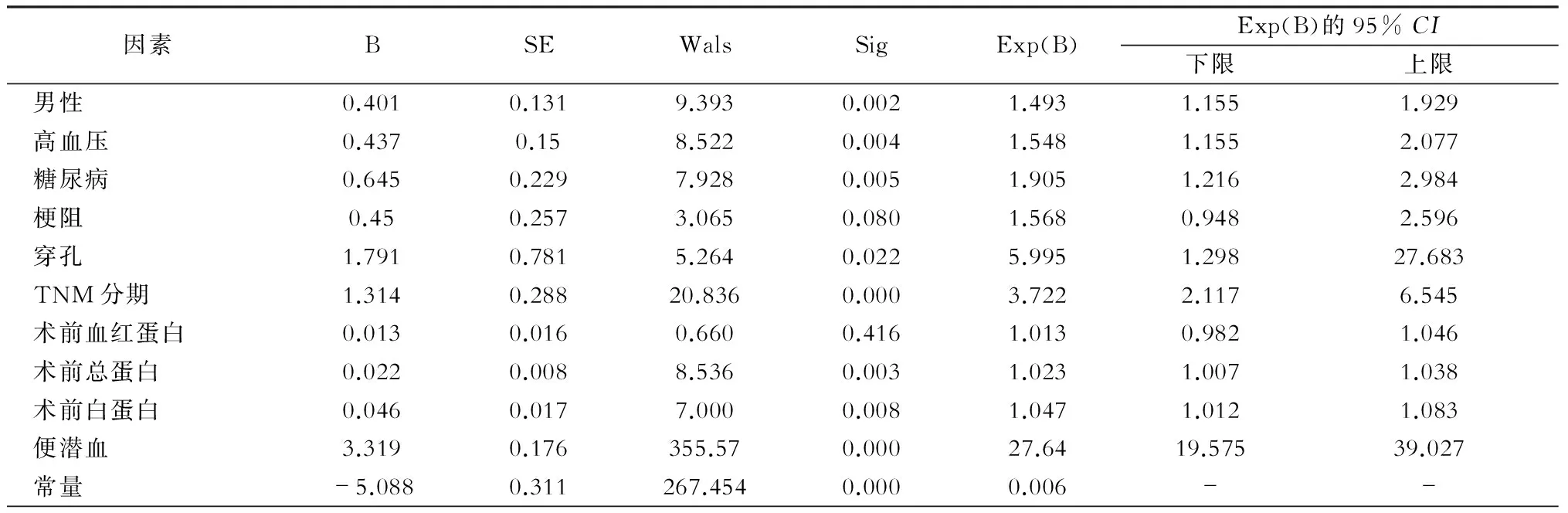
表3 胃癌合并出血的危险因素分析
三、胃癌合并出血的危险因素分析
纳入性别、高血压、糖尿病、肿瘤史、吸烟、梗阻、穿孔、肿瘤分期、术前血红蛋白、术前总蛋白、术前白蛋白、便潜血等因素进行Logistic回归分析,结果发现,男性、高血压、糖尿病、吸烟史、合并消化道穿孔、肿瘤分期、术前白蛋白和总蛋白水平以及入院时便潜血阳性是胃癌合并出血的危险因素(均P<0.05)。(表3)
讨 论
胃癌合并出血是胃癌的常见症状之一[9-11],典型的上消化道出表现为呕吐咖啡样物、柏油样大便,少数病人表现为大呕血。本研究中,胃癌并发出血的发生率约为3.99%(316/7 919)。回顾收集2000~2012年期间就诊于河北医科大学第四医院的胃癌病人7 919例,分析胃癌并发出血病人的临床特点,结果发现,胃癌合并出血的危险因素因素包括:男性、高血压、糖尿病、吸烟史、既往肿瘤病史、合并消化道穿孔、肿瘤浸润深度、肿瘤分期、术前白蛋白和总蛋白水平以及入院时便潜血阳性。
胃癌病人并发出血原因是多方面的[12-15],主要包括:①肿瘤生长迅速,血供相对不足,肿瘤中央形成溃疡和糜烂;②肿瘤侵蚀胃壁较大的血管或形成溃疡累及胃左动脉的分支造成大量出血;③少数早期病变侵犯黏膜下血管丛致出血;④由于多数胃癌病人为中老年人,存在不同程度的动脉硬化,血管收缩能力下降,易于发生出血[16-17]。本研究也发现,具有高血压、糖尿病等动脉粥样硬化高危因素的胃癌病人,出血的发生率较高。但是由于本研究为回顾性研究,未能对病人吸烟史时程和吸烟支数进行分析,因此,出血组病人吸烟史比例并未高于非出血组。由于未能追溯入选病人既往肿瘤手术的病因和术式,因此,未能对其与胃癌并发出血的相关性进一步进行分析。此外,进展期胃癌是胃癌并发出血的独立危险因素。本研究发现,合并穿孔是胃癌并发出血的危险因素之一,这一结果提示,胃癌的浸润、侵蚀是导致出血的重要原因之一。上述结果与既往研究一致[18-21]。
胃癌病人术前多数不能正常进食,具有营养差、贫血、低蛋白的临床特点[22]。本研究结果发现,胃癌合并出血病人血红蛋白、总蛋白和白蛋白水平均较低,术前总蛋白和白蛋白水平是胃癌并发出血的危险因素。这一结果提示,并发出血可能是导致胃癌病人贫血的原因,而营养状态较差、蛋白水平低是导致胃癌病人并发出血的主要原因。此外,仍有部分病人入院时便潜血检查阳性,提示,胃癌病人并发出血的主要临床特点是以慢性、小量出血为主,这一临床特点导致胃癌病人可能长期处于慢性贫血和营养不良状态。上述因素相互作用,加重胃癌病人的病情,使病人预后不佳。
我中心是国家临床重点专科科室,年接诊胃癌病人上千例。本研究回顾了2000~2012年间就诊于我科的胃癌病人的临床资料,笔者未见目前国内单中心研究中,入选样本量、齐同性比本研究高的研究。本研究对分析胃癌并发出血病人的临床特点提供了宝贵资料,有利于早期识别以消化道出血为首发表现的胃癌病人,避免漏诊和误诊,并对疾病预防提供了重要参考。但是由于研究历时时间较长,期间病人在预防出血的治疗措施(例如,预防性应用质子泵抑制剂、内镜下治疗等)存在差异,导致出血的发生率和危险因素等方面可能存在差异,需要我们不断完善临床资料,对胃癌临床特点与时俱进地加以观察和分析。
1 Brenner H,Rothenbacher D,Arndt V.Epidemiology of stomach cancer.Methods Mol Biol,2009,472:467-477.DOI: 10.1007/978-1-60327-492-0_23.
2 Merabishvili VM. Analytical epidemiology of stomach cancer. Vopr Onkol,2013,59:565-570.
3 章兴灿,何兰兰,张小玉,等.胃癌急性出血的临床特点及奥曲肽止血效果观察.中华临床医师杂志(电子版),2013,7: 4113-4114. DOI:10.3877/cma.j.issn.1674-0785.2013.09.080.
4 郑才锋.急诊胃镜治疗胃癌急性出血的临床效果及安全性分析.实用癌症杂志,2017,32:638-640.DOI: 10.3969/j.issn.1001-5930.2017.04.034.
5 汤兴华,刘雄,章宜兰,等.急诊内镜在消化道肿瘤病人上消化道出血中的诊疗价值.中国肿瘤临床与康复,2015,22: 422-424. DOI:10.13455/j.cnki.cjcor.2015.04.13.
6 Torre LA, Bray F, Siegel RL, et al.Global cancer statistics, 2012.CA Cancer J Clin,2015,65:87-108.DOI:10.3322/caac.21262.
7 Washington K.7th edition of the AJCC cancer staging manual:stomach.Ann Surg Oncol,2010,17:3077-3079. DOI:10.1245/s10434-010-1362-z.
8 Hari DM,Leung AM,Lee JH,et al.AJCC Cancer Staging Manual 7th edition criteria for colon cancer:do the complex modifications improve prognostic assessment.J Am Coll Surg,2013,217:181-190.DOI:10.1016/j.jamcollsurg.2013.04.018.
9 刘早红,许可葵,董月华,等.2009-2012年湖南省肿瘤登记地区胃癌的发病与死亡分析. 实用预防医学, 2017, 24: 1120-1124. DOI:10.3969/j.issn.1006-3110.2017.09.027.
10黄兴宇, 韩仁强, 滕支梅,等. 2003-2012年江苏省胃癌发病死亡及农村地区生存情况分析. 中华疾病控制杂志, 2017, 21: 482-486. DOI:10.16462/j.cnki.zhjbkz.2017.05.013.
11李桂刚, 翟玉庭, 张发学, 等. 山东省招远市2008~2012年胃癌发病与死亡分析. 中国肿瘤, 2017, 32: 515-518. DOI:10.11735/j.issn.1004-0242.2017.07.A003.
12邵珂, 田莹莹, 张银铃. 胃癌并上消化道出血的内镜治疗效果分析. 中华肿瘤防治杂志, 2016, 23: 185-186. DOI:10.16073/j.cnki.cjcpt.2016.s2.089.
13孙阳, 李兆堂. 胃癌根治术后上消化道出血的原因分析与治疗措施. 世界最新医学信息文摘, 2016, 19: 51. DOI:10.16073/j.cnki.cjcpt.2016.s2.089.
14冯小嫦. 食管癌、胃癌并上消化道出血的内镜治疗效果分析. 中国卫生产业, 2014, 32: 16-17. DOI:10.16659/j.cnki.1672-5654.2014.32.025.
15徐泽宽, 徐皓. 胃癌根治术后消化道出血原因及处理. 中国实用外科杂志, 2013, 33: 306-308.
16高乐智, 张鹏. 胃癌合并大出血的手术治疗. 中国社区医师(医学专业), 2012, 27: 106-107. DOI:10.3969/j.issn.1007-614x.2012.27.101.
17陈军. 胃癌合并急性大出血的诊治经验. 中国实用外科杂志, 2005, 25: 394-396. DOI:10.3321/j.issn:1005-2208.2005.07.006.
18李炜. 胃癌合并急性出血36例诊治分析. 中国热带医学, 2011, 11: 884-885. DOI:10.13604/j.cnki.46-1064/r.2011.07.057.
19李忠贤. 消化道急性出血的治疗分析. 大家健康(学术版), 2013, 28: 188-189.
20项丹妮, 曹秀英, 戚元琳. 老年人胃癌伴上消化道出血112例临床特点及围手术期处理. 实用癌症杂志, 2000, 15: 58-59.
21陈权. 急诊手术治疗胃癌76例的疗效分析与体会. 当代医学, 2012, 19: 123-124. DOI:10.3969/j.issn.1009-4393.2012.7.084.
22Marmo R, Del PM, Rotondano G, et al. Mortality from nonulcer bleeding is similar to that of ulcer bleeding in high-risk patients with nonvariceal hemorrhage: a prospective database study in Italy. Gastrointest Endosc, 2012, 75: 263-272.e1. DOI: 10.1016/j.gie.2011.07.066.
Riskfactorsofgastrointestinalbleedingingastriccancer
LiYong,ZhaoQun,FanLiqiao,YuanHufang,TanBibo,ZhangZhidong,ZhaoXuefeng,LiuYu,WangDong.
DepartmentofSurgery,theFourthHospital,HebeiMedicalUniversity,ShiJiazhuang050011,China
,LiYong,Email:li_yong_hbth@126.com
ObjectiveTo analyze the risk factors of gastrointestinal bleeding in gastric cancer.MethodsThe patients with gastric cancer admitted to the Fourth Hospital of HebeiMedical University were retrospectively enrolled in this study. All the cases were divided into bleeding group and non-bleeding group according to the incidence of gastrointestinal bleeding. The baseline clinical characteristics, laboratory tests, characteristics of surgery and adverse events during hospitalization were recorded and compared between the two groups. Logistic analysis was used to investigate the risk factors of gastrointestinal bleeding in gastric cancer.ResultsA total of 7919 cases were enrolled, including 316 cases in the bleeding group and 7600 cases in the non-bleeding group. More male patients were in the bleeding group (69.3% vs. 60.3%,P=0.001). There were more patients with hypertention, diabetes in patients in the bleeding group (allP<0.001). There were less smokers in the bleeding group than in the non-bleeding group (32.0% vs. 39.8%,P=0.005). The incidence of obstruction wassignificantly higher in the bleeding group than that in the non-bleeding group (P=0.002), but that of perforation was similar between the two groups. The incidence of positive fecal occult blood was higher (P<0.001), and the levels of hemoglobin, albumin and total protein were lower in the bleeding group (allP<0.001). No significant difference was found in the levels of ALT and AST between two groups (bothP>0.05). There were no significant differences in infiltration depth and TNM staging of tumor between two groups (bothP<0.05). The results of logistic analysis revealed that male, hypertention, diabetes, perforation, infiltration depth, TNM staging, levels of albumin and total protein as well as positive fecal occult blood were risk factors for gastrointestinal bleeding in gastric cancer (allP<0.05).ConclusionsThe risk factors of gastrointestinal bleeding in gastric cancer included male, hypertention, diabetes, perforation, infiltration depth, TNM staging, levels of albumin and total protein as well as positive fecal occult blood.
Gastric cancer; Gastrointestinal bleeding; Risk factors; Logistic analysis
R656.6
A
10.3969/j.issn.1003-5591.2017.06.009
050011 石家庄,河北医科大学第四医院外三科
李勇,Email: li_yong_hbth@126.com
2017-10-09)

