野生种质拓宽中国大豆遗传基础的SSR标记分析
吕祝章,张 娜,邱丽娟
(1.日照职业技术学院,山东日照 276826;2.中国农业科学院作物科学研究所,国家农作物基因资源与遗传改良重大科学工程,农业部作物种质资源利用重点开放实验室,北京 100081)
野生种质拓宽中国大豆遗传基础的SSR标记分析
吕祝章1*,张 娜1,邱丽娟2
(1.日照职业技术学院,山东日照 276826;2.中国农业科学院作物科学研究所,国家农作物基因资源与遗传改良重大科学工程,农业部作物种质资源利用重点开放实验室,北京 100081)
【目的】鉴定和发掘野生大豆种质可利用的优异等位变异,为进一步有效地利用野生大豆资源开展大豆分子辅助育种工作提供参考信息。【方法】采用SSR标记技术对具有野生大豆血缘的大豆推广品种及其亲本进行遗传变异性分析。【结果】10个大豆育成品种分别遗传利用了野生大豆和栽培大豆亲本的19个和10个特有等位变异,并产生了其亲本不具有的18个新的等位变异;野生大豆的小粒、高硬脂酸含量、多荚以及抗胞囊线虫等优良性状基因较易被其育成的大豆品种选择利用。【结论】野生和栽培大豆的种间杂交并不单纯是遗传物质的简单组合,它可以通过基因的重组创造出新的优良基因型种质。因而利用野生大豆特有的等位变异创造新的基因型,扩大栽培大豆的遗传多样性,进而拓宽大豆的遗传基础是有效和可行的途径。
野生大豆;育成品种;遗传基础;等位变异;SSR
种质资源是基因的载体,是进行遗传改良和育种的基础,正确评定种质资源的变异特点,确定其间的遗传变异关系,从中发掘有利基因,有利于正确制订育种策略,进而可实现定向培育目标良种和加快育种进程。我国育成世界上第1个大豆杂交种“杂交豆1号”则是完全得益于对野生大豆资源中不育基因的发现与利用。
我国是大豆的发源地,有占世界90%以上的丰富的野生大豆资源。野生大豆遗传多样性丰富,有些性状是其所特有的基因资源[1-8]。我国大豆育种工作者已先后利用野生大豆资源创新培育出获国家发明奖的铁丰18号、吉林小粒1号,获省级科技进步奖的杂交豆1号、龙品8807、龙小粒豆1号,以及通过国家和省审定推广应用等品种共18个;另创新培育出180余份各具优良特性的入选国家种质库的稳定新种质资源[9-11]。在世界范围内解析由野生大豆衍生而来的、具有丰富表型变异的大豆推广品种与其亲本间的遗传结构、特异性及其遗传关系,对于发掘特异基因,拓宽大豆遗传基础,改良现实生产应用品种具有重要的理论价值和实际意义,而此类研究还鲜见报道。
本研究选用10个利用野生大豆资源育成的大豆推广品种及其17个亲本,对分布于全基因组的具有多态性的88个SSR座位进行分析,旨在分子水平上明确大豆育成品种与亲本间的遗传变异特点,探索利用野生大豆资源拓宽我国大豆遗传基础的趋势,揭示育成品种优异的基因来源,鉴定和发掘野生大豆种质可利用的重要基因及标记,为进一步有效地利用野生大豆资源开展大豆育种工作提供参考信息。
1 材料和方法
1.1 试验材料
选用了10个具有野生血缘的在生产上大面积推广应用的大豆品种及其17个亲本。各品种的系谱情况如下:
龙小粒豆1号=黑农26×ZYD652**;
龙品8807=黑农35×ZYD355**,91-806=黑农35×ZYD665**;
吉林小粒1号=平顶四×GD50477**;
吉林小粒4号=吉林18号×(通农9号×GD50444-1**);
吉林小粒6号=公野9140-5*×公野8648*;
吉林小粒7号=公野9140*×黑龙江小粒豆;
吉林66号=吉林30×(吉林27×GD50279**);
中野1号=(察隅1号×ZYD3576**)×大湾大粒;
中野2号=(察隅1号×ZYD3576**)×大湾大粒。
*和**分别代表半野生和野生大豆,上述材料中的黑龙江小粒豆、察隅1号未被搜集到。
1.2 实验方法
1.2.1 SSR分析
每份材料是从入库的500g纯净种子中随机取出100粒种子磨粉混匀,采用SDS法[12]提取DNA。PCR反应体系为20μL,其中含有40ng基因组DNA模板、1×PCR 缓冲液、1.25mmol/L MgCl2、0.2mmol/L dNTP、0.2μmol/L SSR引物和1U Tag DNA聚合酶。选用分布于全基因组的88对SSR标记进行分析,SSR引物序列来自大豆数据库(http://soybase.agron.iastate.edu/ssr.html),由奥科生物技术公司合成。反应在PE-9600型号的PCR扩增仪上进行。反应程序为95℃预变性4min;95℃变性30s,47℃退火30s,72℃延伸30s,运行35个循环;72℃延伸10min,4℃保存。扩增产物用6%聚丙烯酰胺、8 mol/L尿素制成的测序胶分离,银染技术检测。
1.2.2 数据统计分析
每个SSR位点,根据标记条带的有无记录并统计等位变异出现数目进行分析。
2 结果与分析
2.1 育成品种产生新的等位变异分析
10个大豆育成品种共检测到264个等位变异,其中在LGB1 Satt453,LGB2 Satt556,LGC2 Satt286,LGD1a Satt179(3 个),LGD1b Satt005,LGD2 Satt226,LGG Sat_164,LGH Satt302 (3 个),LGK Satt559(2个)、Satt588,LGL Satt229,LGM Satt175,LGN Satt387等13个位点上产生了18个新的等位变异(表1),新的等位变异占其等位变异总数的6.82%。育成品种产生新的特有等位变异情况见表2。
2.2 育成品种遗传利用野生大豆亲本特有等位变异分析
9个野生和半野生大豆亲本共检测到了339个等位变异,与8个栽培大豆亲本相比共拥有110个特有等位变异,分布于15个连锁群的61个位点上(表1),占其等位变异总数的32.45%。其中在LGA1 Satt591,LGB2 Satt304,LGC1 Satt294、Satt180,LGC2 Satt291、Sat_252,LGD1a Satt184,LGD2 Satt014,LGG Satt012,LGH Satt192,LGI Sat_219、Satt239,LGL Satt 232、Satt446、Sat_099,LGN Satt387 等 16 个位点上的19个特有等位变异被6个育成的大豆品种所利用,特有等位变异利用率达17.27%。特有等位变异
被利用的情况为:龙品8807遗传利用了ZYD355在Satt294(3 个)、Sat_099(2 个)、Satt291、Sat_252、Sat_219、Satt232、Satt446等7个位点上共10个特有等位变异;吉林小粒1号遗传利用了野生大豆GD50477 在Satt180、Sat_252、Satt014、Satt184、Satt 239、Satt387等6个位点上的6个特有等位变异;吉林小粒6号遗传利用了半野生大豆公野8648在Satt012、Satt192位点上的各1个特有等位变异;吉林小粒4号、中野1号、吉林66号分别遗传利用了野生大豆GD50444-1在Satt591、野生大豆ZYD3576在Satt304、野生大豆GD50279在Satt012位点上的各1个特有等位变异(见表3)。分析发现有4个育成品种未遗传利用到其野生亲本在本研究中检测到的特有等位变异,可能是由于其野生亲本特有等位变异数少,亦或是由于育种目标定向选择造成。
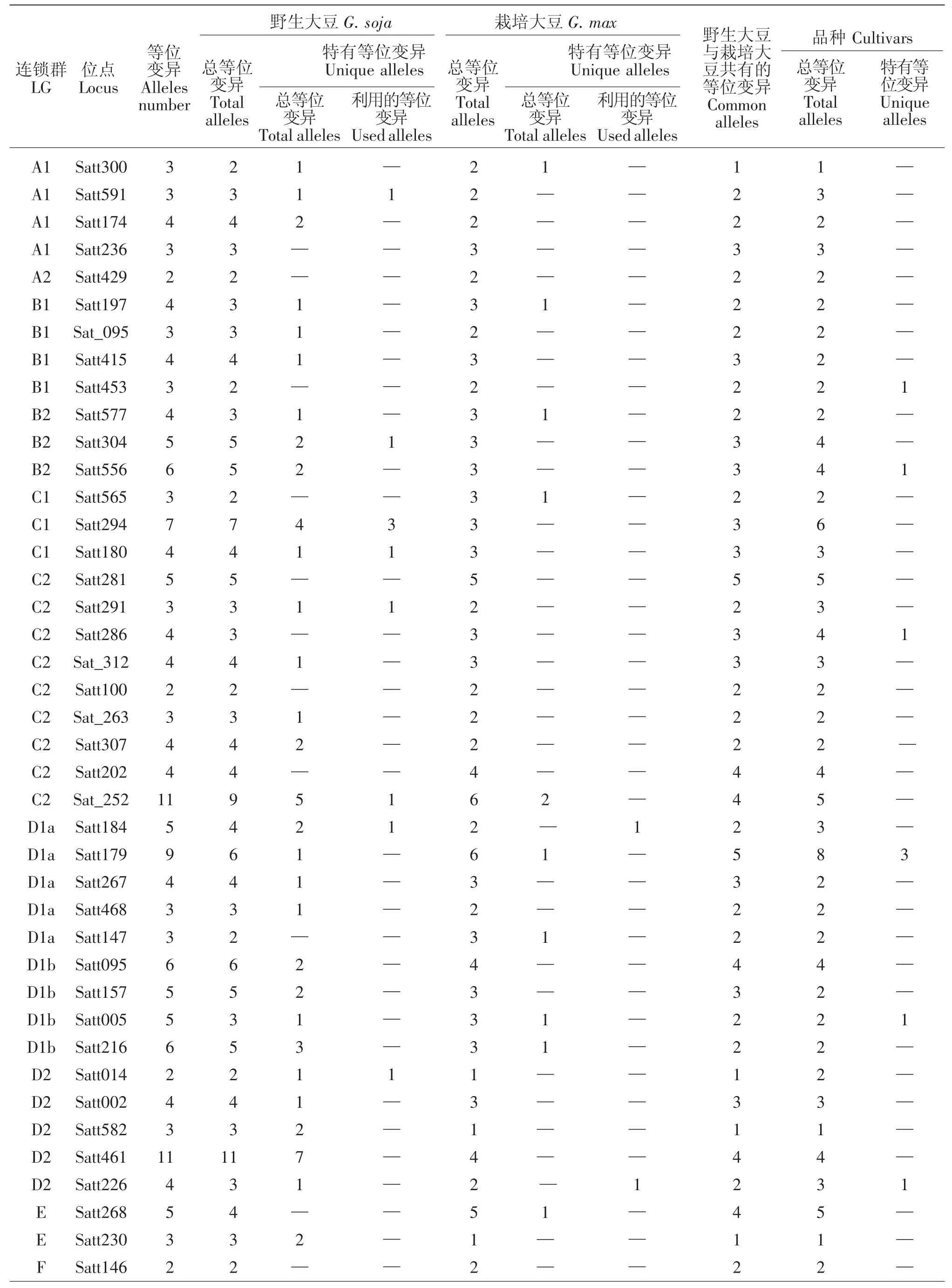
表1 88个SSR位点在连锁群上的等位变异分布Table 1 88 SSR locus distributed on the different Linkage Groups for cultivated and wild soybeans
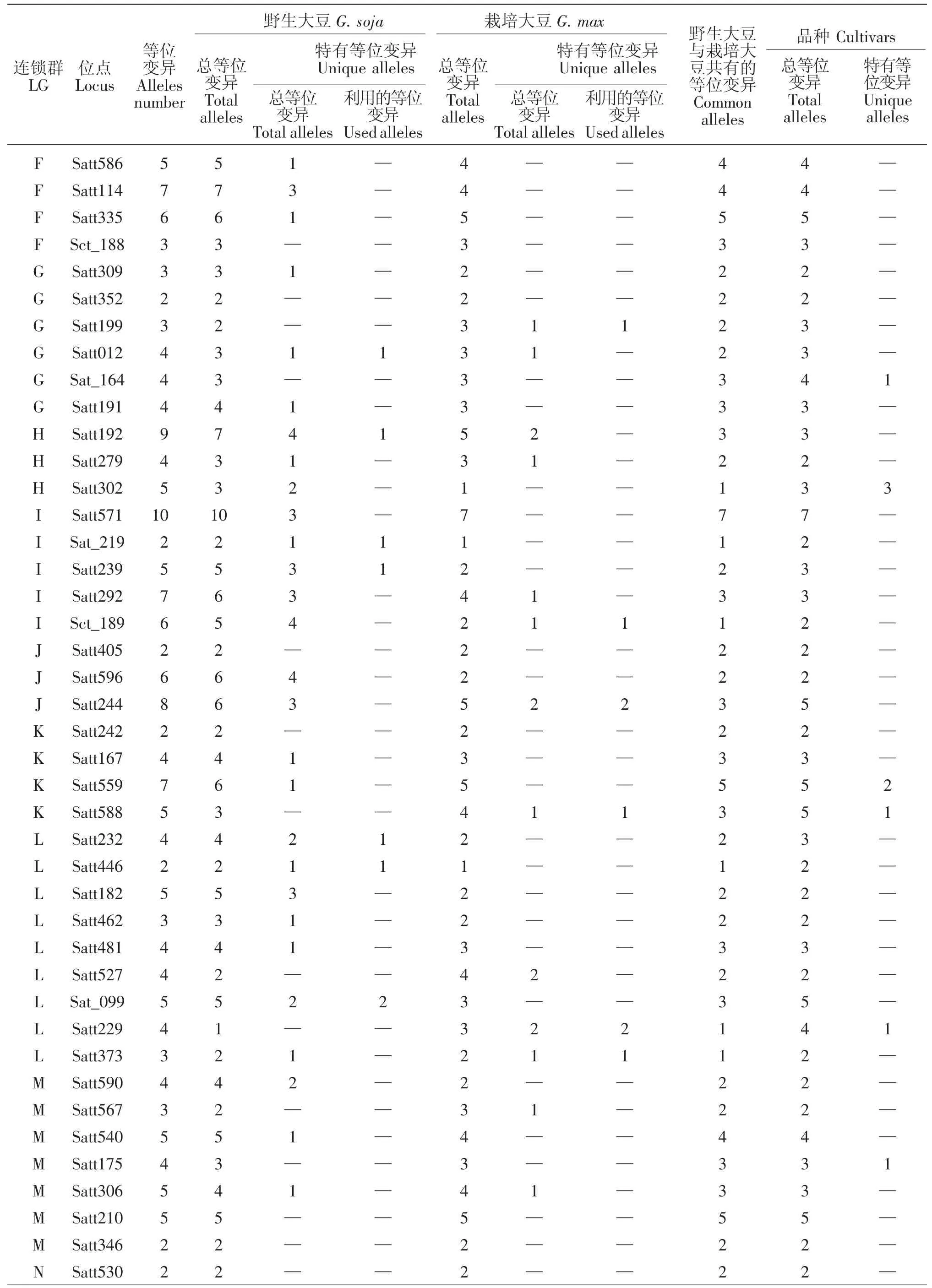
续表1
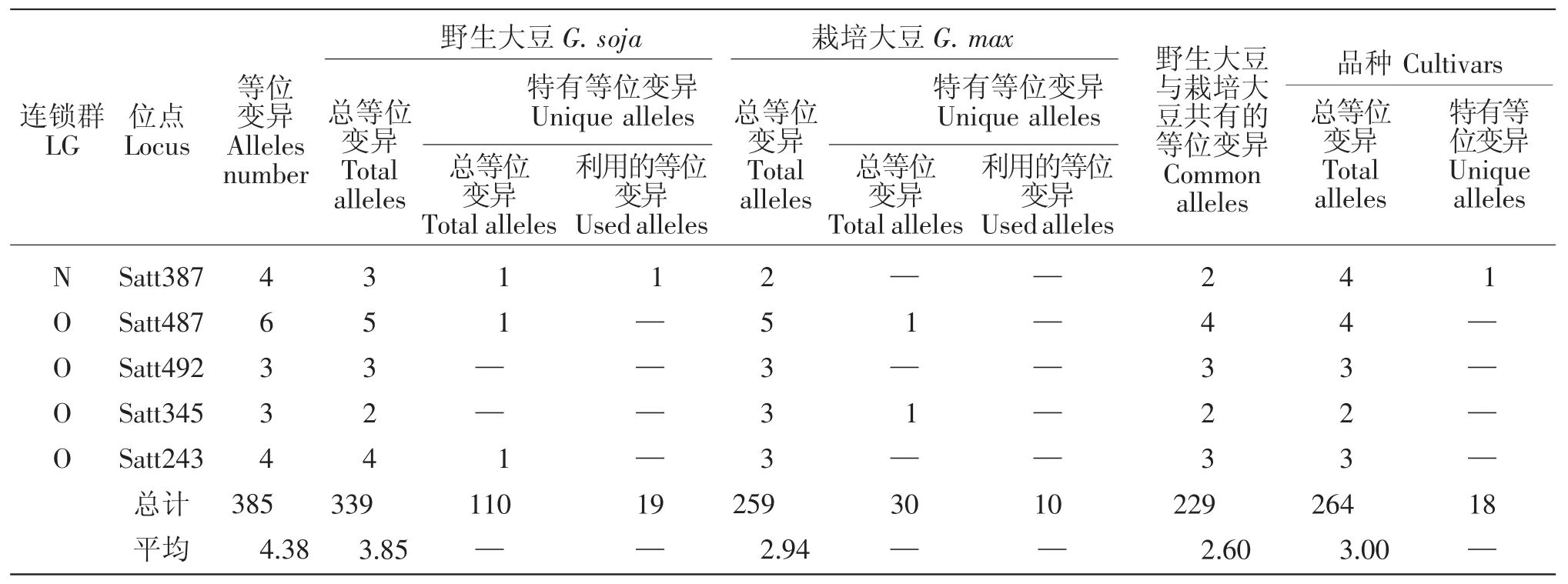
续表1
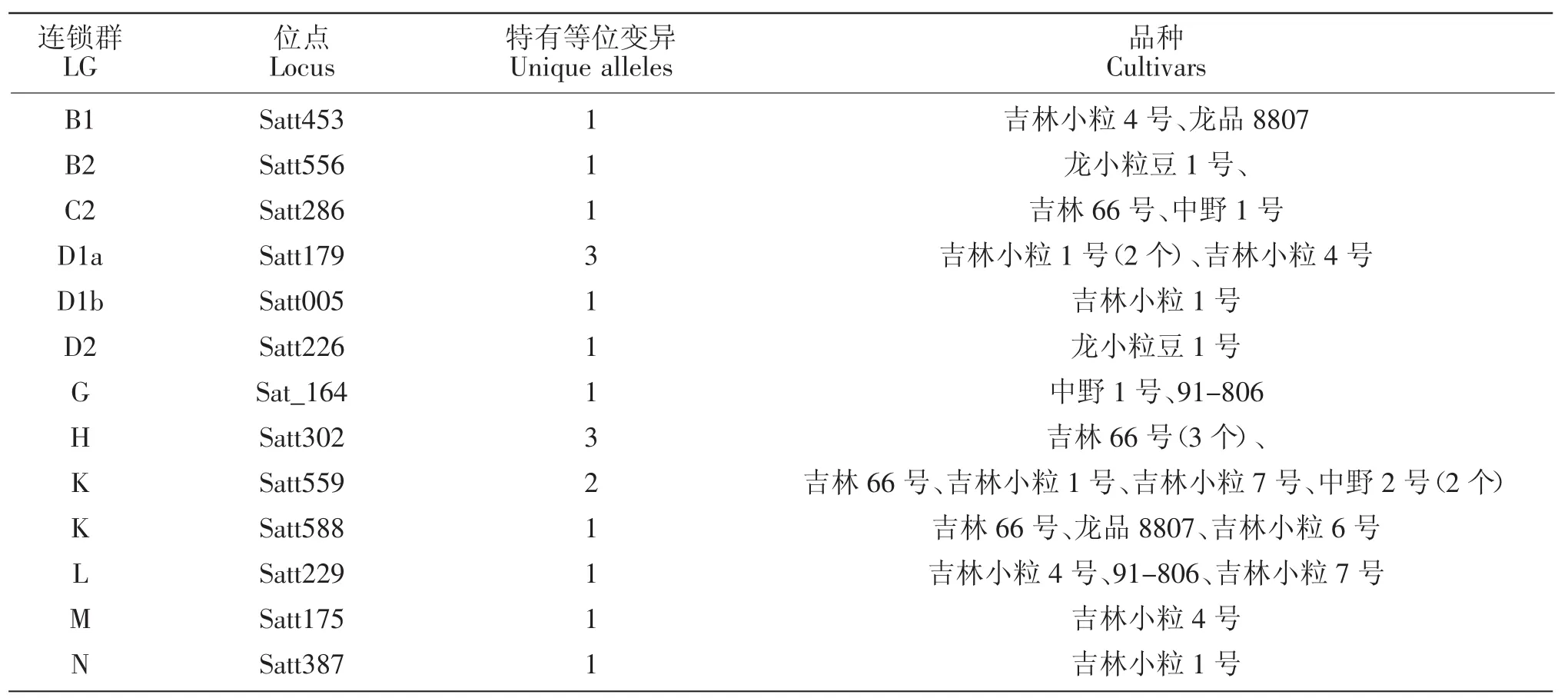
表2 育成品种产生特有等位变异情况Table 2 The variation of specific alleles in breeding cultivars
2.3 育成品种遗传利用栽培大豆亲本特异等位变异分析
8个栽培大豆亲本共检测到259个等位变异,与野生大豆亲本相比仅拥有30个特有等位变异,分布于16个连锁群上的25个位点(表1),占其等位变异总数的11.58%,显著低于野生大豆亲本的32.45%;其中分布于LGD1a Satt179、LGE Satt268、LGG Satt199、LGI Sct_189、LGJ Satt244(2 个)、LGK Satt588,LGL Satt229(2个)、Satt373等8个位点上的10个特有等位变异被其育成品种所利用,特有等位变异利用率为33.33%,反而高于野生大豆亲本的17.27%。这表明野生大豆与栽培大豆之间不仅在形态上有较大的区别,而且在遗传基础上也存在着明显的差异,栽培大豆的特有等位变异在遗传育种上更容易被遗传并加以选择和利用,这可能是由于其性状更适合育种选择的目标所致。特有等位变异被育成品种利用的分析结果见表4。

表3 育成品种利用野生大豆特有等位变异情况Table 3 The variation of specific alleles in wild soybean varieties
3 讨论与结论
不同的野生大豆材料共有且分布在A1连锁群与脂肪含量有关的Satt591[13],B2连锁群与粒重有关的Satt304[14],C1连锁群与产量和粒重有关的Satt294[15],C1连锁群与脂肪和硬脂酸含量有关的Satt180[16],C2连锁群与产量和粒重有关的Satt291[15]和与产量、株高有关的Sat_252[16],D1a连锁群与百粒重有关的Satt184[17],D2 连锁群与百粒重有关的 Satt014[18],G连锁群与铁营养和抗胞囊线虫有关的Satt012[19-22],I连锁群与荚粒数有关的Sat_219[23]和与叶片大小、株高、开花期、荚粒数及脂肪含量有关的 Satt239[18,23-25],L连锁群与倒伏性有关的Satt232[26]以及与粒重有关的 Sat_099[14,27],N连锁群与产量和株高有关的Satt387[28-29]等位点上的特异等位变异被育成品种利用。从此可以看出野生大豆的小粒、高硬脂酸含量、多荚以及抗胞囊线虫等优良性状易被育成品种选择利用。
在10个育成品种中共产生了18个新的等位变异,即部分座位在育成品种中产生了不同于双亲的带型,发生了变异。DNA变异中,新杂交带的产生及亲本带的丢失,表明DNA产生了复制和丢失,杂交带大小的变化可能与碱基甲基化,DNA重排及转座等机制有关[30-31]。引起基因组中某些DNA片段发生同源重组、插入、缺失等,从而造成该片段分子量的增加或减少,因而可以表明野生和栽培大豆的种间杂交并不单纯是遗传物质的简单组合,更重要的是它可以通过基因的重组创造出新的优良基因型种质。
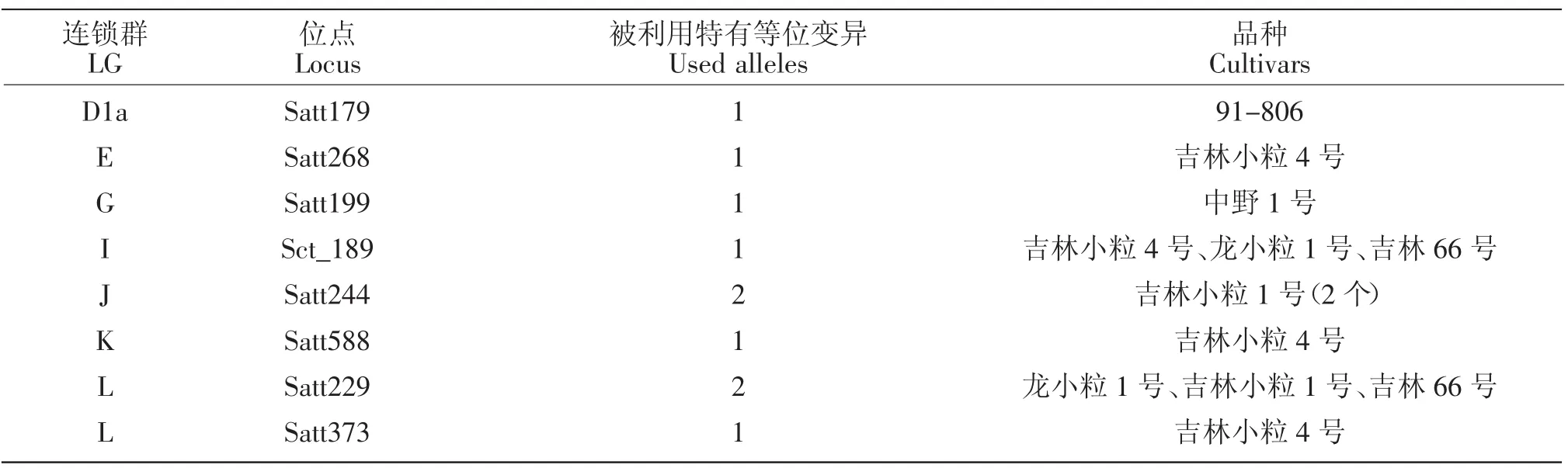
表4 育成品种利用栽培大豆特有等位变异情况Table 4 The variation of specific alleles of cultivated soybean cultivars
野生大豆是未经过人工选择的材料,遗传背景复杂,遗传多样性较为丰富。作为栽培大豆近缘祖先种—野生大豆的潜在价值应该受到更进一步的重视、开发与利用,充分挖掘和发挥野生大豆的资源优势,必将会为大豆育种工作带来新的活力和突破性进展。
[1] 盖钧镒,许东河,高忠,等.中国栽培大豆和野生大豆不同生态类型群体间遗传演化关系的研究[J].作物学报,2000,26(5):513-520.
[2] 李向华,田子罡,李福山.新考察收集野生大豆与已保存野生大豆的遗传多样性比较[J].植物遗传资源学,2003,4(4):345-349.
[3] 田清震,盖钧镒,喻德跃,等.我国野生大豆与栽培大豆AFLP指纹图谱研究[J].中国农业科学,2001,34(5):480-485.
[4] 赵洪锟,王玉民,李启云,等.中国不同纬度野生大豆和栽培大豆SSR分析[J].大豆科学,2001,20(3):172-176.
[5] 周晓馥,庄炳昌,王玉民,等.利用RAPD与SSR技术进行野生大豆种群内分化的研究[J].中国生态农业学报,2002,10(4):6-9.
[6] 何真,韵晓东,武凯,等.大豆种质资源遗传多样性研究进展[J].生物技术进展,2015,5(2):103-108.
[7] 李为民,李思锋,黎斌,等.DNA分子标记在野生大豆遗传多样性研究中的应用进展[J].中国农学通报,2014,30(21):246-250.
[8] 张乐,李英慧,刘章雄,等.栽培大豆(G.max)和野生大豆(G.soja)~Glymal3g21630基因多样性[J].作物学报,2011,37(10):1724-1734.
[9] 杨光宇,王洋,马晓萍,等.小粒大豆新品种吉林小粒6号选育报告[J].中国农业信息,2008(4):19.
[10] 杨光宇,王洋,马晓萍,等.出口专用大豆新品种吉林小粒7号选育报告[J].吉林农业科学,2005,30(5):24-25.
[11] 杨明亮,张东梅,常玉森,等.特用大豆优质种质资源利用与创新[J].黑龙江农业科学,2016(8):15-18.
[12] 关荣霞,常汝镇,邱丽娟.用于SSR分析的大豆DNA的快速提取[J].大豆科学,2003,21(1):73-74.
[13] HYTEN D L,PANTALONE V R,SAMS C E,et al.Seed quality QTL in a prominent soybean population[J].Theoretical Applied Genetics,2004,109(3):552-561.
[14] ORF J H,CHASE K,JARVIK T,et al.Genetics of soybean agronomic traits I Comparison of three related recombinant inbred populations[J].Crop science,1999,39(6):1642-1651.
[15] YUAN J,NJITI V N,MEKSEM K,et al.Quantitative trait loci in two soybean recombinant inbred line populations segregating for yield and disease resistance[J].Crop Science,2002,42(1):271-277.
[16] 郑永战,盖钧镒,卢为国,等.大豆脂肪及脂肪酸组分含量的QTL定位[J].作物学报,2006,32(12):1823-1830.
[17] PANTALONE V,PANTHEE DR,SAMS C E,et al.Quantitative trait loci for seed protein and oil concentration and seed size in soybean[J].Crop Science,2005,45(5):2015-2022.
[18] CHAPMANA,PANTALONE V R,USTUN A,et al.Quantitative trait loci for agronomic and seed quality traits in an F2 and F4:6 soybean population[J].Euphytica,2003,129(3):387-393.
[19] CONCIBIDO V C,DIERS B W,ARELLI P R.A decade of QTL mappingforcystnematoderesistance in soybean[J].Crop Science,2004,44(4):1121-1131.
[20] 高利芳,郭勇,郝再彬,等.大豆株高QTL的“整合”及Overview分析[J].遗传,2013,35(2):215-224.
[21] 陈庆山,张忠臣,刘春燕,等.大豆主要农艺性状的QTL分析[J].中国农业科学,2007,40(1):41-47.
[22] 张闻博,蒋洪蔚,李灿东,等.基于元分析的大豆胞囊线虫抗性QTL的整合[J].中国油料作物学报,2010,32(1):104-109.
[23] 张军,赵团结,盖钧镒.大豆育成品种农艺性状QTL与SSR标记的关联分析[J].作物学报,2008,34(12):2059-2069.
[24] 文自翔,赵团结,郑永战,等.中国栽培和野生大豆农艺品质性状与SSR标记的关联分析I.群体结构及关联标记[J].作物学报,2008,34(7):1169-1178.
[25] 文自翔,赵团结,郑永战,等.中国栽培和野生大豆农艺及品质性状与SSR标记的关联分析II.优异等位变异的发掘[J].作物学报,2008,34(8):1339-1349.
[26] SPECHT J E,CHASE K,MACRANDE M,et al.Soybean response to water:A QTL analysis of drought tolerance[J].Crop Science,2001,41(2):493-509.
[27] ADLER F R,CHASE K,LARK K,et al.Genetics of soybean agronomic traits:II.Interactions between yield quantitative trait loci in soybean[J].Crop Science,1999,39(6):1652-1657.
[28] BAIANU I C,DIERS B W,FEHR W R,et al.Putative alleles for increased yield from soybean plant introduction[J].Crop Science,2004,44(3):784-791.
[29] 杨胜先,牛远,李梦,等.栽培大豆农艺性状的关联分析及优异等位变异挖掘[J].中国农业科学,2014,47(20):3941-3952.
[30] WALBOT V.On the life strategies of plants and animals[J].Trends in Genetics,1985,1(6):165-169.
[31] WALBOT V,CHANDLER V,Taylor L.Alterations in the Mutator transposable element family of Zea mays[C].UCLA Symposia on Molecular and Cellular Biology,1985(35):333-342.
SSR Marker Analysis on Genetic Basis of Wild Germplasm in China
LYU Zhu-zhang1*,ZHANG Na1,QIU Li-juan2
(1.Rizhao Polytechnic College,Rizhao 276826,Shandong,China;2.Institute of Crop Science,Chinese Academy of Agricultural Sciences/The National Key Facility for Crop Gene Resources and Genetic Improvement/Key Laboratory of Crop Germplasm and Utilization,Ministry of Agriculture,Beijing 100081,China)
【Objective】To identify and explore the excellent allelic variation of wild soybean germplasm,and provide reference information for excavating the excellent genetic resources of wild soybean efficiently by molecular assisted breeding.【Method】The SSR markers were used to analyze the genetic variability of soybean cultivars and their parents with wild soybean genetic background.【Results】10 soybean cultivars were genetic use of wild soybean and cultivated soybean were 19 and 10 unique alleles,and had their parents with 18 new alleles;soybean varieties of small,wild soybean high stearic acid content,pod and cyst nematode resistance and other excellent genes easily bred by the breeding varieties.【Conclusion】Interspecific hybridization between wild and cultivated soybeans is not just a simple combination of genetic material,it can create a new excellent genotype by genetic recombination.Therefore,those marker genotypes in wild soybean could be directly used to creating a new genotype through the marker-assistant selection,to expand the genetic diversity and broaden the genetic basis of soybean.
wild soybean;breeding variety;genetic basis;allelic variation;SSR
S565.1
A
1000-2650(2017)01-0010-07
10.16036/j.issn.1000-2650.2017.01.002
2016-12-05
国家自然科学基金(30490250)。
吕祝章,博士,教授,主要从事油料作物遗传育种和分子生物学研究,E-mail:ytzhuzhang@163.com。
(本文审稿:武 晶;责任编辑:刘诗航;英文编辑:刘诗航)

