新型Aβ42寡聚体模拟表位疫苗的制备
刘向蒙 于雅东 王少伟 于晓琳 王瑞明
(1. 齐鲁工业大学生物工程学院,济南 250353;2. 昆明市环境监测中心,昆明 650100;3. 中国科学院过程工程研究所,北京 100190)
新型Aβ42寡聚体模拟表位疫苗的制备
刘向蒙1于雅东2王少伟3于晓琳3王瑞明1
(1. 齐鲁工业大学生物工程学院,济南 250353;2. 昆明市环境监测中心,昆明 650100;3. 中国科学院过程工程研究所,北京 100190)
旨在获得一株特异靶向致病性Aβ42寡聚体的模拟表位疫苗。在前期工作中,应用亲和层析的方法从人静脉用免疫球蛋白(Intravenous immune globulin,IVIG)中纯化获得特异性识别Aβ42寡聚体的抗体组分IVIG-AOB。以IVIG-AOB为靶蛋白,应用噬菌体展示技术淘选出一系列Aβ42寡聚体的特异性环状模拟表位多肽,随后将表位多肽融合表达至乙肝病毒核心蛋白(HBc-VLP)构建成表位载体疫苗,进而将免疫小鼠,从中筛选出能有效免疫产生抗Aβ42寡聚体抗体的模拟表位疫苗。从噬菌体环形七肽库中筛选出5条特异性结合IVIG-AOB的模拟表位多肽,将其克隆至HBc载体,并在大肠杆菌中成功表达和组装成嵌合表位的HBc-VLP,通过免疫小鼠优选出一株效果最好的Aβ42寡聚体构象表位疫苗HBc-C4。Aβ寡聚体是AD发生发展的主要致病因素。基于Aβ42寡聚体独特的构象表位研制的表位HBc-VLP疫苗诱导机体产生的抗体将能够特异靶向并中和毒性Aβ42寡聚体,而不影响Aβ42的正常生理功能,从而起到从根本上治疗AD的作用。
阿尔茨海默病;Aβ42寡聚体;模拟表位;疫苗;抗体
阿尔茨海默病(Alzheimer’s disease,AD),是一种持续性恶化的神经退行性疾病。近年来,AD的发病率及患病人数持续增长,已成为继心脏病、癌症、中风后的第四大致病性疾病。AD的病理变化主要表现为由Aβ在神经元细胞外形成的老年斑和由异常磷酸化tau蛋白在神经元细胞内形成的神经纤维缠结[1]。Aβ是由其前体蛋白APP经β-和γ-分泌酶酶切产生的多肽片段[2],过量的Aβ累积后会发生聚集,形成寡聚体、原纤维和纤维等。其中,APP和Aβ单体在神经元和突触发育中起着重要作用[3],而Aβ寡聚体具有神经毒性,是AD发病的起始诱因。
抗Aβ免疫治疗是清除Aβ的有效途径,在AD治疗中具有广阔的应用前景。然而,自身免疫的风险、显著的副作用以及不确定的治疗效果限制了Aβ免疫治疗的发展[4]。第一代疫苗AN1792利用全长的Aβ42多肽作为免疫原直接进行免疫治疗,在动物实验中表现出了良好的治疗效果,但是在临床II期试验中由于引发严重的脑膜炎等副作用而被迫中止。随后的研究表明,全长Aβ含有的T细胞表位引发的T细胞活化及浸润是其副作用发生的主要原因[5]。为了避免T细胞自身免疫反应,第二代Aβ疫苗ACC-001、CAD106等利用Aβ42的B细胞表位区作为抗原表位,同时搭载病毒载体蛋白提高了免疫效率,但是I期或者II期的临床试验发现其治疗效果仍不显著[6-7]。同时,使用抗Aβ单克隆抗体的被动免疫治疗在AD临床试验中效果也不理想,例如 bapineuzumab[8],solanezumab[9]。这些单抗或者疫苗免疫产生的抗体可同时结合Aβ单体、寡聚体和纤维以及APP蛋白。这或许降低了有限的抗体靶向寡聚体的能力,再者,靶向具有正常生理功能的Aβ和APP可导致副作用发生。
2016年的一项I期临床试验表明,一种特异性靶向Aβ寡聚体的单克隆抗体aducanumab,能显著降低AD患者脑内的Aβ水平,改善患者临床认知能力[10]。除此之外,一项III期临床实验表明,人静脉用免疫球蛋白(IVIG)可改善携带APOE-ε4基因的轻度到中度AD患者的认知损伤[11]。我们认为IVIG中抗Aβ寡聚体的抗体组分是起到这一治疗作用的关键[12]。这些研究表明,特异性针对Aβ寡聚体的免疫治疗对AD具有更好的治疗作用。
本研究选择 Aβ42寡聚体作为阿尔茨海默病的免疫治疗靶标,利用本实验室从IVIG中纯化获得的抗Aβ42寡聚体特异性抗体组分(IVIG-AOB)筛选获得Aβ42寡聚体模拟表位,并克隆至HBc中制备VLP疫苗,然后免疫BalB/c小鼠,用ELISA方法检测小鼠血清中抗体水平,进一步验证这种新型疫苗Aβ42寡聚体模拟表位疫苗的免疫原性,期望获得一株较高免疫原性的疫苗。
1 材料与方法
1.1 材料
1.1.1 实验试剂 随机多肽噬菌体库(NEB公司,美国);BL21感受态细胞(TakaRa公司,日本);IVIG-AOB(实验室制备);层析柱、亲和层析填料、疏水介质丁基及羟基磷灰石介质(GE公司,美国);注射用铝佐剂、化学发光试剂盒(ECL)(Thermo公司,美国);Amyloid beta 42(Aβ42)(American Peptide,美国);二甲基亚砜(DMSO)、六氟异丙醇(HFIP)、十二烷基磺酸钠(SDS)、硫磺素T(ThT)、过硫酸铵(AP)、N,N,N,N,-四甲基乙二胺(TEMED)、甲叉双丙烯酰胺、丙烯酰胺、Tris、甘氨酸(glycin)、Tween-20(Sigma公司,美国);200目碳支持膜、醋酸双氧铀(北京中镜科仪);硝酸纤维素膜(NC膜)(Milipore公司,美国);HBc单克隆抗体(Invitrogen公司,美国);抗His单克隆抗体、HRP-羊抗鼠(北京中杉生物工程有限公司);96孔酶标板(广州JET公司);可溶型单组分TMB显色底物(北京天根生化科技有限公司);酸性显影粉、通用定影粉(天津世纪奥博公司);其他试剂为国产分析纯。
1.1.2 实验动物 雌性Balb/c小鼠,4-6周龄,由北京华阜康生物科技股份有限公司提供。
1.2 方法
1.2.1 Aβ42寡聚体模拟表位多肽的筛选 本试验采用固相结合法,将IVIG-AOB包被于聚乙烯平皿中,加入环形7肽噬菌体库,洗脱掉未结合或者结合不牢的噬菌体后收集特异性结合的噬菌体。在淘选过程中,使用逐步降低靶分子浓度(100 μg/mL,10 μg/mL,1 μg/mL)、提高去污剂 Tween-20 的浓度(0.1%、0.3%和0.5%)和增加洗涤次数(12次、15次和20次)的方法,以提高筛选效率。按这种方法进行了4轮的筛选,最终获得了特异性富集的噬菌体。
1.2.2 噬菌体阳性克隆的筛选 使用96孔ELISA板,每孔加入 1 μg/100 μL Aβ寡聚体(PBS稀释),同时需包被空白孔(PBS)以排除挑选的噬菌体与ELISA板结合,4℃包被过夜。包被结束后,用0.3%PBST洗脱3遍,除去残液并拍干后,每孔加满封阻液,37℃封闭2 h。封闭结束后,0.3% PBST洗脱两遍,除去残液并拍干。然后加入合适稀释度的扩增噬菌体贮液,室温震荡1 h,弃掉贮液并拍干,0.3%PBST洗脱10遍,然后用0.3% PBST以1:1 000的比例稀释HRP标记的抗-M13抗体,每孔加入100 μL稀释后的抗体,室温震荡作用1 h。用0.3% PBST洗板10次。每孔加100 μL TMB底物溶液,室温作用10 min,1 mol/L H2SO4每孔100 μL终止反应。用读板仪记录450 nm处的吸光值。
1.2.3 ELISA检测模拟表位多肽与IVIG-AOB结合活性 根据噬菌体ELISA检测结果及测序结果,合成了具有重复序列的6条环形7肽,在多肽合成时加入含有6个组氨酸的His标签(CxxxxxxxCHHHHHH),以检测其与IVIG-AOB的结合情况。环形多肽ELISA检测时,包被样品为IVIG-AOB,每孔1 μg/100 μL,一抗为带His标签的多肽,二抗小鼠抗His标签的单抗,其余按1.2.2的方法。
1.2.4 HBc与模拟表位多肽重组蛋白的表达纯化 首先将表位多肽插入HBc149的免疫显性区域(Major immunodominant region,MIR),重组的 HBc表位嵌合基因克隆至pBR327质粒中。然后将质粒转化至BL21感受态细胞中,挑取单克隆后在含有氨苄抗生素的LB培养基中培养过夜,按照1∶50接种至M9培养基,37℃诱导培养24 h。培养结束后,于8 500 r/min离心5 min,收集菌体,加入2 mL重 悬 buffer(50 mmol/L Tris,5 mmol/L EDTA,150 mmol/L NaCl),加入蛋白酶抑制剂PMSF,混匀,超声破碎菌体,12 000 r/min离心10 min,分别取上清和沉淀;利用SDS-PAGE鉴定蛋白表达。最后将菌体裂解上清进行硫酸铵沉淀(80%)粗纯后,利用疏水层析和羟基磷灰石进行两步纯化,收集洗脱液。1.2.5 表位疫苗免疫 取4-6周龄的雌性BalB/c小鼠18只,分6组,每组3只,皮下免疫3次,每次间隔两周。接种剂量为每只小鼠100 μg HBc重组蛋白VLP抗原混合 Imject® Alum佐剂。抗原与佐剂的比例为 3∶1(V/V)。
1.2.6 ELISA检测小鼠血清中抗体水平 在第3次免疫后第10天,利用眼眶取血收集血清。在96孔板中分别包被用PBS稀释的表位多肽和Aβ42寡聚体(均为 0.5 μg/100 μL),血清利用封闭液按照 1∶100稀释,二抗为 HRP标记的山羊抗小鼠IgG,其他步骤同1.2.2。
1.2.7 统计学分析 所有实验数据均为平均值±标准误差。采用T-TEST分析各组样品间的显著性差异。P<0.05被认为具有统计学差异。*表示P<0.05,**表示 P<0.01,***表示 P<0.001。
2 结果
2.1 噬菌体多肽库的筛选
经过4 轮的筛选,噬菌体的产出量由4.5×106CFU/mL提高到1.0×109CFU/mL,投入产出比从2.3×10-5提高到5×10-3,提高了200多倍。淘选条件及噬菌体富集变化,见表1。

表1 噬菌体多肽库的富集变化
2.2 噬菌体阳性克隆的淘选
ELISA检测4轮淘选后获得的单克隆噬菌体,经OD450的比值分析,IVIG-AOB/对照(阿达木单抗)大于1.7被认为阳性克隆。一般以样品组比上对照组大于2被认为阳性,为了获得更多的克隆数,在此以大于1.7作为选择参数。从288个克隆中挑出118株阳性克隆,并对其进行测序。结果表明,118株阳性克隆中共有6条序列具有两次及两次以上的重复,分别命名为C1-C6。
2.3 验证多肽与IVIG的结合情况
ELISA检测以上合成的6条多肽C1-C6,结果(图1)表明,多肽C1与IVIG-AOB结合与对照组没有差异,说明C1可能与抗体的恒定区结合;而C2-C6与IVIG-AOB的结合明显高于与对照抗体的结合,说明C2-C6这5条多肽是潜在的Aβ寡聚体模拟表位。
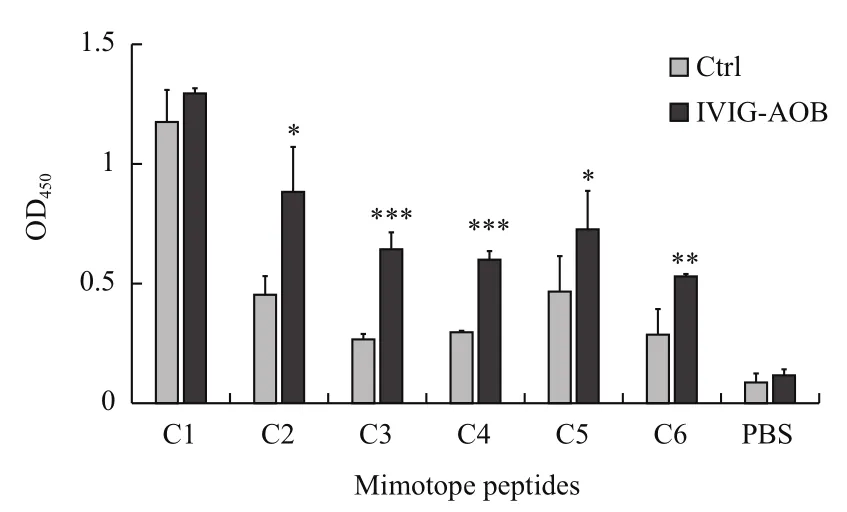
图1 ELISA检测合成的环形7肽与IVIG-AOB的结合
2.4 HBc重组蛋白构建、表达及纯化分析
SDS-PAGE和Western Blot检测表明HBc表位重组蛋白能够成功表达,Western Blot检测抗体是抗HBc抗体,目标条带在14-17 kD之间(图2),条带大小与预期相符。
2.5 HBc表位重组蛋白组装检测
透射电子显微镜(Transmission Electron Microscope,TEM)检测结果(图3)表明,HBc表位重组蛋白组装成正常的VLP颗粒。
2.6 HBc-VLP模拟表位疫苗免疫后血清中抗体的水平
包被表位多肽的ELISA检测结果(图4)表明,5种HBc表位疫苗免疫3次后都可诱发针对各自表位的抗体,表明HBc载体是一种有效的半抗原载体。包被Aβ42寡聚体的ELISA检测结果表明,由于HBc-VLP是一种分子量大于3 000 kD,结构复杂的大蛋白,能够免疫产生多种抗体;Aβ42寡聚体则是不同分子量Aβ的混合物,包含多种不同的构象表位,因此HBc-VLP免疫产生的抗体可能会和Aβ42寡聚体发生一些交叉反应,导致HBc产生的抗Aβ42寡聚体抗体水平偏高。然而HBc-C4诱导产生抗 Aβ42寡聚体抗体明显高于HBc对照组,其余则与HBc对照组无显著差异(图5),表明C4多肽较好的模拟了Aβ42寡聚体表位。
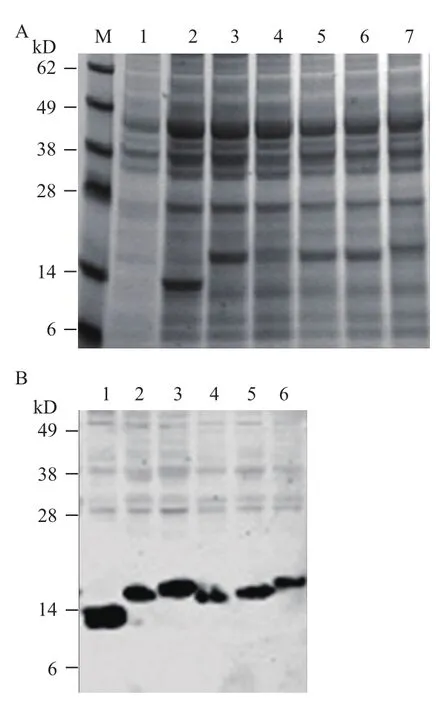
图2 SDS-PAGE(A)和Western-blot(B)检测HBc及HBc重组蛋白表达情况

图3 透射电镜检测纯化后HBc-VLP重组蛋白

图4 ELISA检测小鼠血清中抗表位多肽IgG的水平

图5 ELISA检测小鼠血清中抗Aβ42寡聚体IgG的水平
3 讨论
阿尔茨海默症(AD)是一种持续性恶化的神经退变性疾病,常发生于65岁以上的老人,是最常见的一种老年痴呆疾病[13-15]。随着世界人口老龄化的加剧,AD已成为最大的公共健康问题[16]。针对Aβ的免疫治疗一直被认为是治疗AD的突破口。目前,Aβ疫苗和抗体先后经历过30多次临床试验,但尚无一种疫苗或抗体能够在III期临床试验中表现出良好的改善认知作用[15]。系统分析表明,目前临床所使用的疫苗或者抗体都是针对Aβ单体的N端、中间或者C端,而Aβ单体具有正常的生理功能。因此利用免疫反应中和Aβ单体可能会引起潜在的副作用。同时,对AD发病机制的研究表明,由Aβ单体聚集形成寡聚体是AD发病的核心诱发因素,由此引发一系列毒性级联反应[17]。因此,特异性靶向Aβ寡聚体的免疫制剂可能具有较好的治疗效果,并能减少副作用产生。2016年,一例利用抗Aβ寡聚体的单克隆抗体Aducanumab治疗AD的临床实验表明,Aducanumab能够明显改善AD患者的认知损伤和病理学损伤[10]。
本研究利用从IVIG中纯化获得的特异性结合Aβ42寡聚体的组分IVIG-AOB为靶抗体,通过随机多肽库淘选获得了一系列与之结合的表位多肽;以HBc为载体构建出多个表位载体疫苗,并进行免疫检测从而成功筛选出一株可免疫产生Aβ寡聚体抗体模拟表位疫苗HBc-C4。IVIG-AOB作为一种Aβ寡聚体抗体,相较于目前商业化的Aβ寡聚体抗体A11和OC(均为兔源抗体),其来源于正常人体,安全性更高并特异性结合Aβ42寡聚体。筛选获得表位多肽C4与Aβ42一级序列无任何同源性,且C4为环形的多肽,因此我们认为模拟表位C4免疫产生的抗体不应该与Aβ42单体结合,从而有效避免了自身免疫反应问题。
HBc-C4是一种完全模拟Aβ42寡聚体的表位疫苗,与目前已报道的Aβ聚集体疫苗-Affitope AD02,SDPM1,3A,pBri等相比具有明显的优势。AD02表位与Aβ单体有50%同源性,其产生的抗体虽不和Aβ单体及APP结合,但主要识别Aβ纤维而非寡聚体[18]。SDPM1是一种可结合Aβ40聚集体的环形20肽,其免疫产生的抗体可结合Aβ聚集体而不能特异性针对寡聚体[19]。3A是由8种氨基酸(T、Y、S、H、I、V、F和L)随机合成的20肽,3A本身并不能作为Aβ寡聚体表位,而是其聚集物可免疫产生抗Aβ前纤维状寡聚体的抗体[20]。与3A相似,ABri多肽聚集后形成的聚合物-pABri免疫小鼠能诱发针对Aβ寡聚体的抗体反应[21]。AD02、SDPM1、3A及ABri等Aβ聚集体疫苗都能够明显改善AD转基因小鼠的记忆和病理损伤。因此,我们认为HBc-C4具有治疗AD转基因小鼠的潜力。除此之外,病毒样颗粒(VLP)是一种呈递外源表位理想的载体[12],目前已有多种VLP疫苗应用于临床研究,包括乙肝病毒表面抗原(Hepatitis B virus surface antigen,HBs)疫苗和人乳头瘤病毒(Human papillomavirus,HPV)疫苗[13]等。乙肝病毒核心抗原(Hepatitis B core antigen,HBc)作为抗原制备出的疫苗已得到十分广泛的临床应用,其安全性已经得到确认。因而,以HBc-VLP作为载体制备的表位疫苗在未来临床试验中安全性优越。
4 结论
本研究成功验证了应用新型Aβ42寡聚体模拟表位制备AD疫苗的可行性。通过噬菌体筛选技术,成功获得了一类Aβ42寡聚体模拟表位多肽,并将其克隆至HBc载体中,构建HBc-VLP表位疫苗,通过免疫后筛选获得一株可产生抗Aβ42寡聚体抗体的模拟表位疫苗株HBc-C4。
[1]Querfurth HW, Laferla FM. Mechanisms of disease Alzheimer’s disease[J]. New Engl J Med, 2010, 362(4):329-344.
[2]Haass C, Selkoe DJ. Soluble protein oligomers in neurodegeneration:lessons from the Alzheimer’s amyloid beta-peptide[J]. Nat Rev Mol Cell Bio, 2007, 8(2):101-112.
[3]Muller UC, Zheng H. Physiological functions of APP family proteins[J]. Cold Spring Harbor Perspectives in Medicine, 2012,2(2):a006288.
[4]Schneeberger A, Mandler M, Mattner F, et al. AFFITOME(R)technology in neurodegenerative diseases the doubling advantage[J]. Hum Vaccines, 2010, 6(11):948-952.
[5]Senior K. Dosing in phase II trial of Alzheimer’s vaccine suspended[J]. Lancet Neurol, 2002, 1(1):3.
[6]Pasquier F, Sadowsky C, Holstein A, et al. Two Phase 2 multiple ascending-dose studies of vanutide cridificar(ACC-001)and QS-21 adjuvant in mild-to-moderate Alzheimer’s disease[J]. J Alzheimers Dis, 2016, 51(4):1131-1143.
[7]Farlow MR, Andreasen N, Riviere ME, et al. Long-term treatment with active A β immunotherapy with CAD106 in mild Alzheimer’s disease[J]. Alzheimers Res Ther, 2015, 7(1):23.
[8]Vandenberghe R, Rinne JO, Boada M, et al. Bapineuzumab for mild to moderate Alzheimer’s disease in two global, randomized, phase 3 trials[J]. Alzheimers Res Ther, 2016, 8(1):18.
[9]Doody RS, Thomas RG, Farlow M, et al. Phase 3 Trials of solanezumab for mild-to-moderate Alzheimer’s disease[J]. New Engl J Med, 2014, 370(4):311-321.
[10]Sevigny J, Chiao P, Bussiere T, et al. The antibody aducanumab reduces A β plaques in Alzheimer’s disease[J]. Nature, 2016,537(7618):50-56.
[11]Relkin N. Clinical Trials of intravenous immunoglobulin for Alzheimer’s disease[J]. J Clin Immunol, 2014, 34(1):S74-S79.
[12]Ye S, Zeng R, Jiang P, et al. Concentrations of antibodies against beta-amyloid 40/42 monomer and oligomers in Chinese intravenous immunoglobulins[J]. Journal of Pharmaceutical and Biomedical Analysis, 2017, 138(2):277-282.
[13]Boller F, Forbes MM. History of dementia and dementia in history:an overview[J]. J Neurol Sci, 1998, 158(2):125-133.
[14]Bleuler E. Dementia praecox or the group of schizophrenias[J].Vertex, 2010, 21(93):394-400.
[15]Alzheimer’s A. 2016 Alzheimer’s disease facts and figures[J].Alzheimers Dement, 2016, 12(4):459-509.
[16]Prince M, Comas-Herrera A, Knapp M, et al. World Alzheimer report 2016:improving healthcare for people living with dementia:coverage, quality and costs now and in the future[C].London :Alzheimer’s Disease International, 2016.
[17] Nimmrich V, Ebert U. Is Alzheimer’s disease a result of presynaptic failure? Synaptic dysfunctions induced by oligomeric beta-amyloid[J]. Rev Neuroscience, 2009, 20(1):1-12.
[18] Mandler M, Santic R, Gruber P, et al. Tailoring the antibody response to aggregated a beta using novel Alzheimer-vaccines[J].PLoS One, 2015, 10(1):e0115237.
[19]Kang C K, Jayasinha V, Martin P T. Identification of peptides that specifically bind A β(1-40)amyloid in vitro and amyloid plaques in Alzheimer’s disease brain using phage display[J]. Neurobiol Dis, 2003, 14(1):146-156.
[20]Rasool S, Albay R, Martinez-Coria H, et al. Vaccination with a non-human random sequence amyloid oligomer mimic results in improved cognitive function and reduced plaque deposition and micro hemorrhage in Tg2576 mice[J]. Mol Neurodegener, 2012,7:37.
[21]Goni F, Prelli F, Ji Y, et al. Immunomodulation Targeting abnormal protein conformation reduces pathology in a mouse model of Alzheimer’s disease[J]. PLoS One, 2010, 5(10):e13391.
Preparation of a Novel Aβ42 Oligomer Mimotope Vaccine
LIU Xiang-meng1YU Ya-dong2WANG Shao-wei3YU Xiao-lin3WANG Rui-ming1
(1. Department of Biology Engineering,QILU University of Technology,Jinan 250353 ;2. Kunming Environmental Monitoring Center,Kunming 650100 ;3. State Key Laboratory of Biochemical Engineering,Institute of Process Engineering,Chinese Academy of Sciences,Beijing 100190)
The objective of this study is to obtain a mimotope vaccine specifically targeting to pathogenic Aβ42 oligomer. In previous studies,we purified an antibody IVIG-AOB,which specifically recognizes Aβ42 oligomers,from intravenous immunoglobulin(IVIG)by affinity chromatography. Using phage display technique,a series of ring-shape mimotope polypeptides were screened for specific binding to IVIG-AOB. These oligomer epitope peptide genes were then cloned to HBc-VLP vector and the recombinant proteins were expressed in Escherichia coli. After that,the recombinant Aβ42 oligomer conformational epitope HBc-VLP vaccine were applied to Balb/c mice. The antibody responses induced by the Aβ42 oligomer-targeted VLP vaccine were determined. Five mimotope polypeptides specifically-bound with IVIGAOB were successfully screened from phage cyclic peptide library and cloned into HBc-VLP vector. The recombinant proteins were successfully expressed in E. coli. HBc-C4 elicited the highest antibody titer after vaccination to Balb/c mice. Conclusively,Aβ oligomer is the major factor in the pathological processes of Alzheimer’s disease(AD). The mimotope HPc-VLP vaccine based on the unique structure of Aβ42 oligomer induced body to generate the antibody targeting and neutralizing the toxic Aβ42 oligomers,while not affecting its normal physiological function,thus it plays a fundamental role in the treatment of AD.
Alzheimer’s disease;Aβ42 oligomers;mimotope;vaccine;antibody
10.13560/j.cnki.biotech.bull.1985.2017-0488
2017-06-10
国家自然科学基金项目(81402837),国家科技重大专项(2014ZX09102041-007)
刘向蒙,男,硕士,研究方向:生物技术药物;E-mail:liuxm@ipe.ac.cn
王瑞明,男,博士,教授,研究方向:微生物酶技术;E-mail:ruiming3k@163.com
(责任编辑 李楠)

