水飞蓟素对丙烯酰胺诱导人肝癌细胞氧化损伤的保护作用
李 亮,赵筱铎,刘 巍,孙红洋,赵洪宇,邵美丽,*
水飞蓟素对丙烯酰胺诱导人肝癌细胞氧化损伤的保护作用
李 亮1,赵筱铎1,刘 巍2,孙红洋1,赵洪宇1,邵美丽1,*
研究水飞蓟素对人肝癌细胞系(human hepatocellular liver carcinoma cell line,HepG2)增殖的影响以及对食品加工过程中产生的丙烯酰胺所致肝细胞毒性的预防效果,同时对其保护机制进行探讨。通过噻唑蓝法检测水飞蓟素对HepG2细胞增殖的影响和对丙烯酰胺诱发HepG2细胞毒性的保护效果;利用荧光探针法对HepG2细胞内活性氧的变化进行检测,并运用比色法分别检测细胞内脂质、蛋白质及DNA的氧化损伤标志物(丙二醛、蛋白羰基和8-羟基脱氧鸟苷)含量;利用酶活力试剂盒检测细胞内过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力的变化。结果显示,12~96 µg/mL的水飞蓟素对HepG2细胞无毒性;水飞蓟素可以抑制丙烯酰胺引起的细胞存活率降低和氧自由基水平升高,减少丙烯酰胺对脂质、蛋白质和DNA的氧化损伤,并提高细胞内抗氧化物酶CAT、SOD和GSH-Px活力。研究证明,水飞蓟素能够缓解丙烯酰胺对肝细胞造成的氧化损伤。
水飞蓟素;丙烯酰胺;人肝癌细胞系
丙烯酰胺在日常生活中主要应用于工业领域,对人或动物具有神经毒性、生殖毒性、遗传毒性和致癌性[1-2]。近些年来有研究发现,含淀粉类的食品经高温加工(≥120 ℃)会形成丙烯酰胺[3-5],抑制食品中丙烯酰胺对人类造成的损伤是非常必要的。有实验证明,丙烯酰胺还具有明显的肝毒性,这与丙烯酰胺能够诱导细胞产生过量的活性氧(reactive oxygen species,ROS),从而破坏细胞内的氧化还原平衡,造成细胞损伤或凋亡有着密切联系[6-7]。正常情况下,ROS产生于线粒体和免疫系统,可以抵抗来自病原菌的侵害。但过量的ROS会对多种生物分子包括蛋白质、脂质和DNA具有损伤作用,引发多种退行性疾病[8-10]。此外,丙烯酰胺在细胞内会被细胞色素P450转化成环氧丙酰胺(glycidamide,GA),GA对细胞内蛋白质、DNA的攻击和对还原型谷胱甘肽(glutathione,GSH)的消耗均比丙烯酰胺强[11-12]。
植物化学物质能够有效地保护细胞免受因过量ROS引起的氧化损伤,且因自身具有良好的药用价值而被广泛关注[13]。从奶蓟草中提取的水飞蓟素是一种天然黄酮类混合物,约由50%水飞蓟宾、20%水飞蓟亭、10%异水飞蓟素、5%异水飞蓟宾和15%其他有机聚合物构成。水飞蓟素作为一种常用的保肝成分,具有强抗炎和抗氧化活性[14-15]。人肝癌细胞瘤细胞系(human hepatocellular liver carcinoma cell line,HepG2)具有增殖快、永生化等特性,且含有大部分肝细胞酶系,例如Ⅰ相和Ⅱ相解毒酶,常被用于作为探究化学物质毒性及细胞保护作用的模型[16-17]。本研究利用丙烯酰胺诱导建立HepG2细胞的氧化损伤模型,探讨水飞蓟素预防丙烯酰胺肝毒性的初步作用机制,从而为降低食品中丙烯酰胺对人类造成的损害提供新思路。
1 材料与方法
1.1 材料与试剂
HepG2细胞由哈尔滨商业大学药理学院惠赠。
水飞蓟素(纯度≥90%) 美国Sigma公司;丙烯酰胺(纯度≥99.9%)、噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)(纯度>98%) 美国Amresco公司;RPMI-1640完全培养基美国Gibco公司;胎牛血清 杭州四季青有限公司;BCA蛋白浓度检测试剂盒、ROS检测试剂盒 上海碧云天生物技术有限公司;丙二醛(malondialdehyde,MDA)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒、蛋白质羰基含量检测试剂盒 南京建成生物工程研究所;人8-羟基脱氧鸟苷(8-hydroxy-2’-deoxyguanosine,8-OHdG)检测试剂盒中国Summus公司;其他试剂均为分析纯。
1.2 仪器与设备
Model-680酶标仪 美国伯乐公司;650-60荧光分光光度计 日本日立公司。
1.3 方法
1.3.1 细胞培养和预处理
HepG2细胞培养于含10%胎牛血清、1%双抗(青霉素和链霉素)的1640培养基中。培养条件为37 ℃、5% CO2,选取对数生长期细胞进行实验。细胞预处理及分组如下:对照组:正常培养的HepG2细胞;氧化应激模型组:8 mmol/L丙烯酰胺干预24 h培养的HepG2细胞;实验组:分别用12、24、48、96 μg/mL水飞蓟素提前干预6 h,再用8 mmol/L丙烯酰胺干预24 h,对应制成实验组1、2、3、4。
1.3.2 MTT法测定细胞存活率
取对数生长期HepG2细胞按1×104个/孔的密度接种于96 孔细胞板中,37 ℃、5% CO2条件过夜培养后,分别向每孔中加入0.00、1.25、2.50、5.00、10.00、20.00 mmol/L丙烯酰胺干预24 h,每组设置3 个平行。再向各孔中加入20 μL MTT,37 ℃避光孵育4 h,弃去每孔中培养液,加入150 μL 二甲基亚砜,避光振荡10 min,于570 nm波长处测定各组OD值,并按式(1)计算各组细胞存活率。
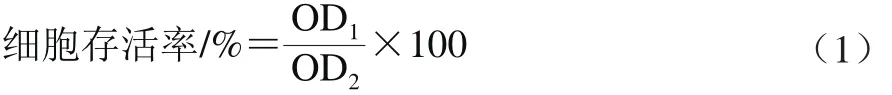
式中:OD1为加入各浓度丙烯酰胺的细胞培养液OD值;OD2为未加入丙烯酰胺的细胞培养液OD值。
取对数生长期HepG2细胞按1×104个/孔的密度接种于96 孔细胞板中,37 ℃、5% CO2条件过夜培养后,分别向每孔中加入0、12、24、48、96 μg/mL水飞蓟素干预24 h,按照上述MTT法依次进行测定,每组设置3 个平行。并按式(2)计算各组细胞存活率。
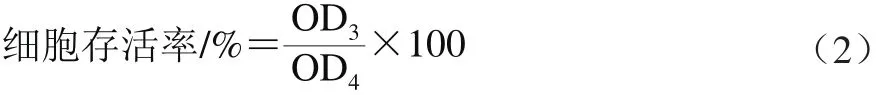
式中:OD3为加入各质量浓度水飞蓟素的细胞培养液OD值;OD4为未加入水飞蓟素的细胞培养液OD值。
再利用上述MTT法依次对1.3.1节中对照组、模型组和实验组进行测定,并按照式(3)计算各组细胞存活率。

1.3.3 氧化指标水平的测定
1.3.3.1 ROS相对水平测定
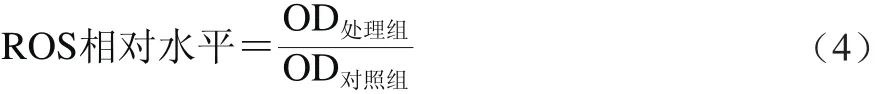
取对数生长期HepG2细胞,按实验需求给予不同因素处理,分别制成对照组、模型组、实验组1~4。弃掉细胞培养液,每孔加入2 mL 10 μmol/L的荧光探针2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA),37 ℃细胞培养箱内孵育20 min。无血清细胞培养液洗涤细胞3 次后,收集细胞,用荧光分光光度计检测,激发波长为488 nm,发射波长为525 nm。按式(4)计算ROS相对水平。
1.3.3.2 氧化损伤标志物含量测定
MDA、蛋白羰基和8-OHdG分别是细胞内脂质、蛋白质和DNA氧化损伤的标志物[18-20]。将对照组、模型组、实验组1~4的培养液1 000 r/min离心10 min,收集细胞,预冷的磷酸盐缓冲液洗涤3 次,加入细胞裂解液对细胞进行裂解,2 500 r/min离心10 min收集细胞上清液。用BCA蛋白质量浓度检测试剂盒测定细胞上清液蛋白质量浓度,然后分别按照MDA、蛋白羟基和8-OHdG检测试剂盒上的方法测定MDA、蛋白羟基和8-OHdG含量,结果分别用nmol/mg pro、nmol/mg pro和μg/mg pro表示。
1.3.4 CAT、SOD和GSH-Px活力的测定
取对照组、模型组、实验组1~4培养液,1 000 r/min离心10 min收集细胞,预冷的磷酸盐缓冲液洗涤3 次,加入细胞裂解液,冰浴条件下对细胞进行裂解后,2 500 r/min离心10 min收集细胞上清液。BCA蛋白质量浓度检测试剂盒测定上清液蛋白质量浓度,并按照CAT、SOD和GSH-Px检测试剂盒上的方法测定CAT、SOD和GSH-Px活力,用U/mg pro表示。
1.4 数据统计处理
实验数据采用SPSS 11.0统计软件进行分析,结果用 ±s表示。并对实验结果进行t检验,P<0.05表示差异显著。
2 结果与分析
2.1 丙烯酰胺对HepG2细胞的毒性作用
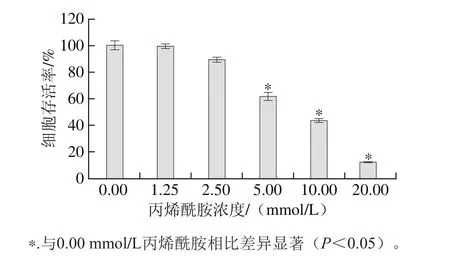
图1 丙烯酰胺对HepG2细胞的毒性作用Fig. 1 Cytotoxic effect of acrylamide on HepG2 cells
MTT法检测丙烯酰胺对HepG2细胞的毒性作用结果如图1所示。HepG2细胞的存活率随着丙烯酰胺浓度的增加而逐渐减少,并通过Graphpad Prism软件计算丙烯酰胺作用24 h的半数致死剂量(half maximal inhibitory concentration,IC50)为(8.04±0.37) mmol/L,故本实验选用8 mmol/L作为后续探究中丙烯酰胺的给药浓度。
2.2 水飞蓟素对HepG2细胞增殖的影响
利用MTT法检测水飞蓟素对HepG2细胞增殖的影响,结果如图2所示。HepG2细胞在不同质量浓度(12、24、48、96 µg/mL)的水飞蓟素作用下,细胞存活率与无水飞蓟素干预正常条件培养的HepG2细胞相比无显著差异。说明水飞蓟素对HepG2细胞增殖没有影响,为后续探究水飞蓟素对丙烯酰胺诱导HepG2细胞毒性的抑制作用提供了保障。
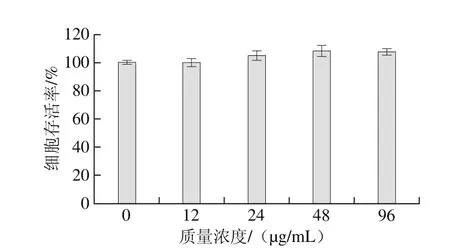
图2 水飞蓟素对HepG2细胞增殖的影响Fig. 2 Effect of silymarin on the proliferation of HepG2 cells
2.3 水飞蓟素对丙烯酰胺所致HepG2细胞毒性的影响
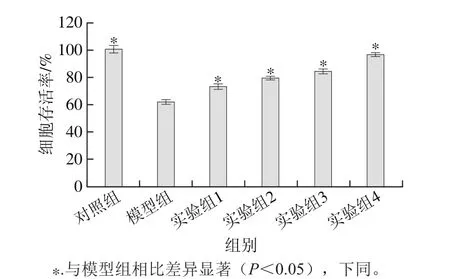
图3 水飞蓟素对丙烯酰胺诱导HepG2细胞毒性的影响Fig. 3 Effect of silymarin on acrylamide-induced cytotoxicity in HepG2 cells
如图3所示,对照组细胞存活率显著高于模型组(P<0.05),说明丙烯酰胺对HepG2细胞增殖具有抑制作用。而实验组1~4的细胞存活率相比模型组显著增加(P<0.05),说明水飞蓟素能显著缓解HepG2细胞受丙烯酰胺引发的细胞毒性,且与质量浓度呈正相关。
2.4 水飞蓟素对丙烯酰胺诱导损伤的HepG2细胞氧化指标的影响
2.4.1 ROS相对水平
细胞内过量ROS的产生能使细胞发生氧化应激现象,从而对细胞造成氧化损伤,所以细胞内ROS水平能直接反映细胞氧化损伤的程度[21]。运用荧光探针DCFH-DA法,对各组HepG2细胞中ROS相对水平进行测定,结果如图4所示。实验组1~4和对照组的ROS相对水平均显著低于模型组(P<0.05)。结合MTT法的结果可知,丙烯酰胺能通过诱发大量ROS的生成,对HepG2细胞造成损伤,而水飞蓟素则通过降低细胞中ROS的水平对HepG2细胞起到保护的效果,且与质量浓度呈正相关。

图4 水飞蓟素对丙烯酰胺诱导HepG2细胞内ROS相对水平的影响Fig. 4 Effects of silymarin on relative ROS level in acrylamide-induced HepG2 cells
2.4.2 MDA、蛋白羰基键和8-OHdG的含量
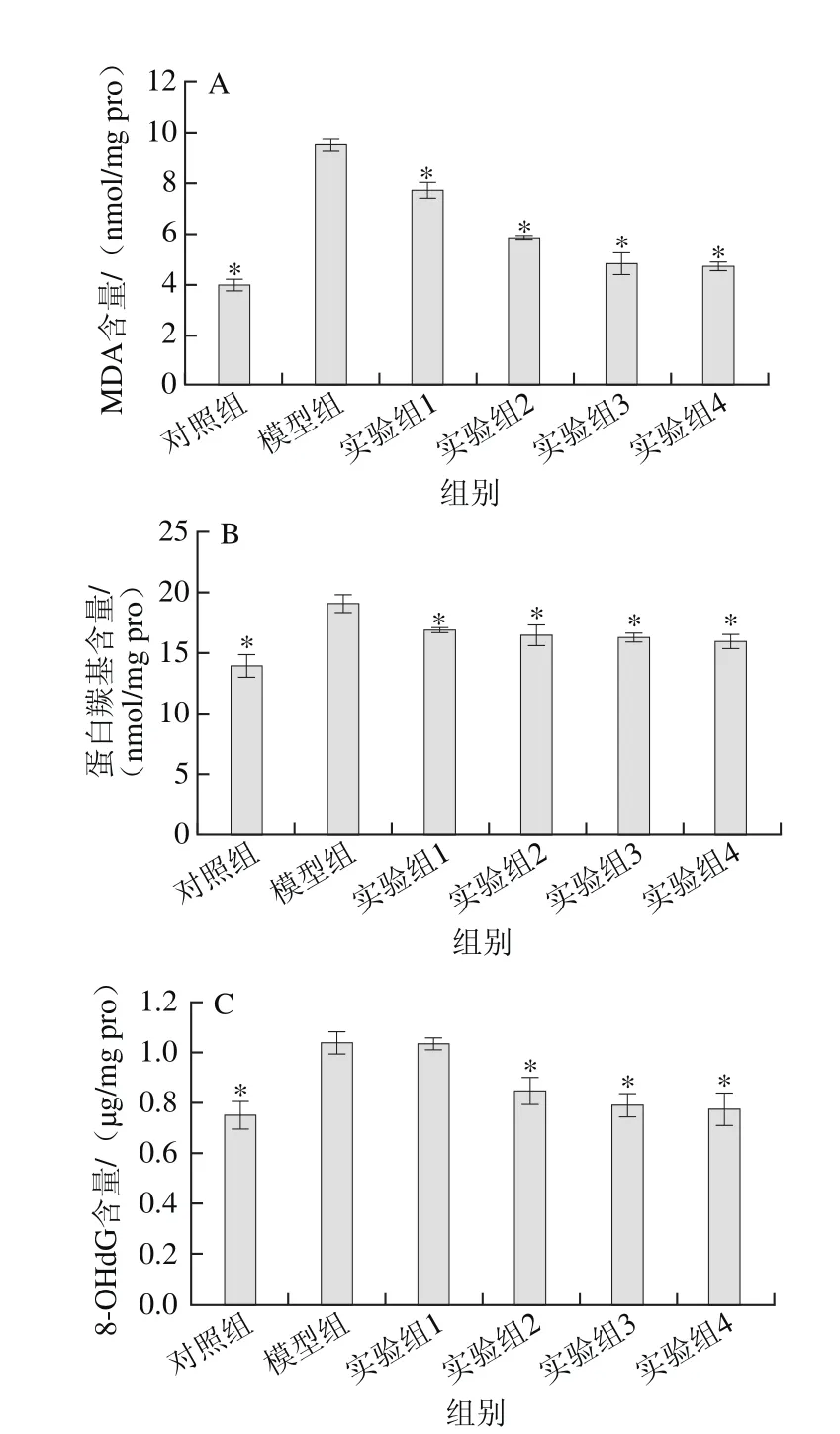
图5 水飞蓟素对丙烯酰胺诱导HepG2细胞内MDA(A)、蛋白羰基(B)、8-OHdG(C)含量的影响Fig. 5 Effect of silymarin on the contents of MDA (A), protein carbonyl (B)and 8-OHdG (C) in acrylamide-induced HepG2 cells
MDA是细胞内脂质的氧化损伤标志物,由细胞膜上的脂质与ROS发生的过氧化反应生成,能破坏甚至摧毁细胞膜[22]。MDA能和硫代巴比妥酸反应生成红色物质,利用这一性质对HepG2细胞内的MDA含量进行测定。如图5A所示,模型组的MDA含量显著高于对照组(P<0.05),这与丙烯酰胺能诱发细胞产生大量ROS密切相关;而实验组随着水飞蓟素质量浓度的增加逐渐减少实验组HepG2细胞内的MDA含量,这一结果与前面细胞内ROS相对水平测定的结果相符。由此说明,水飞蓟素能够减少丙烯酰胺对HepG2细胞内脂质的氧化损伤。
蛋白羰基是ROS或活性氮氧化蛋白的产物,通常用来衡量蛋白质的氧化损伤程度[23]。运用2,4-二硝基苯肼比色法对HepG2细胞内的蛋白羰基含量进行检测。如图5B所示,所有实验组和对照组的蛋白羰基含量显著低于模型组(P<0.05)。表明水飞蓟素能够抑制丙烯酰胺对HepG2细胞内蛋白质的氧化损伤,且与水飞蓟素的质量浓度呈正相关。
8-OHdG是ROS诱发细胞内DNA羟基化形成的,具有修复鸟嘌呤氧化损伤的功能,被公认为一个合适的鉴定DNA氧化损伤标志物[24]。通过酶联免疫吸附测定法检测HepG2细胞内8-OHdG含量,由图5C可知,除实验组1外其他组别的8-OHdG含量均显著低于模型组(P<0.05)。结果证明,水飞蓟素能够抑制丙烯酰胺对HepG2细胞内DNA的氧化损伤,且呈剂量依赖性。
综上所述,水飞蓟素对丙烯酰胺造成HepG2细胞内脂质、蛋白质和DNA的氧化损伤均能起到保护作用,且与水飞蓟素质量浓度呈正相关。
2.5 水飞蓟素对丙烯酰胺诱导损伤的HepG2细胞抗氧化能力的影响
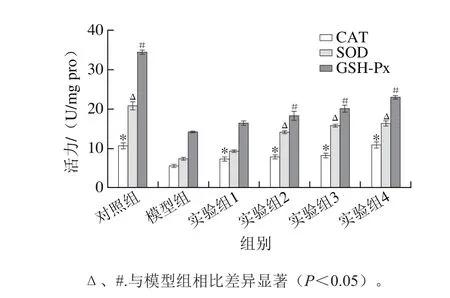
图6 水飞蓟素对丙烯酰胺诱导HepG2细胞内CAT、SOD和GSH-Px活力的影响Fig. 6 Effect of silymarin on the activities of CAT, SOD and GSH-Px in acrylamide-induced HepG2 cells
CAT、SOD和GSH-Px是细胞内3 种重要的抗氧化物酶,常被用于机体抗氧化损伤作用方面的研究。CAT能促使细胞中有害的H2O2转化为无毒的氧和水[25];SOD是一种金属酶,是机体内抵抗ROS损伤的第一道防御关卡,可以使有毒的超氧化自由基降解为氧和过氧化物[26];GSH-Px在体内能通过GSH来调控ROS以及消除有机过氧化物[27],而GSH是一种内源性巯基化合物,对维护细胞的氧化还原平衡和氨基酸平衡、调控细胞基因及胞内信号的转导起到重要作用,与多种蛋白的结构、功能和稳定性相关[28]。有研究发现,丙烯酰胺在体内的代谢也与GSH密切相关,丙烯酰胺在体内一部分被氧化成GA,GA和丙烯酰胺都能在谷胱甘肽-S-转移酶的作用下,结合GSH形成GSH-丙烯酰胺复合物,最后降解为硫醇尿酸[29]。对HepG2细胞内抗氧化物酶CAT、SOD和GSH-Px活力的测定结果由图6可知,实验组1~4和对照组的CAT活力均显著高于模型组(P<0.05),而除实验组1外其余组别的SOD和GSH-Px活力显著大于模型组(P<0.05)。说明水飞蓟素能通过提高胞内CAT、SOD和GSH-Px的活力来保护HepG2细胞抵抗丙烯酰胺诱导的损伤作用,且与水飞蓟素的质量浓度呈正相关性,水飞蓟素的这一功能可能与细胞内的一种核转录因子Nrf2相关[30]。
3 结 论
本实验探究水飞蓟素在保护肝细胞抵抗丙烯酰胺诱导的氧化损伤方面的功能。研究发现水飞蓟素能通过降低细胞内ROS的水平,改善抗氧化物酶CAT、SOD和GSH-Px的活力,对丙烯酰胺造成HepG2细胞内脂质、蛋白质和DNA的氧化损伤起到抑制效果,且与水飞蓟素剂量呈正相关性。MTT法测定结果显示经不同质量浓度水飞蓟素处理的HepG2细胞的存活率与正常培养细胞无统计学意义上的差异,这说明水飞蓟素对HepG2细胞增殖没有影响。本研究证实水飞蓟素能预防丙烯酰胺的肝毒性,并对其作用机制进行了初步探究,为降低食品中丙烯酰胺对机体造成损伤的风险提供了一条途径。
[1] XU Y, CUI B, RAN R, et al. Risk assessment, formation, and mitigation of dietary acrylamide: current status and future prospects[J].Food and Chemical Toxicology, 2014, 69: 1-12. DOI:10.1016/j.fct.2014.03.037.
[2] ZHAO M, WANG F S, HU X S, et al. Effect of acrylamide-induced neurotoxicity in a primary astrocytes/microglial co-culture model[J].Toxicology in Vitro, 2017, 39: 119-125. DOI:10.1016/j.tiv.2016.11.007.
[3] PEDRESCHI F, MARIOTTI M S, GRANBY K. Current issues in dietary acrylamide: formation, mitigation and risk assessment[J].Journal of the Science of Food and Agriculture, 2014, 94(1): 9-20.DOI:10.1002/jsfa.6349.
[4] RIBOLDI B P, VINHAS Á M, MOREIRA J D. Risks of dietary acrylamide exposure: a systematic review[J]. Food Chemistry, 2014,157(15): 310-322. DOI:10.1016/j.foodchem.2014.02.046.
[5] MOTTRAM D S, WEDZICHA B L, DODSON A T. Acrylamide is formed in the Maillard reaction[J]. Nature, 2002, 419: 448-449.DOI:10.1038/419448a.
[6] CHEN W, SU H M, XU Y, et al. Protective effect of wild raspberry (Rubus hirsutus Thunb.) extract against acrylamide-induced oxidative damage is potentiated after simulated gastrointestinal digestion[J]. Food Chemistry,2016, 196(1): 943-952. DOI:10.1016/j.foodchem.2015.10.024.
[7] SHAN X Y, LI Y, MENG X, et al. Curcumin and (-)-epigallocatechin-3-gallate attenuate acrylamide-induced proliferation in HepG2 cells[J].Food and Chemical Toxicology, 2014, 66: 194-202. DOI:10.1016/j.fct.2014.01.046.
[8] MURPHY M P. How mitochondria produce reactive oxygen species[J].Biochemical Journal, 2009, 417(1): 1-13. DOI:10.1042/BJ20081386.
[9] FENG X J, YU W, ZHOU F F, et al. A novel small molecule compound diaporine inhibits breast cancer cell promoting ROS generation[J]. Biomedicine and Pharmacotherapy, 2016, 83: 1038-1047. DOI:10.1016/j.biopha.2016.08.029.
[10] LI S, CHEN G W, ZHANG C, et al. Research progress of natural antioxidants in foods for the treatment of diseases[J]. Food Science and Human Wellness, 2014, 3(3/4): 110-116. DOI:10.1016/j.fshw.2014.11.002.
[11] NAN M, HU J X, CHURCHWELLl M I, et al. Genotoxic effects of acrylamide and glycidamide in mouse lymphoma cells[J]. Food and Chemical Toxicology, 2008, 46(2): 628-636. DOI:10.1016/j.fct.2007.09.093.
[12] LIU Z G, SONG G, ZOU C, et al. Acrylamide induces mitochondrial dysfunction and apoptosis in BV-2 microglial cells[J]. Free Radical Biology and Medicine, 2015, 84: 42-53. DOI:10.1016/j.freeradbiomed.2015.03.013.
[13] OROIAN M, ESCRICHE I. Antioxidants: characterization, natural sources, extraction and analysis[J]. Food Research International, 2015,74: 10-36. DOI:10.1016/j.foodres.2015.04.018.
[14] ZHOLOBENKO A, MODRIANSKY M. Silymarin and its constituents in cardiac preconditioning[J]. Fitoterapia, 2014, 97: 122-132.DOI:10.1016/j.f i tote.2014.05.016.
[15] HSIANG C, LIN L J, KAO S T, et al. Glycyrrhizin, silymarin, and ursodeoxycholic acid regulate a common hepatoprotective pathway in HepG2 cells[J]. Phytomedicine, 2015, 22(7/8): 768-777. DOI:10.1016/j.phymed.2015.05.053.
[16] BAEZA G, SARRIÁ B, MATEOS R, et al. Dihydrocaffeic acid,a major microbial metabolite of chlorogenic acids, shows similar protective effect than a yerba mate phenolic extract against oxidative stress in HepG2 cells[J]. Food Research International, 2016, 87: 25-33.DOI:10.1016/j.foodres.2016.06.011.
[17] YAN F J, DAI G H, ZHENG X D. Mulberry anthocyanin extract ameliorates insulin resistance by regulating PI3K/AKT pathway in HepG2 cells and db/db mice[J]. The Journal of Nutritional Biochemistry, 2016, 36: 68-80. DOI:10.1016/j.jnutbio.2016.07.004.
[18] YONNY M E, GARCÍA E, JOSÉI A L, et al. Measurement of malondialdehyde as oxidative stress biomarker in goat plasma by HPLC-DAD[J]. Microchemical Journal, 2016, 129: 281-285.DOI:10.1016/j.microc.2016.07.010.
[19] KEDZIERSKA M, OLAS B, WACHOWICZ B, et al. Relationship between thiol, tyrosine and carbonyl formation as biomarkes of oxidative stress and changes of hemostatic function of plasma form breast cancer patients before surgery[J]. Clinical Biochemistry, 2012,45(3): 231-236. DOI:10.1016/j.clinbiochem.2011.12.002.
[20] SETYANINGSIH Y, HUSODO A H, ASTUTI I. Detection of urinary 8-hydroxydeoxyguanosine (8-OHdG) levels as biomarker of oxidative DNA damage among home industry workers exposed to chromium[J].Procedia Environmental Sciences, 2015, 23: 290-296. DOI:10.1016/j.proenv.2015.01.043.
[21] LEPETSOS P, PAPAVASSILIOU A G. ROS/oxidative stress signaling in osteoarthritis[J]. Biochimica et Biophysica Acta: Molecular Basis of Disease, 2016, 1862(4): 576-591. DOI:10.1016/j.bbadis.2016.01.003.
[22] BUSH C J, BINDER C J. Malondialdehyde epitopes as mediators of sterile inflammation[J]. Biochimica et Biophysica Acta: Molecular and Cell Biology of Lipids, 2016, 1862(4): 398-406. DOI:10.1016/j.bbalip.2016.06.016.
[23] WU J Z, LUO X T, JING S Q, et al. Tow-dimensional gel electrophoretic detection of portein carbonyls derivatized with biotinhydrazide[J]. Journal of Chromatography B, 2016, 1019(15): 128-131.DOI:10.1016/j.jchromb.2015.11.003.
[24] MARTINS G V, MARQUES A C, FORTUNATO E, et al. 8-Hydroxy-2’-deoxyguanosine (8-OHdG) biomarker detection down to picoMolar level on a plastic antibody film[J]. Biosensors and Bioelectronics,2016, 86(15): 225-234. DOI:10.1016/j.bios.2016.06.052.
[25] ZHANG X Y, LI Y H, WANG J X, et al. Identification and characteristic analysis of the catalase gene from Locusta migratoria[J]. Pesticide Biochemistry and Physiology, 2016, 132: 125-131. DOI:10.1016/j.pestbp.2016.03.010.
[26] JAIKUA W, KUEAKHAI P, CHAITHIRAYANON K, et al.Cytosolic superoxide dismutase can provide protection against Fasciocla gigantica[J]. Acta Tropica, 2016, 162: 75-82. DOI:10.1016/j.actatropica.2016.06.020.
[27] LIU G D, SHENG Z, WANG Y F, et al. Glutathione peroxidase 1 expression, malondialdehyde levels and histological alterations in the liver of Acrossochellus fasciatus exposed to cadmium chloride[J].Gene, 2016, 2(10): 210-218. DOI:10.1016/j.gene.2015.12.034.
[28] ZHAO L Z, ZHAO L, MIAO Y Q, et al. Selective eletrochemical determination of glutathione from the leakage of intracellular GSH contents in HeLa cells following doxorubicin-induced cell apoptosis[J].Electrochimica Acta, 2016, 206(10): 86-98. DOI:10.1016/j.electacta.2016.04.117.
[29] LUO Y S, LONG T Y, SHEN L C, et al. Synthesis, characterization and analysis of the acrylamide- and glycidamide-glutathione conjugates[J]. Chemic-Biological Interactions, 2015, 237(25): 38-46.DOI:10.1016/j.cbi.2015.05.002.
[30] ZHANG H J, WANG J, LIU Y L, et al. Wheat bran feruloyl oligosaccharides ameliorate AAPH-induced oxidative stress in HepG2 cell via Nrf2 signalling[J]. Journal of Functional Foods, 2016, 25: 333-340. DOI:10.1016/j.jff.2016.06.012.
Protective Effect of Silymarin on Acrylamide-Induced Oxidative Damage in HepG2 Cells
LI Liang1, ZHAO Xiaoduo1, LIU Wei2, SUN Hongyang1, ZHAO Hongyu1, SHAO Meili1,*
(1. College of Food Science, Northeast Agricultural University, Harbin 150030, China;2. Tongjiang Entry-Exit Inspection and Quarantine Bureau, Tongjiang 156400, China)
This study was designed to study the effect of silymarin on the proliferation of human hepatocellular liver carcinoma cell line (HepG2) and its preventive effect on the hepatotoxicity caused by acrylamide produced during food processing and to discuss the underlying mechanism. The effect of silymarin on the proliferation of HepG2 cells and its protective effect on acrylamide-induced cytotoxicity in HepG2 cells were evaluated by 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay. By use of fl uorescence probe 2,7-dichlorodi-hydrof l uorescein diacetate (DCFHDA) method, the change in intracellular reactive oxygen species (ROS) of HepG2 cells was detected, and the markers of oxidative damage to lipid, protein and DNA (malondialdehyde, protein carbonyl and 8-hydroxy-2’-deoxyguanosine) were colorimetrically detected. The activities of the intracellular antioxidant enzymes catalase (CAT), superoxide dismutase(SOD) and glutathione peroxidase (GSH-Px) were measured with commercial kits. Our data revealed that the silymarin at 12–96 µg/mL had no cytotoxic effect on HepG2 cells and could increase cell viability and the enzyme activities of CAT,SOD and GSH-Px, reducing intracellular ROS levels and oxidative damage induced by acrylamide to lipid, protein and DNA in HepG2 cells. Therefore, silymarin can protect hepatic cells from oxidative damage caused by food-derived acrylamide.
silymarin; acrylamide; HepG2
10.7506/spkx1002-6630-201801036
TS201.6
A
1002-6630(2018)01-0238-05
李亮, 赵筱铎, 刘巍, 等. 水飞蓟素在丙烯酰胺诱导人肝癌细胞氧化损伤中的保护作用[J]. 食品科学, 2018, 39(1):238-242.
10.7506/spkx1002-6630-201801036. http://www.spkx.net.cn
LI Liang, ZHAO Xiaoduo, LIU Wei, et al. Protective effect of silymarin on acrylamide-induced oxidative damage in HepG2 cells[J]. Food Science, 2018, 39(1): 238-242. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801036.http://www.spkx.net.cn
2016-10-12
黑龙江省自然科学基金面上项目(C201303);黑龙江省教育厅自然科学基金项目(12541045)
李亮(1990—),男,硕士研究生,研究方向为食品安全。E-mail:1066250905@qq.com
*通信作者简介:邵美丽(1974—),女,教授,博士,研究方向为食品安全。E-mail:shml0915@163.com
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.同江出入境检验检疫局,黑龙江 同江 156400)

