大孔树脂-中压柱层析联用分离纯化蓝莓花色苷
于泽源,赵剑辉,李兴国,徐雅琴,汤 雪,杨 昱,*
(1.东北农业大学园艺园林学院,黑龙江 哈尔滨 150030;2.东北农业大学理学院,黑龙江 哈尔滨 150030)
大孔树脂-中压柱层析联用分离纯化蓝莓花色苷
于泽源1,赵剑辉1,李兴国1,徐雅琴2,汤 雪1,杨 昱2,*
(1.东北农业大学园艺园林学院,黑龙江 哈尔滨 150030;2.东北农业大学理学院,黑龙江 哈尔滨 150030)
以蓝莓果实为原料,采用大孔树脂-中压柱层析联用分离纯化蓝莓花色苷。分别比较6 种不同类型树脂对蓝莓花色苷静态吸附-解吸效果,优化大孔树脂分离纯化蓝莓花色苷的工艺。结果表明:D101大孔树脂对蓝莓花色苷的分离效果最佳,对花色苷的吸附属于多分子层吸附。在柱压力为1 MPa、温度25 ℃、上样液质量浓度为0.073 mg/mL、洗脱剂乙醇体积分数为80%、流速5 mL/min条件下,经D101大孔树脂柱分离后,花色苷纯度从5.53%增加到75.58%,提高了12.67 倍。采用Sephadex LH-20中压柱层析对蓝莓花色苷进一步分离纯化,主要得到1 种花色苷组分,通过高效液相色谱和高效液相色谱-电喷雾质谱联用对蓝莓花色苷进行定性和定量分析,确定该组分为矢车菊-3-O-葡萄糖苷,纯度达到90.88%。
蓝莓;中压柱层析;花色苷;大孔树脂
蓝莓(Vaccinium corymbosum L.)为杜鹃花科越橘属小浆果,广泛分布于北美、中国东北与俄罗斯[1]。蓝莓果实营养丰富,是含有花色苷种类最多,花色苷含量最高的小浆果之一[2]。Lee等[3]从美国矮丛蓝莓中鉴定出14 种花色苷;Barnes等[4]从美国南部高丛蓝莓中鉴定出26 种花色苷;而Liu Yixiang等[5]从中国野生蓝莓中鉴定出13 种花色苷。其中,飞燕草素、矢车菊素、牵牛花素、芍药素和锦葵素与葡萄糖、半乳糖、芸香糖、阿拉伯糖等形成的糖苷物是蓝莓果实中的主要花色苷[2-5]。蓝莓花色苷具有清除自由基[3]、抗菌[1]、抗炎症[6]、预防心血管和神经退行性疾病、抑制癌细胞增殖[7]以及改善视力[8]等多种功效,正逐渐引起植物学家、医药学家的关注,成为研究热点。但是,目前有关蓝莓花色苷生物活性的研究报道多采用花色苷的混合提取物,无法对花色苷结构与活性之间的内在联系进行更深入的研究。因此,建立一种能够获得大量高纯度的单一花色苷的方法将对蓝莓花色苷的构效关系研究具有重要意义。
植物提取物中活性成分的初步富集与纯化是实现工业化生产的关键步骤。活性成分常规的分离方法一般是通过液-液萃取[9]或者制备型高效液相色谱分离[10],但是,前者分离效果较差且得到的产品质量少,而后者成本较高并难以推广[11]。大孔树脂是一类新型的非离子型高分子吸附分离介质,具有高稳定性和特殊的选择性,操作条件温和、富集效果明显、成本低廉、适合大规模工业化生产[12-13],已被广泛应用于花色苷[13]、多糖[14]、多酚[15]等活性成分的分离纯化研究中。近年来,国内外一些研究者也将大孔吸附树脂应用于蓝莓花色苷的分离纯化[16-17],但是仅靠大孔树脂分离纯化成分复杂的蓝莓花色苷,无法得到令人满意的高纯度组分,这也成为限制蓝莓花色苷广泛应用的一个亟待解决的问题。因此,本研究在系统分析了6 种大孔树脂对蓝莓花色苷分离效果的基础上,采用中压柱层析法,将D101大孔树脂与Sephadex LH-20中压柱层析联用,对蓝莓花色苷进行分离与纯化,并对得到的花色苷单体进行结构鉴定和定量分析。本研究将为工业化生产高纯度蓝莓花色苷和蓝莓花色苷构效关系研究提供理论参考。
1 材料与方法
1.1 材料与试剂
蓝莓果实采自东北农业大学园艺站,挑选出无病虫害、无机械损伤、成熟度一致的蓝莓‘美登’果实,清洗沥干后速冻,并于-20 ℃冰箱中冻藏。
矢车菊素-3-O-葡萄糖苷标准品 美国诺威公司;Sephadex LH-20 瑞典GE Healthcare Bio-Sciences AB公司;D4020、DA201、D3520、D101、HPD-100、AB-8型大孔树脂 天津市大钧科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
JY92-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;TU-1901双光束紫外-可见分光光度计、T6新悦可见分光光度计 北京普析通用仪器有限责任公司;HL-2恒流泵、BS-100A自动部分收集器上海沪西分析仪器厂有限公司;高效液相色谱(high performance liquid chromatography,HPLC)仪、HPLC-质谱(mass spectrometry,MS)联用仪 美国安捷伦公司;中压制备色层析仪 上海市同田有限公司。
1.3 方法
1.3.1 蓝莓花色苷的提取
称取一定质量蓝莓果浆,用pH 2.0、95%乙醇溶液按液料比10∶1(V/m)配制成蓝莓果浆溶液。在常温条件下,功率510 W超声30 min。然后真空抽滤(0.45 μm滤膜),滤渣在相同条件下提取2 次,合并滤液。经旋转蒸发仪浓缩(温度<50 ℃)除去乙醇,浓缩物用乙酸乙酯萃取,除去脂溶性物质,萃取后剩余物减压浓缩,得到红色黏稠的蓝莓花色苷粗提液,冻干,得到蓝莓花色苷粗提物冻干粉,备用。
1.3.2 花色苷质量浓度及纯度的测定
准确称取0.005 0 g的花色苷粉末,配制成1 g/L的花色苷溶液,采用pH值示差法测定花色苷含量[18]。按照公式(1)、(2)计算蓝莓花色苷质量浓度和纯度[19]。
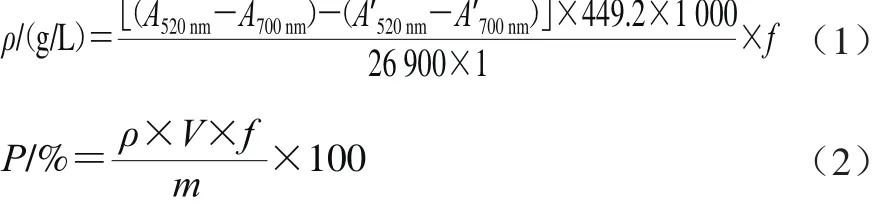
式中:ρ为花色苷质量浓度/(g/L);P为纯度/%;A为pH 1.0的样品稀释液吸光度;A’为pH 4.5的样品稀释液吸光度;f为稀释倍数;449.2为矢车菊素-3-O-葡萄糖苷的相对分子质量;V为花色苷提取液体积/L;26 900为矢车菊色素-3-O-葡萄糖苷的摩尔消光系数/(L/(mol·cm));1为比色皿光程/cm;m为花色苷的质量/g。
1.3.3 大孔树脂初步纯化蓝莓花色苷
1.3.3.1 树脂静态吸附-解吸实验
静态吸附实验如下:准确称取经过预处理[20]后的6 种大孔树脂各1.000 g(相当于干树脂0.356 4 g)置于100 mL具塞三角瓶中,精密加入蓝莓花色苷粗提液50.00 mL(终质量浓度0.054 9 mg/mL),25 ℃条件下,100 r/min振荡24 h,测定滤液中剩余花色苷质量浓度,按照公式(3)、(4)计算静态吸附量与吸附率。实验重复3次,以下实验重复次数相同。
静态解吸实验如下:向已吸附饱和的6 种树脂中分别精密加入50.00 mL 60%乙醇溶液,25 ℃条件下,100 r/min振荡解吸24 h,测定解吸液中花色苷质量浓度,按照公式(5)计算解吸率。
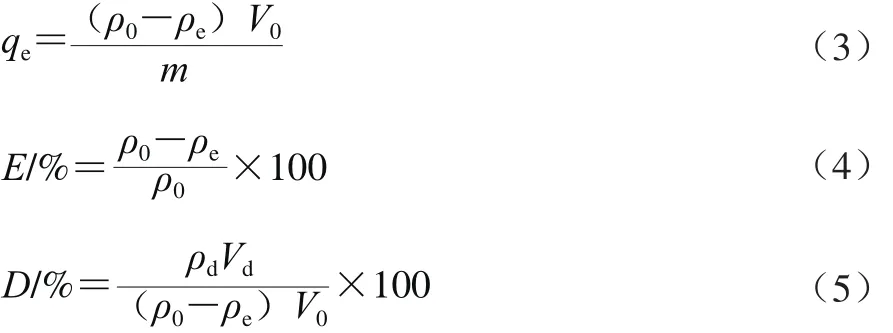
式中:qe为吸附量/(mg/g);E和D分别为吸附率/%和解吸率/%;V0为上样体积/mL;m为干树脂质量/g;ρ0为花色苷粗提液质量浓度/(mg/mL);ρe和ρd分别为吸附和解吸平衡时花色苷溶液质量浓度/(mg/mL);Vd为解吸平衡时花色苷溶液体积/mL。
根据吸附量、吸附率及解吸率,初步筛选大孔树脂。
1.3.3.2 大孔树脂静态吸附-解吸动力学测定
将初步筛选出的HPD-100、DA201、D101树脂,进行花色苷的静态吸附和解吸动力学实验,方法同1.3.3.1节。在吸附和解吸过程中,前1 h每隔20 min取0.5 mL,1 h后每隔0.5 h取0.5 mL溶液测定花色苷含量,直到平衡。分别以吸附量和解吸量为纵坐标,时间为横坐标绘制吸附和解吸动力学曲线,确定纯化花色苷的最佳大孔树脂。
1.3.3.3 吸附等温线的测定
在25、30、35 ℃的恒温水浴振荡器中,向装有1.000 g的D101大孔吸附树脂(相当于干树脂0.356 4 g)的100 mL具塞三角瓶中分别加入不同质量浓度(0.026、0.044、0.065、0.073、0.085、0.109 mg/mL)的花色苷提取液50.00 mL,100 r/min振荡吸附4.5 h,测定滤液中剩余花色苷质量浓度,计算吸附量,考察它们与Langmuir方程(公式(6))和Freundlich方程(公式(7))的符合情况。Langmuir和Freundlich方程经常被用来描述吸附剂与溶质之间的吸附行为。

式中:qe为吸附量/(mg/g);ρe为吸附平衡时花色苷质量浓度/(mg/mL);qm为最大吸附量/(mg/g);aL为吸附和解吸速率常数之比;KF为Freundlich常数,用于衡量吸附量大小;1/n为吸附动力学经验常数。
1.3.3.4 中压-D101树脂柱对蓝莓花色苷的分离纯化
将经过预处理的D 1 0 1大孔树脂置于中压柱(32 mm×150 mm)内,柱体积120.5 mL,花色苷溶液质量浓度为0.073 mg/mL,上样量为10 mL,分别选用不同体积分数(20%、40%、60%、80%)乙醇溶液和不同流速(3、5、7、9 mL/min)进行洗脱,柱压为1.0 MPa,收集洗脱液,测定花色苷含量,计算回收率,确定最佳洗脱剂体积分数和最佳洗脱剂流速。
1.3.4 中压Sephadex LH-20柱层析对蓝莓花色苷的分离纯化
将D101大孔树脂纯化后的花色苷溶液进一步采用Sephadex LH-20中压柱层析(29 mm×250 mm)分离,柱体积165.0 mL,柱压为1.0 MPa,花色苷溶液质量浓度为1.0 mg/mL,上样量为10 mL,然后用体积分数为20%、35%、50%的甲醇梯度洗脱,流速1.0 mL/min,每3 mL收集一管,合并相同组分,浓缩和冻干后,得到蓝莓花色苷主要组分Ⅰ。利用HPLC对蓝莓花色苷组分Ⅰ进行定性和定量分析。
1.3.5 蓝莓花色苷HPLC法定性和定量分析
HPLC条件:1100 C18柱(4.6 mm×150 mm,5 μm);检测器:G1314A紫外检测器;检测波长:520 nm;柱温:室温;流动相:甲醇-0.1%甲酸水溶液(30∶70,V/V);流速:1.0 mL/min。
标准曲线的绘制:用质量分数1%的盐酸溶液,配制成1 mg/mL的矢车菊素-3-O-葡萄糖苷标准品溶液,过0.45 µm微孔滤膜,分别进样0.1、0.3、0.5、0.7、1.0 µL,以进样质量浓度为横坐标,峰面积为纵坐标来绘制标准曲线,得到线性回归方程。
样品分析:用1%盐酸溶液,配制成0.1 mg/mL的样品溶液,过0.45 µm微孔滤膜,进样量5 µL,测定花色苷组分Ⅰ含量,计算纯度。
1.3.6 蓝莓花色苷组分Ⅰ的结构测定
HPLC- MS法对蓝莓花色苷组分Ⅰ的结构进行鉴定。
HPLC条件:流动相:3%甲酸水溶液-水-甲醇(3∶47∶50,V/V)梯度洗脱;流速:0.8 mL/min;检测波长:520 nm;进样量:5 µL。MS条件:电喷雾离子源;正离子扫描模式;扫描范围m/z 200~1 000;干燥气温度350 ℃;雾化气为氮气,流速10 L/min;检测电压为3.5 kV;毛细管电压3 500 V;毛细管温度250 ℃。
1.4 数据统计分析
数据采用SPSS 19.0软件处理,均以 ±s表示,利用方差分析(analysis of variance,ANOVA)进行显著性分析,其中P<0.05表示差异显著。
2 结果与分析
2.1 大孔树脂对花色苷的初步纯化结果
2.1.1 大孔树脂初步筛选
不同类型的大孔树脂对蓝莓花色苷静态吸附及解吸能力的比较见表1。HPD-100和D101树脂对于花色苷的吸附率及吸附量均高于其他4 种树脂。一方面是由于HPD-100和D101是非极性树脂,与弱极性的花色苷化学性质相似,因此更易与花色苷结合[21]。另一方面可能是由于树脂比表面积增加,表面张力随之增加,有利于树脂对花色苷的吸附[22]。此外,DA201大孔树脂的解吸率最高(74.99%),而吸附花色苷能力最强的HPD-100树脂的解吸率为71.76%,这是由于吸附能力强的树脂在一定条件下,洗脱较为困难,使解吸能力下降。研究表明树脂平均孔径的大小也会对洗脱产生影响,大孔径的树脂有利于溶质通过树脂颗粒[23],这也可能是DA201解吸率较大的原因。综合考虑吸附和解吸两个因素,初步筛选出吸附量大、解吸率高的HPD-100、D101和DA201 3 种大孔树脂进行下一步研究。

表1 大孔树脂静态吸附及解吸能力的比较Table 1 Comparison of adsorption and desorption properties of macroporous resins
2.1.2 大孔树脂静态吸附-解吸动力学
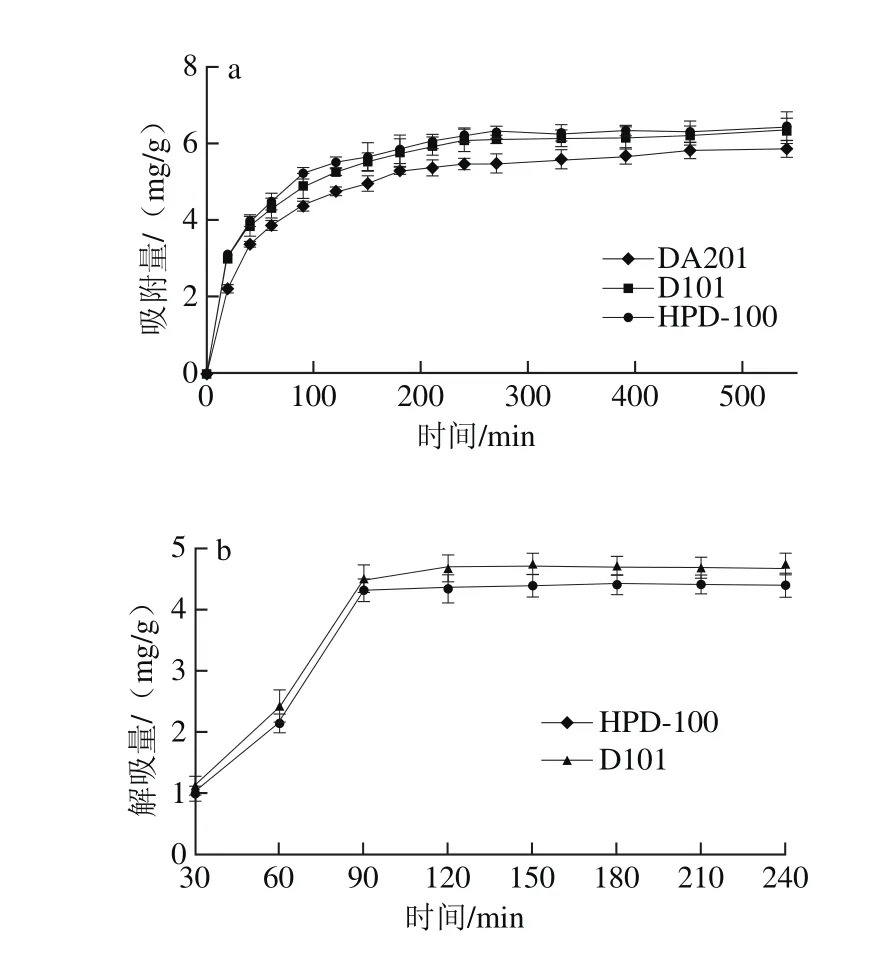
图1 大孔吸附树脂静态吸附(a)和解吸(b)动力学曲线Fig. 1 Adsorption kinetics curves (a) and desorption kinetics curves (b)of macroporous resins
HPD-100、D101、DA201 3 种大孔树脂对蓝莓花色苷的静态吸附与解吸动力学测定结果见图1。3 种树脂对蓝莓花色苷的吸附行为均为快速平衡型。在0~50 min时间范围内,3 种树脂对蓝莓花色苷的吸附量增加较为迅速。随着时间的延长,树脂对花色苷的吸附逐渐达到饱和,在270 min达到平衡,此时HPD-100、D101与DA201树脂对花色苷的吸附量分别为6.203、6.084 mg/g和5.461 mg/g。选择吸附量较大的HPD-100和D101进行静态解吸动力学研究。
由图1b可以看出,在0~90 min阶段,HPD-100和D101树脂解吸均较为迅速,90 min之后解吸逐渐达到平衡。HPD-100与D101吸附树脂分别在150 min和120 min达到解吸平衡,此时的解吸量分别为4.406 mg/g和4.686 mg/g。由于D101树脂解吸平衡时间较短且最大解吸量相对较大,因此确定D101大孔树脂为纯化蓝莓花色苷的最佳树脂。
2.1.3 D101大孔树脂吸附等温线
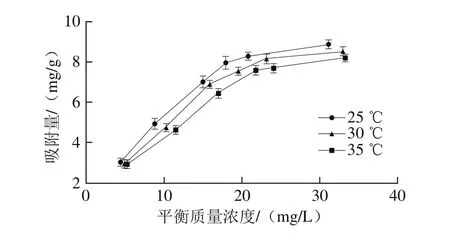
图2 D101树脂在不同温度下的吸附等温线Fig. 2 Adsorption isotherms of D101 resin at different temperatures
不同温度下D101大孔树脂对蓝莓花色苷的吸附等温线如图2所示。结果表明,D101树脂对于蓝莓花色苷的吸附能力随花色苷起始质量浓度的增加而增大,并在花色苷的起始质量浓度为0.073 mg/mL时基本达到饱和。这一结果为后续中压柱层析分离纯化花色苷粗提物提供合适的上样质量浓度。此外,由图2可以看出,在任何平衡质量浓度下,D101大孔树脂对花色苷的吸附量均随着温度的升高而逐渐减小,这可能是由于大孔树脂吸附主要是物理吸附,且吸附过程是一个放热过程,所以较高的温度会抑制花色苷与树脂表面活性位点的结合[24]。因此,确定D101大孔树脂对花色苷的最佳吸附温度为25 ℃。

表2 Langmuir方程和Freundlich方程回归参数Table 2 Regression parameters of Langmuir and Freundlich isothermal equations
Langmuir方程和Freundlich方程常被用于揭示树脂的线性拟合,以及描述树脂之间如何相互作用。Langmuir方程曲线通常描述单分子层吸附,相邻吸附分子之间均匀分布且无相互作用,而Freundlich方程曲线为经验公式,通常被用于描述在一定溶质浓度范围内的多分子层吸附[25]。Langmuir和Freundlich方程参数列于表2。Langmuir方程和Freundlich方程的决定系数(R2)均较高,其中Langmuir方程的R2小于Freundlich的,证明该吸附过程为多分子层吸附。并且25 ℃时Freundlich方程中的1/n值小于1,表明D101树脂与蓝莓花色苷之间容易发生吸附[26]。
2.1.4 动态解吸洗脱剂体积分数和洗脱流速的选择

图3 乙醇体积分数(a)和洗脱流速(b)对花色苷回收率的影响Fig. 3 Effect of ethanol concentration (a) and elution fl ow rate (b) on the recovery rate of anthocyanins
不同体积分数的乙醇及洗脱流速对蓝莓花色苷回收率的影响见图3。随着乙醇体积分数的增大,花色苷回收率也随之增加,当乙醇体积分数达到80%时,花色苷回收率达到95.91%。考虑到若继续增大乙醇体积分数,过多的杂质可能会溶出,影响花色苷的纯度,所以本实验选择体积分数80%乙醇作为洗脱剂。由图3b可以看出,随着洗脱剂洗脱流速的增加,花色苷回收率明显降低,可能是流速过快,洗脱剂不能与被吸附的花色苷充分作用而将其从树脂上洗脱下来。当洗脱流速分别为3 mL/min和5 mL/min时,花色苷的回收率相差不大,综合考虑纯化效率及生产效率,本实验选择5 mL/min为洗脱流速,此时蓝莓花色苷的回收率达到95.91%。
2.2 花色苷组分及含量
经D101大孔树脂在最佳条件下分离纯化后,蓝莓花色苷纯度从5.53%增加到75.58%,提高了12.67倍,样品进一步经Sephadex LH-20中压柱层析纯化后得到蓝莓花色苷的主要组分Ⅰ。矢车菊-3-O-葡萄糖苷标准品与组分Ⅰ的HPLC谱图见图4。

图4 矢车菊-3-O-葡萄糖苷标准品(a)和花色苷组分Ⅰ(b)的HPLC谱图Fig. 4 HPLC chromatograms of standard cyanidin-3-O-glucoside (a)and anthocyanin fraction Ⅰ (b)
由图4可以看出,蓝莓花色苷组分Ⅰ的保留时间为10.392 min,矢车菊-3-O-葡萄糖苷标准品保留时间为10.074 min,标准品与样品保留时间近似,所以初步判定组分Ⅰ为矢车菊-3-O-葡萄糖苷。利用HPLC分析,得到标准品矢车菊-3-O-葡萄糖苷标准曲线回归方程:Y=3 794.1X+0.579 2(R2=0.999 3),线性范围为0.1~1.0 µg,根据回归方程计算得到Sephadex LH-20纯化后得到的花色苷组分Ⅰ的纯度为90.88%。
2.3 花色苷的结构
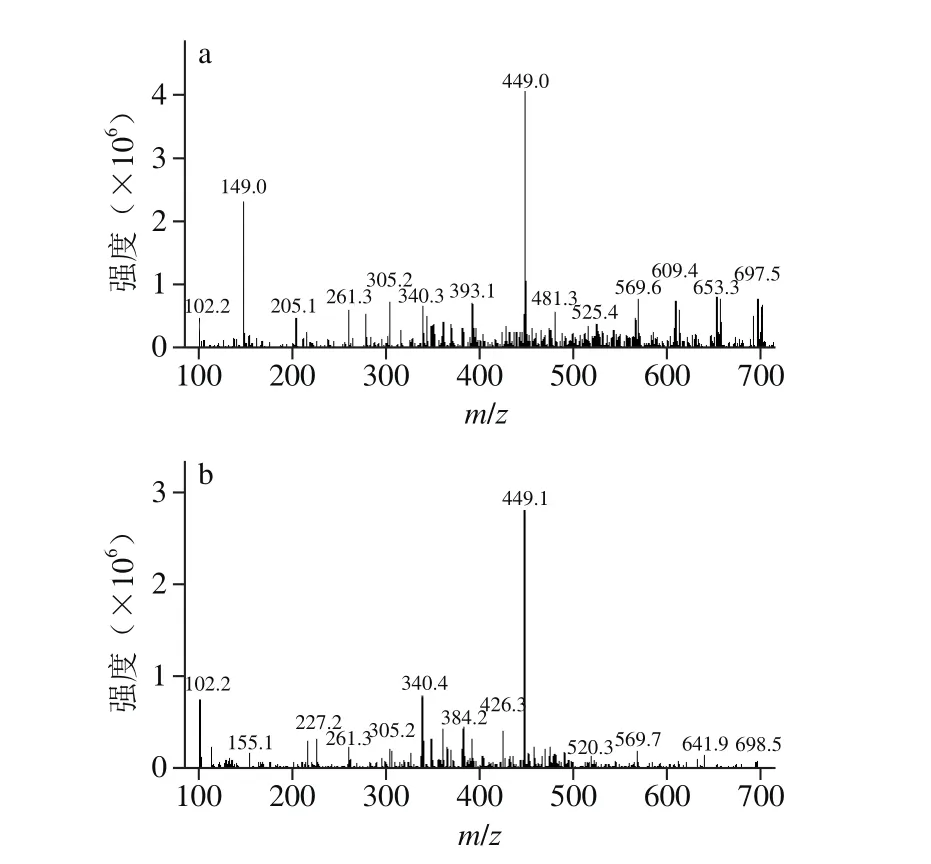
图5 矢车菊-3-O-葡萄糖苷标准品(a)和花色苷组分Ⅰ(b)的MS谱图Fig. 5 Mass spectra of standard cyanidin-3-O-glucoside (a) and anthocyanin fraction I (b)
矢车菊-3-O-葡萄糖苷标准品与花色苷组分Ⅰ的质谱图见图5。在正离子模式下,花色苷组分Ⅰ的分子离子峰为449.1与矢车菊-3-O-葡萄糖苷标准品分子离子峰449.0一致,并且样品与标准品中分别含有离子碎片m/z 340.4和m/z 340.3,是由矢车菊-3-O-葡萄糖苷(m/z 449.0)失去一分子邻苯二酚(Δ m/z 109)所形成的。参考相关文献[27-29]中的数据资料,并结合HPLC的保留时间结果可以推断,蓝莓花色苷组分Ⅰ是矢车菊-3-O-葡萄糖苷,其结构如图6所示。
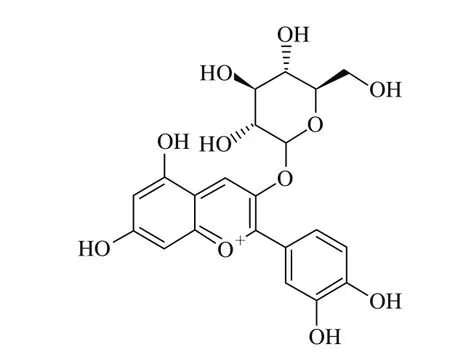
图6 矢车菊-3-O-葡萄糖苷结构Fig. 6 Chemical structure of cyanidin-3-O-glucoside
3 结 论
研究表明D101大孔树脂是最适于分离纯化蓝莓花色苷的树脂。不同温度下,花色苷在D101树脂上的吸附行为均可以用Langmuir和Freundlich方程很好地拟合,并且D101树脂在25 ℃时对花色苷的分离纯化效果最好。大孔树脂中压柱层析法最佳工艺条件为:25 ℃、上样液质量浓度0.073 mg/mL、洗脱剂为80%乙醇、流速5 mL/min。蓝莓花色苷粗提物经大孔树脂与Sephadex LH-20中压柱层析联用分离纯化后,得到矢车菊-3-O-葡萄糖苷,纯度为90.88%。因此,中压柱层析联用可以有效分离纯化蓝莓花色苷,本研究结果可以为蓝莓及其他小浆果花色苷工业化生产提供理论依据。
[1] PERTUZATTI P B, BARCIA M T, REBELLO L P G, et al.Antimicrobial activity and differentiation of anthocyanin profiles of rabbiteye and highbush blueberries using HPLC-DAD-ESI-MSnand multivariate analysis[J]. Journal of Functional Foods, 2016, 26:506-516. DOI:10.1016/j.jff.2016.07.026.
[2] ZHAO L Y, CHEN J, WANG Z Q, et al. Direct acylation of cyanidin-3-glucoside with lauric acidin blueberry and its stability analysis[J].International Journal of Food Properties, 2016, 19(1): 1-12. DOI:10.10 80/10942912.2015.1016577.
[3] LEE S G, VANCE T M, NAM T G, et al. Contribution of anthocyanin composition to total antioxidant capacity of berries[J]. Plant Foods for Human Nutrition, 2015, 70: 427-432. DOI:10.1007/s11130-015-0514-5.
[4] BARNES J S, NGUYEN H P, SHEN S, et al. General method for extraction of blueberry anthocyanins and identification using high performance liquid chromatography-electrospray ionization-ion traptime of flight-mass spectrometry[J]. Journal of Chromatography A,2009, 1216(23): 4728-4735. DOI:10.1016/j.chroma.2009.04.032.
[5] LIU Yixiang, SONG Xue, HAN Yong, et al. Identification of anthocyanin components of wild Chinese blueberries and amelioration of light-induced retinal damage in pigmented rabbit using whole berries[J]. Journal of Agricultural and Food Chemistry, 2011, 59(1):356-363. DOI:10.1021/jf103852s.
[6] FU Y, ZHOU X Z, CHEN S G, et al. Chemical composition and antioxidant activity of Chinese wild raspberry (Rubus hirsutus Thunb.)[J].LWT-Food Science and Technology, 2015, 60: 1262-1268.DOI:10.1016/j.lwt.2014.09.002.
[7] HE B, ZHANG L L, YUE X Y, et al. Optimization of ultrasoundassisted extraction of phenolic compounds and anthocyanins from blueberry (Vaccinium ashei) wine pomace[J]. Food Chemistry, 2016,204: 70-76. DOI:10.1016/j.foodchem.2016.02.094.
[8] MAGDALENA Z, ANNA M. Microwave-assisted drying of blueberry(Vaccinium corymbosum L.) fruits: drying kinetics, polyphenols,anthocyanins, antioxidant capacity, colour and texture[J]. Food Chemistry, 2016, 212: 671-680. DOI:10.1016/j.foofchem.2016.06.003.
[9] BYAMUKAMA R, KIREMIRE B T, ANDERSEN O M, et al.Anthocyanins from fruits of Rubus pinnatus and Rubusrigidus[J].Journal of Food Composition and Analysis, 2005, 18(6): 599-605.DOI:10.1016/j.jfca.2004.04.007.
[10] ANOCOS B, GONZALEZ E, CANO M P. Differentiation of raspberry varieties according to anthocyanin composition[J]. Zeitschrift für Lebensmittel-Untersuchung und-Forschung, 1999, 208(1): 33-38.
[11] CAO S Q, PAN S Y, YAO X L, et al. Isolation and purification of anthocyanins from blood oranges by columnchromatography[J].Agricultural Sciences in China, 2010, 9(2): 207-215. DOI:10.1016/S1671-2927(09)60085-7.
[12] CHEN Y, ZHANG W J, ZHAO T, et al. Absorption properties of macroporous absorbent resins for separation of anthocyanins from mulberry[J]. Food Chemistry, 2016, 194: 712-722. DOI:10.1016/j.foodchem.2015.08.084.
[13] YANG Y, YUAN X H, XU Y Q, et al. Purif i cation of anthocyanins from extracts of red raspberry using macroporous resin[J].International Journal of Food Properties, 2015, 18(5): 1046-1058.DOI:10.1080/10942912.2013.862632.
[14] XU Y Q, LIU G J, YU Z Y, et al. Purification, characterization and antiglycation activity of a novel polysaccharide from black currant[J]. Food Chemistry, 2016, 199: 694-701. DOI:10.1016/j.foodchem.2015.12.078.
[15] XI L S, MU T H, SUN H N. Preparative purif i cation of polyphenols from sweet potato (Ipomoea batatas L.) leaves by AB-8 macroporous resins[J]. Food Chemistry, 2015, 172: 166-174. DOI:10.1016/j.foodchem.2014.09.039.
[16] ZHENG X Z, ZHANG Z G, JIN C J, et al. Purification characteristics and parameters optimization of anthocyanin extracted from blueberry[J]. International Journal of Agricultural and Biological Engineering, 2015, 8(2): 135-144. DOI:10.3965/j.ijabe.20150802.1407.
[17] 郑红岩, 于华忠, 刘建兰, 等. 大孔吸附树脂对蓝莓花色苷的分离工艺[J]. 林产化学与工业, 2014, 34(4): 59-65. DOI:10.3969/j.issn.0253-2417.2014.04.010.
[18] FIGUEIREDO P, ELHABIRI M, SAITO N, et al. Anthocyanin intramolecular interactions. a new mathematical approach to account for the remarkable colorant properties of the pigments extracted from Matthiola incana[J]. Journal of the American Chemical Society, 1996,118(20): 4788-4793.
[19] 赵晟锌, 徐雅琴, 李兴国. 大孔吸附树脂纯化黑穗醋栗花色苷研究[J].东北农业大学学报, 2010, 41(8): 115-120.
[20] CHEN Y Y, ZHANG D J. Adsorption kinetics, isotherm and thermodynamics studies of flavones from Vaccinium Bracteatum Thunb leaves on NKA-2 resin[J]. Chemical Engineering Journal, 2014,254: 579-585. DOI:10.1016/j.cej.2014.05.120.
[21] ZHAO Z Y, DONG L L, WU Y L, et al. Preliminary separation and purification of rutin and quercetin from Euonymus alatus (Thunb.)Siebold extracts by macroporous resins[J]. Food and Bioproducts Processing, 2011, 89(4): 266-272. DOI:10.1016/j.fbp.2010.11.001.
[22] 杨昱, 徐雅琴, 于泽源. 树莓叶片黄酮成分分离纯化研究[J]. 高校化学工程学报, 2011, 25(6): 948-954.
[23] TIOMTHY J B, AMANDEEP K S, LI Z, et al. Adsorption/desorption characteristics and separation of anthocyanins and polyphenols from blueberries using macroporous adsorbent resins[J].Journal of Food Engineering, 2014, 128: 167-173. DOI:10.1016/j.foodeng.2013.12.029.
[24] WU Y F, ZHANG L, MAO J W, et al. Kinetic and thermodynamic studies of sulforaphane adsorption on macroporous resin[J].Journal of Chromatography B, 2016, 1028: 231-236. DOI:10.1016/j.jchromb.2016.06.035.
[25] YANG C J, LI D X, WAN C X. Combination of HSCCC and Sephadex LH-20 methods an approach to isolation and purif i cation of the main individual theaf l avins from black tea[J]. Journal of Chromatography B,2008, 861: 140-144. DOI:10.1016/j.jchromb.2007.11.022.
[26] YANG Q Y, ZHAO M M, LIN L Z. Adsorption and desorption characteristics of adlay bran free phenolics on macroporous resins[J]. Food Chemistry, 2016, 194: 900-907. DOI:10.1016/j.foodchem.2015.08.070.
[27] BOCHI V C, GODOY H T, GIUSTI M M. Anthocyanin and other phenolic compounds in Ceylon gooseberry (Dovyalis hebecarpa)fruits[J]. Food Chemistry, 2015, 176: 234-243. DOI:10.1016/j.foodchem.2014.12.041.
[28] 胡济美, 籍保平, 周峰, 等. 大兴安岭笃斯越橘花色苷成分鉴定研究[J].食品科学, 2009, 30(10): 239-241.
[29] LI D N, MENG X J, LI B. Prof i ling of anthocyanins from blueberries produced in China using HPLC-DAD-MS and exploratory analysis by principal component analysis[J]. Journal of Food Composition and Analysis, 2016, 47: 1-7. DOI:10.1016/j.jfca.2015.09.005.
Isolation and Purif i cation of Anthocyanin from Blueberry by Sequential Medium Pressure Column Chromatography on Macroporous Resin and Sephadex LH-20
YU Zeyuan1, ZHAO Jianhui1, LI Xingguo1, XU Yaqin2, TANG Xue1, YANG Yu2,*
(1. College of Horticulture and Landscape Architecture, Northeast Agricultural University, Harbin 150030, China;2. College of Science, Northeast Agricultural University, Harbin 150030, China)
In this study, the anthocyanins of blueberry were isolated and purif i ed by sequential medium pressure column chromatography using macroporous resin and Sephadex LH-20. The static adsorption and desorption of blueberry anthocyanins on six different types of resins was compared, and the separation process of anthocyanins by macroporous resin adsorption chromatography was optimized. The results showed that D101 resin gave the best separation eff i ciency and its adsorption behavior obeyed a multi-molecular layer adsorption. Under the following conditions: column pressure 1 MPa,temperature 25 ℃, anthocyanins concentration 0.073 mg/mL, and elution with 80% ethanol at a fl ow rate of 5 mL/min,the purity of anthocyanins increased by 13.67 folds from 5.53% to 75.58%. A purif i ed anthocyanin fraction was obtained by subsequent Sephadex LH-20 column chromatography, which was identified as cyanidin-3-O-glucoside using highperformance liquid chromatography-electrospray ionization mass spectrometry (HPLC-ESI-MS) with a purity of 90.88%.
blueberry; medium pressure column chromatography; anthocyanins; macroporous resin
10.7506/spkx1002-6630-201801018
TS201.1
A
1002-6630(2018)01-0118-06
于泽源, 赵剑辉, 李兴国, 等. 大孔树脂-中压柱层析联用分离纯化蓝莓花色苷[J]. 食品科学, 2018, 39(1): 118-123.
DOI:10.7506/spkx1002-6630-201801018. http://www.spkx.net.cn
YU Zeyuan, ZHAO Jianhui, LI Xingguo, et al. Isolation and purification of anthocyanin from blueberry by sequential medium pressure column chromatography on macroporous resin and sephadex LH-20[J]. Food Science, 2018, 39(1):118-123. (in Chinese with English abstract)
10.7506/spkx1002-6630-201801018. http://www.spkx.net.cn
2016-10-11
黑龙江省自然科学基金面上项目(C2016015)
于泽源(1961—),男,教授,博士,研究方向为天然产物提取及活性。E-mail:yzy@neau.edu.cn
*通信作者简介:杨昱(1977—),女,副教授,博士,研究方向为天然产物提取及活性。E-mail:yangyu_002@163.com

