SBBR工艺反硝化过程中N2O和NO的产生情况
梁 雪,赵剑强,高 坤,葛光环,赵日祥
(长安大学 环境科学与工程学院,陕西 西安 710054)
N2O作为不容忽视的温室气体,其增温作用约为CO2的300倍。有报道称,污水处理过程中产生的N2O占N2O总释放量的2.5%~25.0%[1]。而反硝化过程是N2O产生的重要阶段[2],故研究反硝化中N2O的产生及影响因素,对了解生物脱氮过程中温室气体的排放有重要意义。
反硝化过程中不同碳氮比(COD与TN之比)和不同电子受体对条件下N2O产生情况的研究已有很多报道。如:Chung等[3]研究发现,在反硝化过程中碳氮比低于2时的N2O产生量是碳氮比大于4时的100倍以上;Zhao等[4]发现,以为电子受体时的反硝化速率和N2O释放量均高于以为电子受体时;Zeng等[5]发现,以为电子受体时N2O产生量是为电子受体时的5倍以上。聚羟基脂肪酸酯(PHA)是微生物在失衡的生长环境下,将乙酸、葡萄糖等小分子有机物转化并储存于细胞内的一种高分子聚合物[6-7],聚羟基丁酸酯(PHB)是PHA的重要组分。在外碳源不足时,PHA可作为内碳源被微生物分解利用,维持反硝化的进行[8]。Wu等[9]实验发现,以PHB为电子供体时,N2O的排放量显著增加。Beun等[10]指出,PHB作为电子供体时,由于PHB降解缓慢,导致N2O的排放量达到了一个非常高的水平。
本工作控制COD为500 mg/L,探究了不同碳氮比、不同电子受体和供体(COD和PHA)对序批式生物膜反应器(SBBR)反硝化过程中N2O产生情况的影响,同时考察了NO的产生情况,以期深入了解反硝化过程的机理。
1 实验部分
1.1 实验装置
实验装置示意见图1。反应器为有效容积13 L的圆柱形SBBR,以塑料纤维(由江苏鹏锦环保设备有限公司生产,便于生物附着生长)为填料,填充比(塑料纤维与反应器的体积比)为12%。反应器采用水浴加热,日常运行和反硝化实验温度均控制在(30±1)℃。
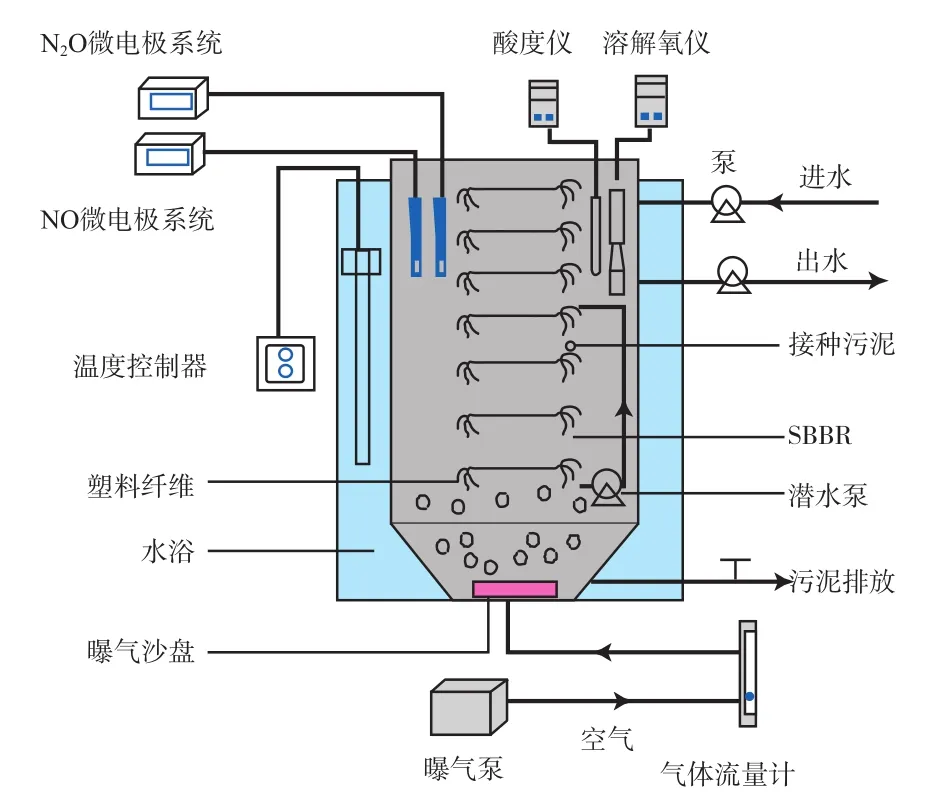
图1 实验装置示意
反应器接种污泥取自陕西省西安市长安区污水处理厂卡鲁塞尔氧化沟。
1.2 日常运行
SBBR日常运行为A/O/A(厌氧/好氧/缺氧)模式,每12 h为1周期,每个周期包括进水及静置(60 min)、曝气(240 min)、缺氧(390 min)、排水及静置(30 min)4个阶段。运行过程中(除进水及静置、排水及静置阶段),反应器底部安装的潜水泵起搅拌作用,曝气采用曝气泵和曝气砂盘,利用气体流量计调节曝气量在20 L/h左右。
日常运行进水为人工配水,配方为(mg/L):COD(葡萄糖)200,NH4HCO350,KH2PO410,CaCl216,NaHCO3150,MgSO4·7H2O 50,微量元素溶液1 mL/L[11],pH为7.2~8.5。
1.3 反硝化实验
反硝化实验中,氮源的投加方式分为两种:碳源(葡萄糖)和氮源同时投加(以下简称同步投加)以及投加碳源60 min后再投加氮源(以下简称异步投加)。异步投加的目的是,利用“饥饿-饱食”运行过程中微生物对外源有机物(葡萄糖)在厌氧段贮存为PHA的功能,改变反硝化过程电子供体的类型。
当稳定运行在A/O/A模式下的反应器完成一个周期的运行后,将其运行方式根据实验设计要求改为缺氧运行(同步投加)或厌氧60 min后缺氧运行(异步投加),进行不同碳氮比、不同电子供体和受体的反硝化实验。每次改变运行模式时先用蒸馏水置换反应器内溶液3次,避免上一周期剩余的-N对N2O的产生造成影响。
1.4 分析方法
参照《水和废水监测分析方法》[12]测定水样的COD、TN、-N和-N含量;采用成都世纪方舟科技有限公司PHS10型便携式智能酸度计测定pH;采用美国哈希公司Hach-HQ30d型溶解氧仪测定DO;采用丹麦Unisense公司微电极系统在线测定溶解态NO和N2O;利用物质守恒原理,依据在线测得的溶解态N2O计算N2O-N生成率(N2O-N生成率是指反硝化过程中N2O-N产量与的-N去除量的比值)及N2O-N释放量[13](N2O-N释放量是指反硝化过程中产生的N2O-N溢出反应器而释放到大气中的量)。
2 结果与讨论
2.1 碳氮比对N2O产生情况的影响
不同条件下的反硝化实验结果见表1。由表1可见,不论是投加亚硝态氮还是硝态氮,在实验研究的碳氮比范围内,N2O-N生成率均表现出随碳氮比增大而下降的现象。这是由于硝态氮还原为氮气的4个反应过程中,各还原酶对底物或电子的竞争能力不同,而N2O还原酶竞争能力最弱[14]。因此,不论是利用外源碳(COD)还是内源碳(PHA),本实验在不同电子受体反硝化过程中均表现出了N2O-N生成率随着碳氮比增大而下降的现象。
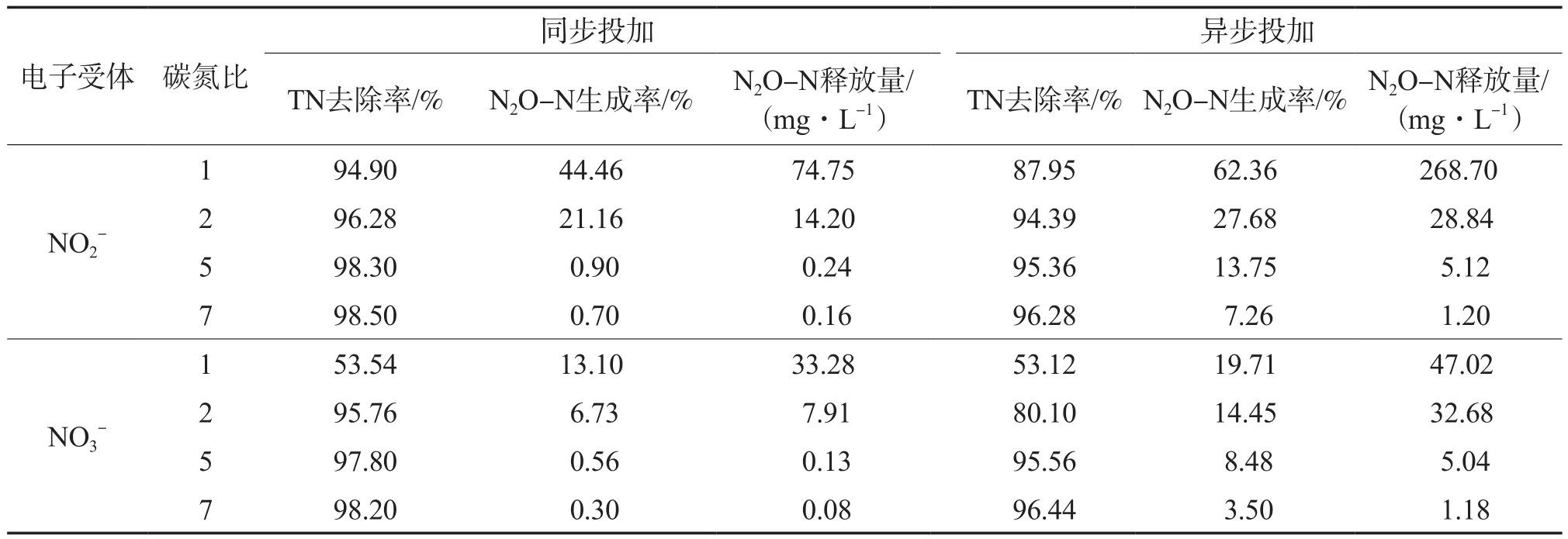
表1 不同条件下的反硝化实验结果
2.2 电子受体对N2O产生情况的影响
由表1可知,不论是同步投加还是异步投加,在相同实验条件下,投加时的N2O-N生成率均高于投加时,平均高出约0.6~2.4倍。该实验结果表明,更容易导致N2O的产生。因为投加时,反应器中的浓度是一个缓慢增大的过程;而投加时,它在反应器中的浓度瞬间增大且一般都会大于投加的情况。对还原到N2的4个阶段均有抑制作用,且对N2O还原酶的抑制作用尤其强烈。所以,反应器中浓度高时,N2O还原被抑制从而使其积累。
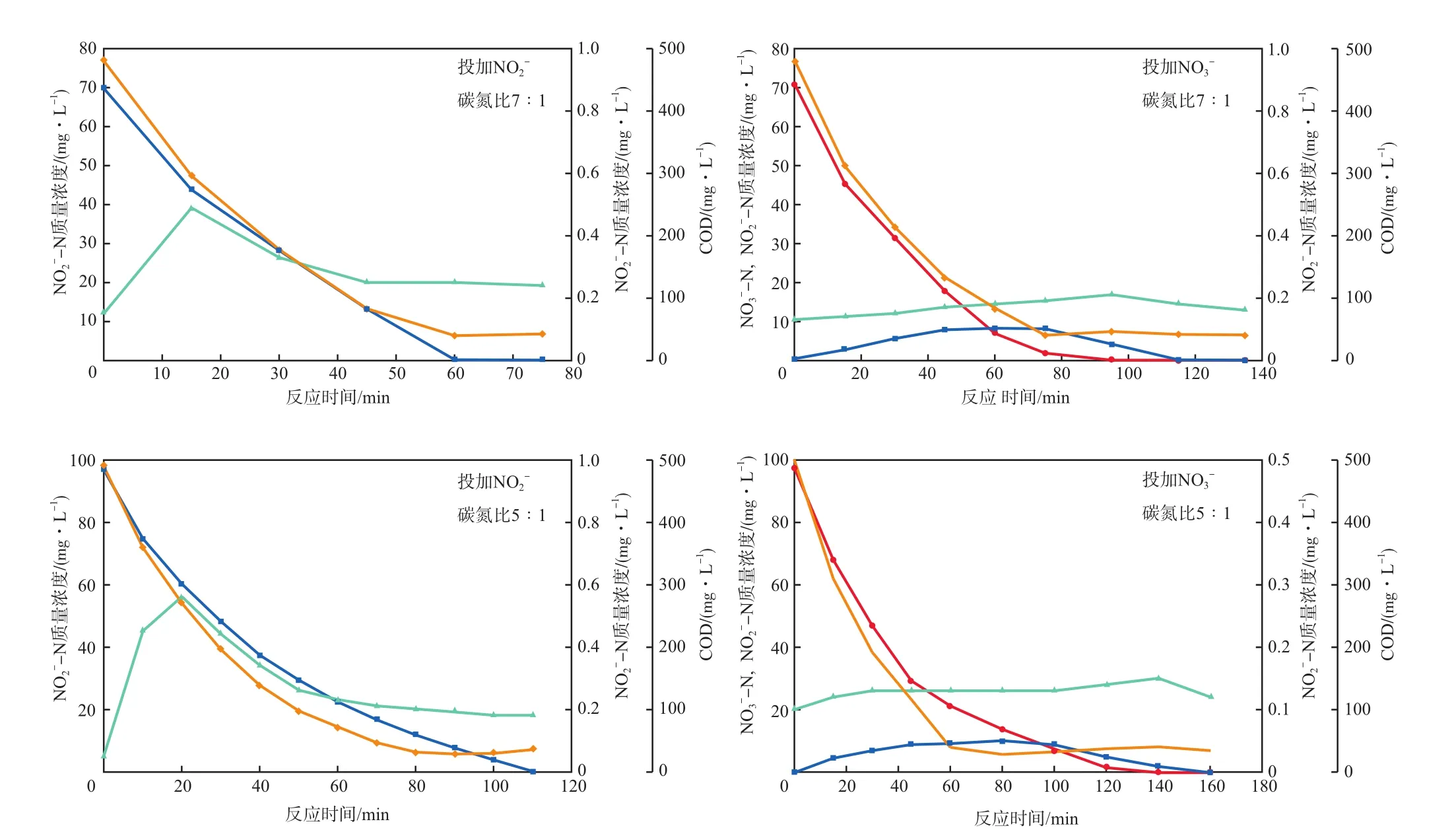
图2 同步投加时-N、-N和N2O-N的变化情况

图3 异步投加时-N、-N和N2O-N的变化情况
图3中,异步投加碳氮比为1∶1时,两种电子受体反硝化过程中产生的N2O-N都持续积累且没有下降趋势,反应经过1800 min时,以为电子受体时有59.04 mg/L的NO2-N剩余,N2O-N积累量为268.70 mg/L;反应经过1596 min时,以为电子受体时有26.64 mg/L的-N积累,此时N2O-N积累量为47.02 mg/L。同步投加时实验结果类似。由于碳源不足,反硝化过程中N2O还原酶竞争不到充足的电子供体[17],且高浓度的会对N2O还原酶有强烈的抑制作用,使同步反硝化过程中的最后一步,即N2O的还原速率降低或停止,导致N2O持续积累。
对于N2O-N的积累也有学者认为是N2O还原酶对电子的亲和能力差[16],在电子供体缺乏时N2O还原酶的活性受到了抑制。Ma等[18]认为反硝化过程中会产生一定量的游离亚硝酸(FNA),而FNA会抑制反硝化菌的活性,同时也会抑制N2O的还原[19]。此外,Dong等[20]认为高浓度的有利于以N2O为最终代谢产物的反硝化菌的生长,从而使N2O积累量增加。而在的反硝化过程中,由于还原为比还原为N2所需能量少[21],所以在能量缺乏时,的还原过程受阻,而的积累又对N2O还原酶有毒害作用,导致N2O不能及时还原[22]。
2.3 电子供体对N2O产生情况的影响
2.4 NO的产生和变化情况
碳氮比为2∶1时,反硝化过程中NO-N的变化情况见图4。由图4可见:以为电子受体,同步投加时NO-N最大积累量为1.03 mg/L,异步投加时为1.67 mg/L;以为电子受体,同步投加时NO-N最大积累量为0.18 mg/L,异步投加时几乎没有NO产生。由此可见:为电子受体时的NO产生量明显比为电子受体时多,表明高浓度的促进了NO的产生[23];且以为电子受体时,异步投加过程中NO产生量高于同步投加过程。在碳氮比为2时,以为电子受体的异步投加过程中NO-N的生成率最高,为0.70%。
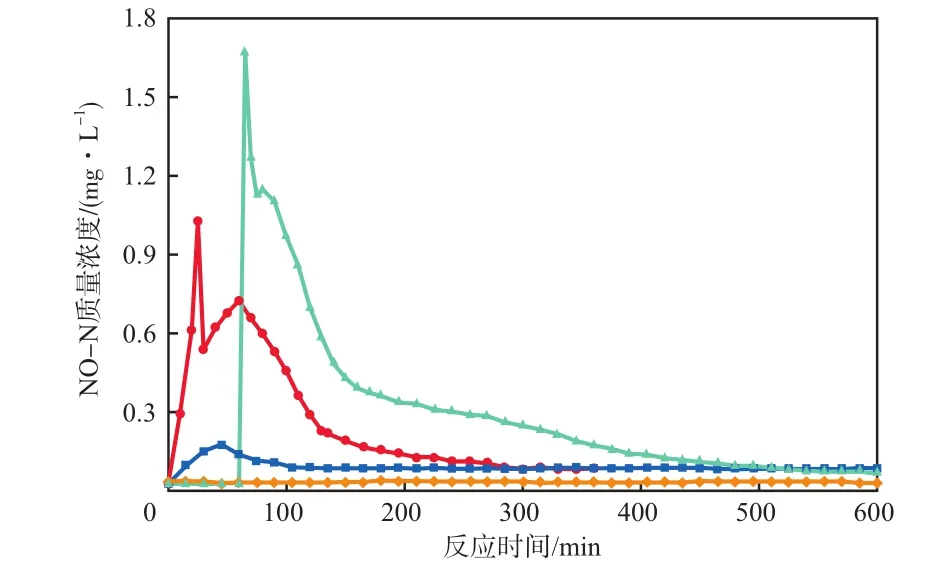
图4 反硝化过程中NO-N的变化情况
3 结论
[1] Khalil M A K,Rasmussen R A. The global sources of nitrous oxide[J]. J Geophys Res:Atmos,1992,97(D13):14651 - 14660.
[2] Meyer R L,Zeng R J,Giugliano V,et al. Challenges for simultaneous nitrification,denitrification,and phosphorus removal in microbial aggregates:Mass transfer limitation and nitrous oxide production[J].FEMS Microbiol Ecol,2005,52(3):329 - 338.
[3] Chung Y C,Chung M S. BNP test to evaluate the influence of C/N ratio on N2O production in biological denitrification[J]. Water Sci Technol,2000,42(3/4):23 - 27.
[4] Zhao Wei,Wang Yayi,Liu Shanhu,et al. Denitrification activities and N2O production under salt stress with varying COD/N ratios and terminal electron acceptors[J]. Chem Eng J,2013,215/216:252 - 260.
[5] Zeng R J,Lemaire R,Yuan Zhiguo,et al. Simultaneous nitrification,denitrification,and phosphorus removal in a lab-scale sequencing batch reactor[J].Biotechnol Bioeng,2003,84(2):170 - 178.
[6] Beccari M,Dionisi D,Giuliani A,et al. Effect of different carbon sources on aerobic storage by activated sludge[J]. Water Sci Technol,2002,45(6):157 - 168.
[7] Pijuan M,Casas C,Baeza J A. Polyhydroxyalkanoate synthesis using different carbon sources by two enhanced biological phosphorus removal microbial communities[J]. Process Biochem,2009,44(1):97 -105.
[8] Qin Lei,Liu Yu,Tay Joo-Hwa. Denitrification on polyβ-hydroxybutyrate in microbial granular sludge sequencing batch reactor[J]. Water Res,2005,39(8):1503 -1510.
[9] Wu Guangxue,Zhai Xiaofeng,Jiang Chengai,et al.Effect of ammonium on nitrous oxide emission during denitrification with different electron donors[J]. J Environ Sci,2013,25(6):1131 - 1138.
[10] Beun J J,Dircks K,van Loosdrecht M C M,et al.Poly-β-hydroxybutyrate metabolism in dynamically fed mixed microbial cultures[J]. Water Res,2002,36(5):1167 - 1180.
[11] Lovley D R,Phillips E J P. Novel mode of microbial energy metabolism:Organic carbon oxidation coupled to dissimilatory reduction of iron or manganese[J].Appl Environ Microbiol,1988,54(6):1472 -1480.
[12] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社,2002:216 - 274.
[13] 葛光环,赵剑强,高坤,等. SBBR工艺硝化过程中DO对N2O产生量的影响[J]. 环境工程学报,2016,10(4):1794 - 1798.
[14] Schalk-Otte S,Seviour R J,Kuenen J G,et al. Nitrous oxide(N2O)production by Alcaligenes faecalis during feast and famine regimes[J]. Water Res,2000,34(7):2080 - 2088.
[15] Itokawa Hiroki,Hanaki Keisuke,Matsuo Tomonori.Nitrous oxide production in high-loading biological nitrogen removal process under low COD/N ratio condition[J]. Water Res,2001,35(3):657 - 664.
[16] 李鹏章,王淑莹,彭永臻,等. COD/N与pH值对短程硝化反硝化过程中N2O产生的影响[J]. 中国环境科学,2014,34(8):2003 - 2009.
[17] Otte S,Grobben N G,Robertson L A,et al. Nitrous oxide production by Alcaligenes faecalis under transient and dynamic aerobic and anaerobic conditions[J]. Appl Environ Microbiol,1996,62(7):2421 -2426.
[18] Ma Juan,Yang Qing,Wang Shuying,et al. Effect of free nitrous acid as inhibitors on nitrate reduction by a biological nutrient removal sludge[J]. J Hazard Mater,2010,175(1/3):518 - 523.
[19] Zhou Yan,Pijuan M,Zeng R J,et al. Free nitrous acid inhibition on nitrous oxide reduction by a denitrifying-enhanced biological phosphorus removal sludge[J]. Environ Sci Technol,2008,42(22):8260 -8265.
[20] Dong L F,Nedwell D B,Underwood G J C,et al.Nitrous oxide formation in the Colne estuary,England:The central role of nitrite[J]. Appl Environ Microbiol,2002,68(3):1240 - 1249.
[21] 赵聪聪,张建,胡振,等. 碳源类型对污水生物处理过程中氧化亚氮释放的影响[J]. 环境科学学报,2011,31(11):2354 - 2360.
[22] Alinsafi A,Adouani N,Béline F,et al. Nitrite effect on nitrous oxide emission from denitrifying activated sludge[J]. Process Biochem,2008,43(6):683 -689.
[23] Berks B C,Ferguson S J,Moir J W B,et al. En-zymes and associated electron transport systems that catalyse the respiratory reduction of nitrogen oxides and oxyanions[J]. BBA:Bioenerg,1995,1232(3):97 - 173.
[24] Kampschreur M J,van der Star W R L,Wielders H A,et al. Dynamics of nitric oxide and nitrous oxide emission during full-scale reject water treatment[J]. Water Res,2008,42(3):812 - 826.
[25] Cordas C M,Duarte A G,Moura J J G,et al. Electrochemical behaviour of bacterial nitric oxide reductase:Evidence of low redox potential non-heme FeBgives new perspectives on the catalytic mechanism[J]. BBA:Bioenerg,2013,1827(3):233 - 238.

