异丙甲草胺在不同类型土壤中的吸附和淋溶特性研究
冯玉洁,谢圣华,田 海,潘 飞,梁延坡,曾东强
(1. 海南省农业科学院植物保护研究所,海南省植物病虫害防控重点实验室,海南 海口 571100;2.广西大学 农药与环境毒理研究所,广西 南宁 530004;3.中国热带农业科学院分析测试中心,海南 海口 571100)
异丙甲草胺在不同类型土壤中的吸附和淋溶特性研究
冯玉洁1,2,谢圣华1,田 海3,潘 飞1,梁延坡1,曾东强2*
(1. 海南省农业科学院植物保护研究所,海南省植物病虫害防控重点实验室,海南 海口 571100;2.广西大学 农药与环境毒理研究所,广西 南宁 530004;3.中国热带农业科学院分析测试中心,海南 海口 571100)
【目的】研究异丙甲草胺在甘蔗种植区3种代表性土壤中的吸附和淋溶特性。【方法】采用批量平衡法和土柱淋溶法,研究其在不同土壤中的吸附淋溶特性。【结果】异丙甲草胺在广西来宾壤土、扶绥壤质粘土和安徽萧县粉砂质壤土中的吸附规律均可以用Freundlich方程较好描述,土壤有机碳归一化吸附系数(KOC)分别为75.71、35.80和34.93,吸附常数(Kf)分别为7.58、3.06、3.12;表明异丙甲草胺在壤土中较难吸附,在另两种土壤中属难吸附;吸附自由能(△G)为-10.73、-8.87、-8.81 KJ/mol,均属于物理吸附;【结论】异丙甲草胺在粉砂质壤土中可淋溶,在壤土和壤质黏土中为较难淋溶,其在粉砂质壤土中移动性较壤质粘土和壤土强,对地下水造成污染的可能性较大。
异丙甲草胺;土壤;吸附;淋溶
【研究意义】土壤是农药施用后的一个重要归宿场所,土壤中的农药随着地表径流、淋溶等途径进入地表水和地下水,进而引起地表水甚至地下水体的污染,农药对地下水污染问题已越来越多的受到研究者关注[1]。农药在土壤中的迁移性和持久性是影响农药对地下水污染的主要因素[2],而其迁移与农药的自身理化性质和土壤吸附特性等因素密切相关,是评价农药生态环境安全性的重要指标[3-4]。【前人研究进展】异丙甲草胺[2-甲基-6-乙基-N-(1-甲基-2-甲氧乙基)-N-氯代乙酰基苯胺],分子式C15H22ClNO2,分子量为283.8,水溶解度为530 mg/L(20 ℃),可与大多数有机溶剂混溶,是一种酰胺类除草剂[5]。因其具有广谱、高效、选择性强的特点[6],是甘蔗田常用除草剂之一。微量的异丙甲草胺对人和动物有毒性作用[7-8]。已有研究发现,一定剂量异丙甲草胺可以显著减少鸡胚胎的细胞数量[9],对斑马鱼胚胎发育产生明显的致畸、致死、抑制发育等不良影响[10],可引起大鼠生殖系统内分泌的变化[11],并可在大鼠体内细胞色素P450酶系作用下,代谢为具有致癌作用的二烷基醌亚胺[12]。【本研究切入点】有关异丙甲草胺在土壤中的吸附行为已有报道[13-17],尚未发现有针对异丙甲草胺在甘蔗典型土壤中的吸附和淋溶行为的研究。【拟解决的关键问题】本研究参照《化学农药环境安全评价试验准则》[18]中吸附淋溶试验指导方法系统研究了异丙甲草胺在甘蔗种植区3种代表性土壤中的吸附和淋溶特性,并分析农药和土壤理化性质等对异丙甲草胺在土壤中迁移的影响,旨在为土壤和地下水中农药污染修复提供参考。
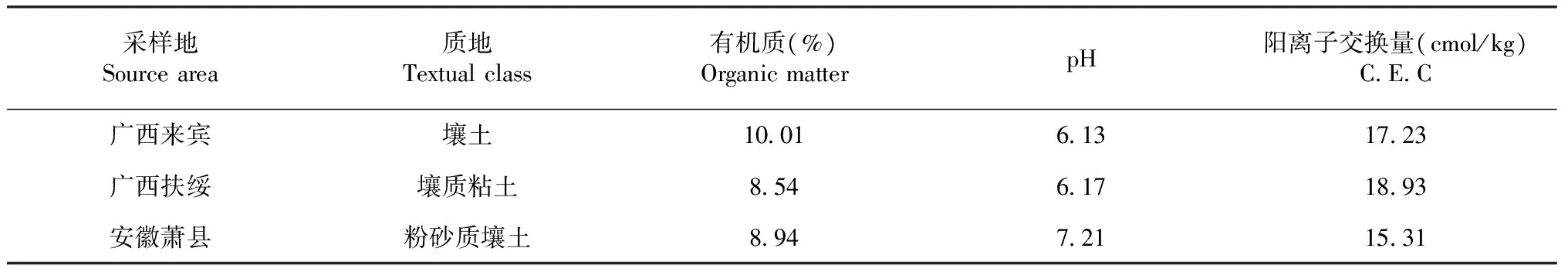
表1 供试土壤的基本理化性质
1 材料与方法
1.1 供试土壤
供试土壤分别采自广西区来宾市、广西崇左市扶绥县和安徽省萧县3个主要的甘蔗种植区,理化性质见表1。土壤及试验用水在使用前均经高压蒸汽灭菌(121 ℃,0.5 h)。
1.2 药品和试剂
异丙甲草胺(97.9 %)由广西化工研究院提供;乙腈为色谱纯;冰醋酸、二氯甲烷、氯化钠、无水硫酸钠、无水氯化钙、无水硫酸镁均为分析纯;玻璃柱(内径5 cm,高35 cm)。
0.01 mol/L氯化钙水溶液:称取1.110 g(精确至0.001 g)氯化钙置于1 L容量瓶中,以纯水定容。
1.3 试验仪器
Waters e2695高效液相色谱仪带二极管阵列检测器(PDA),美国waters科技有限公司;Agilent C18色谱柱(4.6 mm×250 mm×5 μm),美国安捷伦科技有限公司;Milli-Q超纯水仪,法国密里博有限公司;BT100流量型兰格蠕动泵,保定兰格恒流泵有限公司;TDZ5-WS多管架离心机,湖南湘仪离心机仪器有限公司;THZ-D台式恒温摇床,江苏金坛医疗仪器公司。
1.4 标准溶液配制
1000 mg/L标准母液:称取异丙甲草胺原药(97.9 %)0.1021 g置于100 mL容量瓶中,用少量乙腈溶解后用0.01 mol/L的氯化钙水溶液定容至100 mL。
1.5 土壤吸附试验
1.5.1 吸附试验 采用批量平衡法,在一系列100 mL具塞三角瓶中分别称取5.0 g供试土壤。吸附动力学试验,每个三角瓶中加入25 mL浓度为5.0 mg/L的异丙甲草胺溶液,于(25±2) ℃恒温振荡器中振荡24 h,分别于1,2,4,8,12,24,48 h取土壤悬浊液于4800 r/min离心5 min,取上清液过0.45 μm水相滤膜,液相色谱检测;吸附等温线试验,每个三角瓶中分别加入25 mL浓度为0.1,0.5,1.0,5.0,10.0 mg/L的异丙甲草胺标准溶液,于(25±2) ℃恒温振荡器中振荡24 h,取土壤悬浊液于4800 r/min离心5 min,取上清液过0.45 μm水相滤膜,液相色谱检测。
1.5.2 解吸试验 分离出上清液后,在土壤中加入等体积的0.01 mol/L CaCl2溶液,加塞后置于恒温振荡器中,于(25±2) ℃条件下振荡24 h后,以4800 r/min离心5 min,取上清液过0.45 μm水相滤膜,测定上清液中农药含量。重复操作1次,合计2次上清液农药含量。
以上所有试验均重复3次,同时设置未加土壤的农药氯化钙水溶液与加入土壤不含农药的氯化钙水溶液的对照处理。
1.5.3 土柱淋溶试验 称取700~800 g(精确到0.1 g)土壤样品于玻璃柱中,制成30 cm高的土柱,加入0.01 mol/L的氯化钙溶液至土壤饱和持水量的60 %,平衡过夜。将10、100 mg/L的异丙甲草胺溶液均匀滴加在土壤表层后,在其上覆盖1 cm石英砂和1层滤纸,用蠕动泵将300 mL氯化钙溶液(0.01 mol/L)从土柱上端进行淋溶(30 mL/h),收集淋出液。结束后,将土柱均匀切成3段,分别测定各段土壤及淋出液中的异丙甲草胺含量。
1.6 样品中异丙甲草胺的提取及测定
土样中异丙甲草胺的提取:称取10 g土样加至50 mL离心管中,加入500 mg无水硫酸镁和15 mL乙腈,涡旋5 min后离心(4500 r/min)5 min,取上清液1~2 mL过0.22 μm有机滤膜,待测。
水样:取200 mL淋洗液加入500 mL分液漏斗中,加入氯化钠至饱和,用50 mL二氯甲烷萃取3次,合并有机相并过无水硫酸钠,35 ℃条件下浓缩近干,用乙腈溶解并定容至2 mL,过0.22 μm有机滤膜,待测。
色谱检测条件:Waters e2695高效液相色谱仪带PDA检测器,配Aglient C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈和0.1 %乙酸水溶液(体积比为7∶3),流速:1 mL/min;柱温:25 ℃;进样体积:20 μl;检测器波长220 nm。在该条件下,其的保留时间为6.83 min。
1.7 添加回收试验
向空白土壤中添加0.1、0.5、1.0 mg/kg水平的异丙甲草胺标液,向空白水样中0.5、1.0、2.0 mg/L水平的标液,采用1.6所建立的方法测定回收率及相对标准偏差(RSD),试验重复5次。
1.8 计算方法
根据我国《化学农药环境安全评价试验准则》[18]进行计算。
吸附率:A=100(M-Ce×V0)/M=100X/M
式中,A为吸附率;M为未加土壤的农药水溶液平衡时农药含量,mg;Ce为经土壤吸附平衡时水相中农药浓度,mg/L;V0为水溶液体积,mL;X为吸附于土壤中的农药量,mg。
解析率:D=100[C×V-(V0-V)×Ce]/X
式中,D为解吸率;C为解吸液中农药的质量浓度,mg/L;V为解吸试验后水相体积,mL。
式中,Cs吸附平衡时土壤吸附的异丙甲草胺浓度,mg/kg;Ce为平衡溶液中异丙甲草胺浓度,mg/L;Kf土壤吸附系数;1/n为吸附系数。
有机质吸附常数(Koc)、吸附自由能(△G,KJ/mol)计算公式如下:
Koc=100Kf/OC %
△G=-RTlnKoc
式中,R为气体摩尔常数,8.314 J/(K·mol);T为绝对温度,K。

图1 异丙甲草胺在3种蔗土中的吸附动力学过程Fig.1 The adsorption kinetics process of metolachlor in three soils
土柱淋溶:根据三段土壤及淋出液中的农药含量,分别求出其占添加总量的百分比。
Ri=mi/M×100 %
式中,Ri为各组分中农药含量的比例, %;mi为各组分中农药含量,mg;i=1、2、3、4,分别表示组分0~10、10~20、20~30 cm土壤和淋出液;M为农药添加总量,mg。
2 结果与分析
2.1 分析方法的准确度和精密度
在0.05~5.00 mg/L浓度范围内异丙甲草胺标准品的线性方程为y=50679x-3137,R2=0.9996。在0.1~1.0 mg/kg添加水平下,土壤样品中异丙甲草胺的回收率为78.9 %~98.7 %,RSD为2.99 %~6.43 %,LOQ为0.03 mg/kg;在0.5~2.0 mg/L添加水平下,水样中异丙甲草胺的回收率为82.0 %~87.2 %,RSD为2.41 %~8.17 %,LOQ为0.10 mg/L。结果符合分析标准要求[12]。
2.2 异丙甲草胺在土壤中的吸附动力学特性
在24 h振荡过程中,未发现异丙甲草胺因微生物分解、水解或光解而明显消解。
异丙甲草胺在3种土壤中的吸附在8~12 h内基本达到平衡(图1),为确保吸附达到完全平衡,平衡时间统一控制为24 h。3种土壤对异丙甲草胺的吸附能力由强到弱依次是:广西壤土>广西壤质粘土>安徽粉砂质壤土,其平衡吸附率分别为35.83 %、37.60 %、25.46 %。

表2 异丙甲草胺在3种土壤中的吸附解吸参数

图2 异丙甲草胺在3种土壤上的吸附等温线(25 ℃)Fig.2 Adsorption isotherms of metolachlor in three soils
2.3 异丙甲草胺在土壤中的等温吸附特性
通过比较发现,异丙甲草胺在3种蔗土中的吸附规律可用Freundlich方程较好的拟合。异丙甲草胺在广西壤土、广西壤质粘土和安徽粉砂质壤土中的Kf值分别为7.58、3.06和3.12(表2),表明在供试3种土壤中,广西壤质粘土对异丙甲草胺的吸附作用最弱,广西壤土的吸附作用最强。通常吸附等温线有3种类型即S、L、H型。1/nads<1时,该类等温吸附线属于L型(图2),表明异丙甲草胺在较低浓度下与土壤的亲和力比对水的亲和力要强,而随着浓度的增加,与土壤的亲和力降低,吸附减弱。
有机碳归一化吸附系数KOC(单位mL/g)统一描述不同土壤对化合物的吸附行为。异丙甲草胺在广西壤土、广西壤质粘土和安徽粉砂质壤土中的KOC值分别为75.71、35.80和34.93,根据《化学农药环境安全评价试验准则》[18],表明异丙甲草胺在广西壤土中属于较难吸附等级,在另2种土壤中属于难吸附等级。
2.4 异丙甲草胺在土壤中的吸附自由能
土壤吸附自由能 (ΔG) 是反映土壤吸附特性的重要参数,根据其大小可以推断土壤的吸附机制:当吸附自由能变化|ΔG|<40 KJ/mol 时为物理吸附;反之为化学吸附[19]。由表2可以看出,3种土壤对异丙甲草胺农药吸附的自由能变化均为负值,且吸附自由能变化均小于40 KJ/mol,表明该吸附为物理吸附,且是自发的可逆吸附。
2.5 异丙甲草胺在土壤中的淋溶特性

表3 异丙甲草胺在不同土层中的分布百分比

图3 异丙甲草胺在土柱各层及淋洗液中的淋溶分布Fig.3 Metolachlor residues in soil column layers and eluent
异丙甲草胺在广西来宾壤土的3~12 cm段农药残留占总量的50 %以上(表3),在广西扶绥壤质粘土中的6~15 cm段农药残留占总量的50 %以上,而在安徽萧县粉砂质壤土中,农药残留主要集中在15~24 cm段(占近70 %),淋洗液中均未见异丙甲草胺检出(图3)。由此可以看出,异丙甲草胺在安徽粉砂质壤土中的移动性强于广西壤土和壤质粘土。根据各段土柱中农药的百分含量可将农药的移动性能进行等级划分[18],安徽粉砂质壤土属可淋溶等级,广西壤土和壤质粘土属较难淋溶等级。
3 讨 论
农药在土壤中的吸附和淋溶行为主要受农药本身特性和土壤理化性质的影响,通常情况下,土壤中有机质含量越高,吸附农药的能力越强,pH值降低,农药吸附量升高,阳离子交换量也会直接影响农药在土壤中的吸附[20],且通常来说,土壤吸附强的农药,其土壤移动能力就弱。对比异丙甲草胺在3种土壤中的Kf值与土壤性质的关系,可以看出,Kf值与土壤有机质含量具有很好的相关性,而与阳离子交换量和pH值等其他土壤性质相关性不强。异丙甲草胺的吸附主要受有机质含量的支配,土壤中有机质含量越高,越有利于异丙甲草胺的吸附,这与王素丽等[15]和曹鹏英[16]等的研究结果一致。
Freundlich吸附等温方程中,常用1/nads表示吸附过程的强烈程度,吸附机理不同是产生吸附强烈程度差异的原因。由表2和图2可知,3种土壤的1/nads均小于1,且属于L型,这与王素丽等[15]和王琪全等[17]关于异丙甲草胺的吸附曲线为L型的研究结果一致。3种土壤对异丙甲草胺的吸附为物理吸附,且是自发的可逆吸附,表明异丙甲草胺在施入土壤后不会因与土壤组分发生化学反应而失去活性。
根据《化学农药环境安全评价试验准则》[18]中吸附性和移动性的等级划分标准,异丙甲草胺在壤土中属于较难吸附型和较难淋溶型,壤质粘土中属难吸附型和较难淋溶型,而在粉砂质壤土中属难吸附型和可淋溶型。由此可见,异丙甲草胺在粉砂质壤土中移动性较壤质粘土和壤土强,对地表水和地下水造成污染的可能性较大。
4 结 论
添加回收试验表明:土壤样品中异丙甲草胺的回收率为78.9~98.7 %,RSD为2.99 %~6.43 %,LOQ为0.03 mg/kg;水样中异丙甲草胺的回收率为82.0 %~87.2 %,RSD为2.41 %~8.17 %,LOQ为0.10 mg/L。分析方法符合吸附、淋溶特性研究的分析要求。
批量平衡法结果表明,异丙甲草胺在3种土壤中的吸附能力大小顺序为壤土>壤质粘土>粉砂质壤土,吸附以物理吸附为主。异丙甲草胺在3种土壤中的吸附均可采用Freundlich方程较好的拟合, 其Kf值分别为7.58、3.06和3.12,KOC值分别为75.71、35.80和34.93,在3种土壤上的等温吸附曲线呈L型,表明异丙甲草胺在壤土中属于较难吸附型,在另两种土壤中属于难吸附型。
异丙甲草胺在粉砂质壤土中可淋溶,壤土和壤质粘土属较难淋溶。
[1]林 绿, 覃志豪, 李文娟. 我国农药地下水环境风险评估场景体系的建立[J]. 农业环境科学学报, 2014, 33(11): 2194-2203.
[2]Manuel A E, Eugenio L P, Elena M C. The mobility and degradation of pesticides in soils and the pollution of groundwater resources[J]. Agriculture Ecosystem and Environment, 2008, 123: 247-260.
[3]吴文铸, 孔德洋, 郭 敏, 等. 甲羧除草醚在土壤中的吸附和淋溶特性[J]. 生态环境学报, 2012, 21(12): 2013-2017.
[4]许秀莹, 宋稳成, 王鸣华. 氟啶胺在土壤中的吸附解吸与淋溶特性[J]. 中国环境科学, 2013, 33(4): 669-673.
[5]Aguilar C, Ferrer I, Borrull F, et al. Monitoring of pesticides in river water based on samples previously stored in polymeric cartridges followed by on-line solid-phase extraction-liquid chromatography-diode array detection and confirmation by atmospheric pressure chemical ionization mass spectrometry[J]. Analytica Chimica Acta, 1998, 386(3): 237-248.
[6]Kontchou C Y, Gschwind N. Interactions and biodegradation of the herbicide metolachlor with different surfaces[J]. Ecotoxicology and Enviromental Safety, 1998, 40(1/2):29-33.
[7]Alavanja M C, Dosemeci M, Samanic C, et al. Pesticides and lung cancer risk in the agricultural health study cohort[J]. American Journal Epidemiology, 2004, 160(9): 876-885.
[8]Rusiecki J A, Hou L, Lee W J, et al. Cancer incidence among pesticide applicators exposed to metolachlor in the agricultural health study[J]. International Journal of Cancer, 2006, 118(12): 3118-3123.
[9]Varnagy L, Budai P, Fejes S, et al. Toxicity and degradation of metllachlor (Dual Gold 960 EC) in chicken embryos[J]. Commun Agric Appl Biol Sci, 2003, 68(4): 807-811.
[10]周 炳, 赵美蓉, 黄海凤. 4种农药对斑马鱼胚胎的毒理研究[J]. 浙江工业大学学报, 2008, 36(2): 136-140.
[11]Mathias F T, Romano R M, Sleiman H K, et al. Herbicide metolachlor causes changes in reproductive endocrinology of male wistar rats[J]. ISRN Toxicol, 2012, DOI: 10. 5402/ 2012/ 130846.
[12]Coleman S, Linderman R, Hodgson E, et al. Comparative metabolism of chloroacetamide herbicides and selected metabolites in human and rat liver microcosms[J]. Environmental Health Perspect, 2000, 108(12): 1151-1157.
[13]葛超超, 郭 璇, 李建法, 等. 水稻秸秆生物炭对异丙甲草胺的吸附和缓释作用[J]. 生态与农村环境学报, 2016, 31(1): 168-172.
[14]侯少锋, 李荣玉, 尹显慧, 等. 精异丙甲草胺胁迫下烟草根际土壤微生物的动态响应及其降解[J]. 江苏农业科学, 2016, 44(6): 493-495.
[15]王素利, 王 竣, 金淑惠, 等. 异丙草胺丁草胺和异丙甲草胺在土壤中的吸附行为研究[J]. 农业环境科学学报, 2005, 24(增刊): 288-290.
[16]曹鹏英, 薄 瑞, 韩丽君, 等. 精异丙甲草胺在土壤中的吸附行为及环境影响因素研究[J]. 农药学学报, 2007, 9(2): 159-164.
[17]王琪全, 刘维屏. 乙草胺和异丙甲草胺在土壤中吸附的研究[J]. 土壤学报, 2000, 37(1): 95-101.
[18]化学农药环境安全评价试验准则: GB/T 31270.1-2014[S]. 北京: 中国标准出版社, 2015.
[19]Jana T K, Das B. Sorption of carbaryl ( 1-napthyl N-methyl carbamate ) by soil[J]. Bull Environ Contam Toxicol, 1997, 59: 65-71.
[20]刘维屏, 农药环境化学[M].北京: 化学工业出版社, 2006: 121-124.
AdsorptionandLeachingBehaviorofMetolachlorinDifferentSoils
FENG Yu-jie1,2, XIE Sheng-hua1,TIAN Hai3, PAN Fei1, LIANG Yan-po1, ZENG Dong-qiang2*
(1.Institute of Plant Protection, Hainan Academy of Agricultural Science, Laboratory for Control of Plant Diseases and Insect Pests, Hainan Haikou 571100, China; 2. Institute of Pesticide & Environmental Toxicology, Guangxi University, Guangxi Nanning 530004, China; 3. Analysis and Testing Center, CATAS, Hainan Haikou 571100,China)
【Objective】The adsorption and leaching behavior of metolachlor in different soils were studied.【Method】The adsorption and leaching of metolachlor in different soils were conducted by batch equilibrium and column leaching experiments.【Result】The adsorption of metolachlor in the tested soils was better fitted by the empirical Freundlich adsorption isotherm, and the adsorption constants (Kf) in Guangxi loam soil, Guangxi loamy clay、Anhui sandy loam were 7.58,3.06 and 3.12. The organic carbon partition coefficients (KOC) were 75.71、35.80 and 34.93, which demonstrated that metolachlor was rather difficult to be adsorbed on the loam soil, the sorption on the loamy clay and sandy loam were difficult degree. The values of adsorption free energy (△G) in the soil samples were ranged from -8.81 to -10.73KJ/mol. And the adsorption belonged to spontaneous and physical process.【Conclusion】 Metolachlor in the soil of sandy loam belonged to ‘Can be leached’ catalog and ‘difficult to be leached’ catalog in the soils of loam soil, loamy clay. The mobility of metolachlor in sandy loam is more than that of loamy clay and loam soil, which is more likely to cause pollution to groundwater.
Metolachlor; Soil; Adsorption; Leaching
1001-4829(2017)12-2751-05
10.16213/j.cnki.scjas.2017.12.023
2017-10-12
海南省省属科研院所技术开发研究专项(KYYS-2015-01);海南省农业科学院农业科技创新专项经费(CXZX201602)
冯玉洁(1986-),女,河南新乡人,硕士,研究方向:农药残留与农产品质量安全,E-mail:fengyujie238@163.com,*为通讯作者:曾东强,E-mail:zengdq550@163.com。
S143.92
A
(责任编辑李 洁)

