H2O2对盐胁迫下羽衣甘蓝幼苗生长的影响
李伟+郭君洁+李鸿雁


摘要: 以羽衣甘蓝名古屋品种(Brassica oleracea L. var. acephala f. tricolor Hort.)为研究材料,在100 mmol/L NaCl胁迫下,分别使用外源H2O2和H2O2清除剂二甲基硫脲处理。2 d后测定植物的生长速率、干质量、鲜质量和相对含水量,6 h后测定植株体内3个抗氧化酶超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)的活性及基因的表达。结果显示,盐胁迫下加入0.05 mmol/L外源H2O2,羽衣甘蓝幼苗生长速率、干质量、鲜质量、相对含水量、3个抗氧化防护酶的活性和基因表达分别高于盐胁迫下相关指标;清除内源H2O2,则植物幼苗生长速率、干质量、鲜质量和相对含水量、3个抗氧化防护酶的活性及基因表达分别低于盐胁迫下相关指标。由此推测,在盐胁迫条件下,H2O2参与了抗氧化防护基因表达的调控,它可能是盐胁迫诱导的羽衣甘蓝叶片抗氧化防护系统的重要调控因子。
关键词: 羽衣甘蓝;H2O2;盐胁迫;抗氧化酶;基因表达
中图分类号: S635.901 文献标志码: A
文章编号:1002-1302(2017)22-0149-04
盐胁迫是造成作物严重减产最常见的逆境条件,提高植物对环境胁迫的抗性,尤其是对盐胁迫的抗性,是稳定植物生长的首选目标,当植物受到环境胁迫时会产生大量活性氧,包括过氧化(H2O2)、单线态氧(1O2)、羟自由基(·OH)、超氧阴离子(O-2[KG-*2]· )、脂质过氧基(ROO·)等[1-4]。盐胁迫能迅速诱导植物体内活性氧的积累,对蛋白质和脂类引起氧化损伤[5]。而植物体内有2种清除保护机制,即酶促系统和非酶促系统,其中酶促系统包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)等。研究表明,盐胁迫能使植物体内活性氧增高[6-8]。近年来,许多试验表明,H2O2是一种重要的信号分子,当植物细胞在响应于各种胁迫反应时能生成该物质,并进一步调节应激反应的一系列信号转导[9-14]。有证据显示,逆境条件下内源H2O2积累能增加植物的抗逆性,过量的H2O2等ROS能引起细胞内大分子氧化损伤;Wahid等的研究表明,过氧化氢预处理可以使细胞膜系统保持完整,继而提高小麦种子抗氧化能力,增强小麦在萌发过程中的耐盐性[13]。在植物的抗盐反应中起到关键作用的SOS1(salt overly sensitive)是拟南芥Na+/H+反向转运体,H2O2能调节其mRNA稳定性。然而,在盐胁迫诱导下,H2O2与氧化酶活性其表达机理尚不十分清楚。
本试验研究盐胁迫下外源H2O2或者清除体内H2O2对羽衣甘蓝幼苗生长特性、抗氧化酶活性及相关基因表达的影响,旨在揭示H2O2在植物抗盐胁迫反应中的作用机制。
1 材料与方法
1.1 试验材料
试验于2015年8—10月在黄淮学院实验室进行。选用羽衣甘蓝名古屋品种(Brassica oleracea L. var acephala f. tricolor Hort.) 为研究材料,由驻马店市南海公园提供。H2O2供体为30% H2O2,H2O2清除剂为二甲基硫脲,均为国产分析纯。
1.2 试验处理
把羽衣甘蓝种子,消毒后,用蒸馏水冲洗数次,滤纸吸干。处理后的种子放入垫好滤纸的培养皿中,温室培养[温度:(24±2) ℃,光照—黑暗:16 h—8 h,光照度:2 000 lx]。待羽衣甘蓝胚根长3~5 mm时,选取胚根整齐一致的幼苗,盆栽。待苗长至10 cm左右,放入Hoagland溶液温室预培养3 d。3 d 后,分4组进行处理,分别是对照组(CK):Hoagland溶液;盐处理组(N):100 mmol/L NaCl+Hoagland溶液;NaCl+H2O2组(N+H):100 mmol/L NaCl+0.05 mmol/L H2O2+Hoagland溶液;NaCl+DMTU组(N+DMTU):100 mmol/L NaCl+5 mmol/L DMTU+Hoagland溶液。处理6 h后,进行SOD、CAT、APX活性分析与基因(SOD,GenBank:JQ321587.1;CAT,GenBank:JF720325.1;APX,GenBank:XM_013733887.1)表达测定。用异硫酸胍法提取叶片内总RNA,ABI7700进行定量PCR,以actin(GenBank登录号AF111812.1)作为内参(表1),方法参照文献[15]进行。每处理重复3次,为了保持处理一致性,处理期間每天更换处理液,处理48 h后,分别取羽衣甘蓝幼苗测定生长速率,取叶片分别测定干质量、鲜质量和相对含水量,测定方法参照文献[16]进行。
2 结果与分析
2.1 盐胁迫下外源或清除内源H2O2对羽衣甘蓝幼苗生长的影响
研究发现,用50 mmol/L NaCl处理的羽衣甘蓝幼苗与对照没有显著差异,仅有部分老叶枯萎。在100 mmol/L NaCl胁迫下,羽衣甘蓝幼苗受伤害程度增加,上部部分叶片变黄,下部老叶萎蔫。当NaCl浓度达到150、200 mmol/L时,叶片严重失水,导致甘蓝幼苗全株死亡。因此,在此后试验中,选择100 mmol/L NaCl进行处理。在此浓度下,羽衣甘蓝幼苗表现出一定的盐害症状,但不会导致植物死亡。预试验表明,H2O2浓度为0.05 mmol/L时对100 mmol/L NaCl胁迫下羽衣甘蓝幼苗生长的影响较为明显,因此本试验H2O2浓度为005 mmol/L。
用100 mmol/L NaCl处理羽衣甘蓝幼苗的生长受到显著抑制,植株生长速率、植株地上部鲜质量、干质量和相对含水量与对照相比均下降,且有显著差异。外源H2O2使盐胁迫羽衣甘蓝幼苗生长速度、鲜质量、干质量和相对含水量与仅盐胁迫处理显著增加(图1)。在盐胁迫下,用H2O2清除剂DMTU处理,则叶片生长速率、植株鲜质量、干质量和相对含水量与盐胁迫下相比显著下降,表明清除H2O2后,盐胁迫下羽衣甘蓝生长受到抑制。endprint
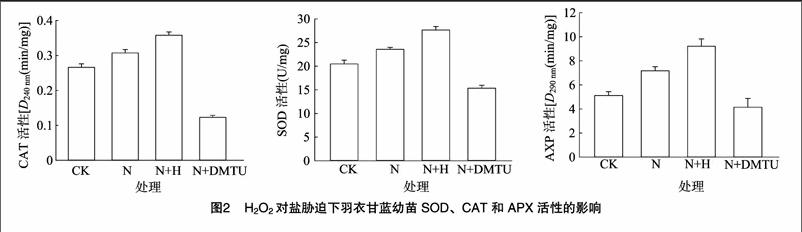
2.2 鹽胁迫下外源H2O2或清除内源H2O2对几种抗氧化酶活性的影响
当植物体处在胁迫环境中时,抗氧化酶活性通常会增加,以加强对逆境的适应。在100 mmol/L NaCl胁迫条件,羽衣甘蓝幼苗SOD酶活性显著上升,与对照相比有显著差异,外源0.05 mmol/L H2O2处理与盐胁迫相比可以显著提高SOD酶活性(图2)。说明低浓度外源H2O2能增强抗氧化酶活性。CAT和APX与SOD类似。
2.3 盐胁迫下外源H2O2或清除内源H2O2对几种氧化酶基因表达的影响
与对照相比,盐胁迫条件下,3个基因的表达均有所增加,且SOD、CAT、APX基因表达增加的趋势相同。加入外源H2O2,3种基因表达量有所提高,与对照有显著差异。当用H2O2清除剂对盐胁迫下羽衣甘蓝的3个抗氧化防护基因表达进行测定,结果显示,3种基因的表达量与盐胁迫相比有所下降,差异显著(图3)。
3 讨论
当植物受到盐胁迫时,体内活性氧代谢平衡失调,积累的活性氧导致盐害[17-18]。因此,本研究中,高浓度的H2O2处理,引起羽衣甘蓝幼苗活性氧增加,对盐胁迫适应性下降,使植物受害加重,生长受到严重抑制。近年研究表明,H2O2等活性氧在植物体内也能起到信号转导作用,微量过氧化氢等活性氧在调节某些生理现象方面起着重要作用,尤其是在细胞信号转导中的作用。本试验中采用的0.05 mmol/L浓度H2O2在羽衣甘蓝响应盐胁迫过程中可能发挥了某种信号作用,参与或者影响了盐胁迫信号转导过程,从而一定程度地缓解了盐胁迫对羽衣甘蓝幼苗生长的抑制作用。
盐胁迫能抑制植物的呼吸代谢,这个过程中细胞内ROS大量增加(如H2O2等),对植物造成次生伤害,如细胞膜脂质过氧化。植物为了清除体内ROS,植物体内的抗氧化酶活性会相应提高,增加植物耐盐能力[19-20]。盐胁迫下,植物SOD、CAT和APX等抗氧化酶协同作用,清除过多的活性氧,使活性氧代谢处于平衡状态,保护生物膜的完整性,使其在一定范围内忍耐盐胁迫。但是,当活性氧的产生超过了抗氧化系统的消除能力时,植物就会受到伤害[21]。SOD催化O-2发生歧化反应,从而避免O-2对细胞的毒性伤害,而歧化反应过程中所产生的H2O2则由CAT、APX等来清除[22-23]。也有研究认为,H2O2是活性氧信号转导途径中的一个重要内源信号分子,在植物对生物和非生物胁迫的抗性中起着重要作用[24]。本试验结果表明,在盐胁迫下,3种抗氧化酶活性都比空白对照增强。但在高盐胁迫下,适当浓度的H2O2能够提高羽衣甘蓝叶片SOD、CAT以及APX的活性,而清除剂处理下,则3种抗氧化酶与仅盐胁迫处理相比显著下降。表明低浓度的H2O2盐胁迫条件下有信号转导作用。
H2O2作为信号分子也胁迫调节相关的基因表达。在一定条件下,H2O2作为一种信号分子,可以调节一系列相关基因的表达[25-26]。例如,当植物被病原体感染时,植物体内的H2O2诱导PR-1和PAL 基因的表达[27]。有人把豆类植物用 10 mmol/L H2O2处理,其免疫反应中类NOS活性提高近8.3倍。大豆(Glycine max L.)细胞用外源H2O2处理,细胞质APX的转录水平显著提高[28]。如果用APX抑制剂羟基脲或CAT抑制剂氨基三唑处理培养的水稻(Oryza sativa L.)细胞,H2O2的产量明显增加,它使APX的转录水平大幅提高[29]。另有研究表明,H2O2激活促原分裂蛋白激酶(MAPK)进一步增强抗氧化酶防御酶活性[30]。本研究结果表明,在盐胁迫下,3种抗氧化酶的基因表达受过氧化氢正调控(图3),表明抗氧化防御系统增加了植物对盐胁迫的耐受性和内源性过氧化氢的积累有关。
综上所述,在盐胁迫条件下,H2O2参与了羽衣甘蓝抗氧化保护酶活性的调节,同进也参与了抗氧化酶基因表达调控,它可能是盐胁迫诱导的羽衣甘蓝叶片抗氧化防护系统的重要调控因子。
参考文献:
[1] Correa N S,Bandeira J D,Marini P,et al. Salt stress:antioxidant activity as a physiological adaptation of onion cultivars[J]. Acta Botanica Brasilica,2013,27(2):394-399.
[2]Harpreet K,Sirhindi G,Bhardwaj R. Alteration of antioxidant machinery by 28-homobrassinolide in Brassica juncea L. under salt stress[J]. Advances in Applied Science Research,2015,6(4):166-172.
[3]Egbichi I,Keyster M,Ludidi N. Effect of exogenous application of nitric oxide on salt stress responses of soybean[J]. South African Journal of Botany,2014,90(1):131-136.
[4]刘友良,汪良驹. 植物对盐胁迫的反应和耐盐性[M]//余叔文,汤章城. 植物生理与分子生物学. 2版.北京:科学出版社,1998:752-754.
[5]刘爱荣,张远兵,陈登科. 盐胁迫对盐芥(Thellungiella halophila)生长和抗氧化酶活性的影响[J]. 植物研究,2006,26(2):216-221.
[6]Costa P,Neto A,Bezerra M,et al. Antioxidant-enzymatic system of two sorghum genotypes differing in salt tolerance[J]. Brazilian Journal of Plant Physiology,2005,17(4):353-362.endprint
[7]Hernández J A,Ferrer M A,Jiménez A,et al. Antioxidant systems and O-2[KG-*2]· / H2O2 production in the apoplast of pea leaves. Its relation with salt-induced necrotic lesions in minor veins[J]. Plant Physiology,2001,127(3):817-831.
[8]高永生,陳集双. 盐胁迫下镧对小麦幼苗叶片抗氧化系统活性的影响[J]. 中国稀土学报,2005,23(4):490-495.
[9]Anderson B E,Ward J M,Schroeder J I. Evidence for an extracellular reception site for abscisic acid in commelina guard cells[J]. Plant Physiology,1994,104(4):1177-1183.
[10] 苗雨晨,董发才,宋纯鹏. 过氧化——植物体内的一种信号分子[J]. 生物学杂志,2001,18(2):4-6.
[11]赵凤云,王元秀. 植物体内重要的信号分子——H2O2[J]. 西北植物学报,2006,26(2):427-434.
[12]李师翁,薛林贵,冯虎元,等. 植物中的H2O2信号及其功能[J]. 中国生物化学与分子生物学报,2007,23(10):804-810.
[13]Wahid A,Perveen M,Gelani S,et al. Pretreatment of seed with H2O2 improves salt tolerance of wheat seedlings by alleviation of oxidative damage and expression of stress proteins[J]. Journal of Plant Physiology,2007,164(3):283-294.
[14]Chung J S,Zhu J K,Bressan R A,et al. Reactive oxygen species mediate Na+-induced SOS1 mRNA stability in Arabidopsis[J]. Plant Journal for Cell and Molecular Biology,2008,53(3):554-565.
[15]刘遵春,陈荣江,包东娥. 干旱胁迫对金光杏梅幼苗生长及其生理生化指标的影响[J]. 沈阳农业大学学报,2008,39(1):100-103.
[16]Li D H,Liu H,Yang Y L,et al. Down-regulated expression of gene by RNA interference enhances drought tolerance in rice[J]. Rice Science,2008,16(1):14-20.
[17]张立军,魏 颖,宋广周,等. H2O2信号在植物理化胁迫反应中的作用[J]. 辽宁农业科学,2008(2):33-37.
[18]Gong M,Chen B,Li Z G,et al. Heat-shock-induced cross adaptation to heat,chilling,drought and salt stress in maize seedlings and involvement of H2O2[J]. Journal of Plant Physiology,2001,158(9):1125-1130.
[19]毛桂莲,许 兴,米海莉,等. NaCl胁迫下枸杞愈伤组织活性氧产生与质膜H+/Na+酶活性的关系[J]. 干旱地区农业研究,2003,21(3):110-113.
[20]Liu A R. Effects of salt stress on the growth and the antioxidant enzyme activity of Thellungiella halophila[J]. Bulletin of Botanical Research,2006,26(2):216-221.
[21]王国骄,唐 亮,范淑秀,等. 抗氧化机制在作物对非生物胁迫耐性中的作用[J]. 沈阳农业大学学报,2012,43(6):719-724.
[22]孙卫红,王伟青,孟庆伟. 植物抗坏血酸过氧化物酶的作用机制、酶学及分子特性[J]. 植物生理学报,2005,41(2):143-147.
[23]蔡妙珍,罗安程,林咸永,等. Ca2+对过量Fe2+胁迫下水稻保护酶活性及膜脂过氧化的影响[J]. 作物学报,2003,29(3):447-451.
[24]梁国庆,孙静文,周 卫,等. 钙对苹果果实超氧化物歧化酶、过氧化氢酶活性及其基因表达的影响[J]. 植物营养与肥料学报,2011,17(2):438-444.
[25]蒋景龙. H2O2与生长素对山黧豆初生根发育的影响[J]. 江苏农业科学,2016,44(3):121-123.
[26]蔡凤香,陈豆豆,杨 飞,等. H2O2对水稻幼苗生长和生理的调节[J]. 江苏农业科学,2016,44(3):74-77.
[27]Beligni M V,Lamattina L. Nitric oxide interferes with plant photo-oxidative stress by detoxifying reactive oxygen species[J]. Plant Cell & Environment,2002,25(6):737-748.
[28]Lee S C,Kang B G,Oh S E. Induction of ascorbate peroxidase by ethylene and hydrogen peroxide during growth of cultured soybean cells[J]. Molecules and Cells,1999,9(2):166-171.
[29]Morita S,Masumura T,Tanaka K,et al. Induction of rice cytosolic ascorbate peroxidase mRNA by oxidative stress; the involvement of hydrogen peroxide in oxidative stress signalling[J]. Plant & Cell Physiology,1999,40(4):417-422.
[30]Zhang A,Jiang M,Zhang J,et al. Nitric oxide induced by hydrogen peroxide mediates abscisic acid-induced activation of the mitogen-activated protein kinase cascade involved in antioxidant defense in maize leaves[J]. New Phytologist,2007,175(1):36-50.endprint

