芒果BCH基因的克隆与表达
陈景锋+赵志常+高爱平+黄建峰+罗睿雄+刘宽亮+张梦云


摘要: β-胡萝卜素羟化酶(BCH)基因是催化玉米黄素合成的关键基因,玉米黄素在植物光保护过程中发挥着重要的作用。采用RACE方法从黄色的金煌芒果的果皮中克隆得到了1个BCH基因,该基因全长cDNA序列为 1 160 bp,开放阅读框为888 bp,编码295个氨基酸,分子质量为32.97 ku,分子等电点为9.51。利用生物信息学在线分析软件对其组成成分、疏水性/亲水性、二级结构、功能结构域以及三级结构进行预测和分析。通过系统发育分析发现,该基因编码的蛋白与温州蜜柑、柚子、大豆、草莓等具有较近的亲缘关系。对不同芒果品种的BCH基因的表达进行分析发现,红色的贵妃品种中表达量较高,而黄色的金煌品种中表达量较低。
关键词: 芒果;β-胡萝卜素羟化酶(BCH)基因;基因克隆;基因表达分析;亲缘关系
中图分类号: Q785;S667.701 文献标志码: A
文章编号:1002-1302(2017)22-0024-03
β-胡萝卜素羟化酶(β-carotene hydroxylase,BCH) 基因是催化玉米黄素合成的关键基因。目前,已经报道了从拟南芥、甜橙、南丰蜜橘、甜椒等[1-5]植物中克隆到了该基因。由于BCH在类胡萝卜素生物合成中的关键作用,已成为植物类胡萝卜素遗传工程改良中的主要目的基因。芒果类胡萝卜素生物合成途径中的 BCH基因分离和鉴定研究国内外至今未见报道,BCH在芒果类胡萝卜素生物合成途径中具体作用和功能目前还不清楚。本研究中克隆并分析了芒果BCH基因,为进一步研究BCH在芒果果实着色上的调控功能奠定分子基础,对揭示 BCH基因在芒果类胡萝卜素合成及果色形成中的作用具有重要理论意义,为进一步创制高胡萝卜素含量新种质资源、开展芒果类胡萝卜素品质育种提供了理论依据。
1 材料与方法
1.1 材料
分别用刀片切取桂七芒果完全成熟的绿果皮、金煌芒果完全成熟的黄色果皮、贵妃芒果完全成熟的红色果皮,切碎放入采样袋中液氮速冻后,立即放入-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1 芒果果皮总RNA提取 采用植物RNA提取试剂盒提取芒果果皮總RNA,用DNase试剂盒进行基因组DNA消除,RNase-free无菌水溶解,采用SMARTerTM RACE Amplification Kit(Clontech)反转录合成cDNA。
1.2.2 PCR扩增反应 扩增条件为:94 ℃ 4 min;94 ℃ 50 s,50 ℃ 50 s,72 ℃ 2 min,35个循环;72 ℃延伸7 min。 反应体系为25 μL,其中含10×PCR buffer(含Mg2+) 2.5 μL、25 ng DNA模板、20 μmol引物、1.0 U Taq DNA聚合酶、5.0 mmol dNTPs。
1.3 BCH基因全长cDNA序列的获得
以合成的 cDNA 为模板,根据已知的BCH基因片段设计cDNA 3′-RACE和5′-RACE引物,进行3′和5′端的扩增。将目的基因片段回收、连接、转化、鉴定及测序,并根据得到的cDNA 3′ 端和5′末端的序列结果拼接BCH的全长cDNA,设计特异引物,进行全长cDNA序列的扩增。
1.4 BCH基因生物信息学分析
根据BLAST(http://www.ncbi.nlm.nih.gov/BLAST)登录的BCH蛋白序列进行氨基酸序列的同源性分析,用DNAMAN软件进行序列多重比对,并绘制系统进化树推断其在进化过程中亲缘关系。采用bioedit软件对BCH蛋白中各个氨基酸的含量、亲水/疏水性进行了分析。WoLFPSORT(http://www.genscript.com/wolf-psort.html)软件进行定位预测,采用Swissmodel(http://swissmodel.expasy.org/)蛋白的三级结构预测。
1.5 表达分析
分别提取桂七、金煌、贵妃芒果果皮的RNA,反转为cDNA 并采用Primer 5.0设计引物进行RT-PCR的扩增。RT-PCR分析采用的内参引物序列为:actin-F,5′-AATGG AACTGGAATGGTCAAGGC-3′;actin-R,5′-TGCCAGATCT TCTCCATGTCATCCCA-3′。目的基因扩增采用的引物为:BCH-F,5′ -CAGCATAGCCCATATAGCACTC-3′;BCH-R,5′-CAATGGAGCCGATATAAAACTAT-3′。PCR 产物在10%琼脂糖凝胶上进行电泳,并采用Quantity One 软件进行数据分析,作出相对表达量。
2 结果与分析
2.1 BCH基因的获得
根据得到金煌芒果BCH基因的3′端和5′端序列信息进行拼接,最后得到BCH基因的全长cDNA序列。设计特异引物,进行全长cDNA序列扩增,将电泳条带回收测序后得到BCH基因的cDNA全长序列,为1160 bp,分析发现开放阅读框为 888 bp,编码295个氨基酸序列。通过NCBI上已经登录的拟南芥、柚子、大豆、葡萄的BCH蛋白序列进行了比对(图1),发现克隆的基因为BCH基因。
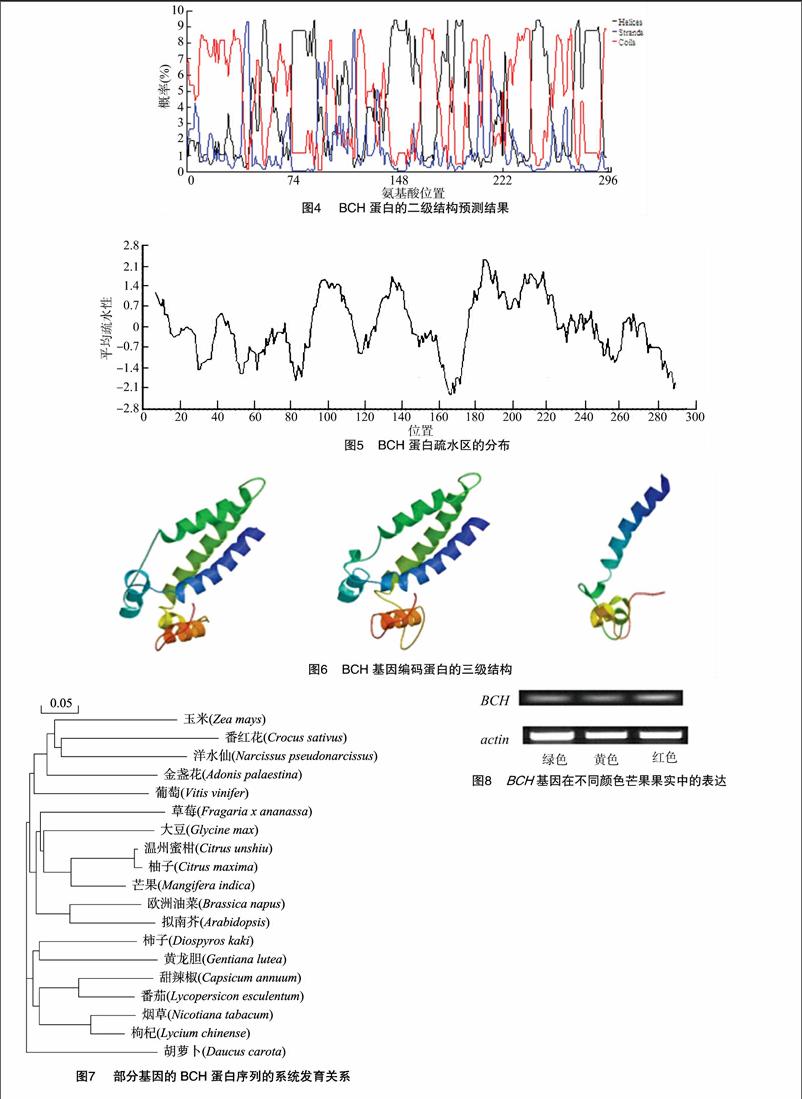
2.2 部分生物信息学分析
采用bioedit软件对芒果BCH蛋白中各个氨基酸的含量进行分析,结果发现,该蛋白丙氨酸(Ala)、谷氨酸(Glu)、甘氨酸(Gly)和缬氨酸(Val)的含量较高(图2),用NCBI 上的CDD(conserved domain database,https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)数据库分析其氨基酸序列中可能有的蛋白功能结构域,结果表明该蛋白有1个典型的FA-hydroxylase superfamily(脂肪酸羟化酶超家族) 保守结构域(图3)。对其蛋白二级结构进行预测,发现芒果BCH蛋白的二级结构以无规则卷曲和β-折叠为主,也具有少量的α-螺旋结构(图4)。采用bioedit软件的Kyte 和Doolittle 算法对BCH蛋白的亲水性/疏水性(正值表示疏水性,负值表示亲水性)进行分析,BCH蛋白所含的氨基酸主要介于2.4~-2.3之间(图5),采用WoLFPSORT(http://www.genscript.com/wolf-psort.html)软件对BCH蛋白进行定位预测,发现该基因定位在叶绿体中,采用Swissmodel(http://swissmodel.expasy.org/)在线软件对蛋白的三级结构进行预测,推导出该蛋白可能的三级结构构型(图6)。采用DNAMAN软件进行亲缘关系聚类分析发现,芒果BCH蛋白与温州蜜柑、柚子、大豆等植物的蛋白序列聚为一类(图7)。endprint
2.3 BCH基因的RT-PCR分析
分别提取桂七、金煌、贵妃这3种不同着色品种芒果果皮的RNA,反转录为cDNA,通过上述RT-PCR分析的引物进行扩增,对扩增结果进行分析发现,该基因在红色品种贵妃的果实中表达较多,绿色品种的桂七果皮中次之,而黄色品种的金煌果皮中相对表达较少(图8),初步推断BCH基因可能与红色品种的贵妃果实中的类胡萝卜素合成有密切的关系。
3 讨论
BCH是玉米黄素生物合成的重要基因,基因编码蛋白的结构特征决定其基因的功能和性质。通过对几个物种的BCH蛋白的比对发现芒果BCH蛋白含有BCH蛋白家族相同的保守序列,即含有一个脂肪酸羟化酶超家族保守结构域,前人通过对拟南芥、玉米、水仙等研究发现,也含有相同的保守结构域,亚细胞定位发现该基因定位于叶绿体中[6],这与本研究结果相一致。通过聚类分析表明,芒果BCH基因与柑橘类具有较近的亲缘关系。对其表达分析发现,红色的贵妃品种中表达量较高, 而黄色的金煌品种中表达量较低。孙化雨等对毛竹的根、幼茎、叶片、叶鞘、节等部分的表达分析发现,BCH基因主要在叶片中表达,而根中表达量较少[7];对转基因拟南芥分析发现,叶片中叶绿素、叶黄素、类胡萝卜素等含量升高,表明在毛竹中BCH基因的过量表达促进了类胡萝卜素向玉米黄素转化,使其含量增加,抗胁迫能力增加[8-9]。本研究从金煌芒果果皮中克隆得到了1个BCH基因,对该基因在芒果中的功能研究还须要进一步通過转基因验证其功能及在对芒果果实色泽形成的作用机理,为深入理解芒果果实色泽形成多样性的原因提供理论依据,并为生产中着色不良成因提供改善的技术支持。
[HS2][HT8.5H]参考文献:
[1] Tian L,Magallanes-Lundback M,Musetti V,et al. Functional analysis of beta- and epsilon-ring carotenoid hydroxylases in Arabidopsis[J]. Plant Cell,2003,15(6):1320-1332.
[2]Sun Z R,Gantt E,Cunningham F X. Cloning and functional analysis of the β-carotene hydroxylase of Arabidopsis thaliana[J]. Journal of Biological Chemistry,1996,271(40):24349-24352.
[3]徐昌杰,陈昆松,张上隆,等. 甜橙β-胡萝卜素羟化酶cDNA克隆及其瞬间反义表达[J]. 农业生物技术学报,2003,11(6):593-597.
[4]冯唐锴,李思光,汪艳璐,等. 南丰蜜橘β-胡萝卜素羟化酶基因的克隆和序列分析[J]. 西北植物学报,2007,27(2):238-243.
[5]Wolfraim L A,Dhindsa R S. Cloning and sequencing of the cDNA for cas17,a cold acclimation-specific gene of alfalfa[J]. Plant Physiology,1993,103(2):667-668.
[6]赵大球,曹春燕,孔 芬,等. 植物β-胡萝卜素羟化酶的生物信息学分析[J]. 生物技术通报,2010(4):116-121.
[7]孙化雨,陈 颖,赵韩生,等. 毛竹β-胡萝卜素羟化酶基因的分子特征及其功能[J]. 林业科学,2015,51(10):53-59.
[8]Kim J,Smith J J,Tian L,et al. The evolution and function of carotenoid hydroxylases in Arabidopsis[J]. Plant & Cell Physiology,2009,50(3):463-479.
[9]Pons E,Alquézar B,Rodríguez A,et al. Metabolic engineering of β-carotene in orange fruit increases its in vivo,antioxidant properties[J]. Plant Biotechnology Journal,2014,12(1):17-27.endprint

