四川紫花白及无菌播种技术研究
姜丽琼,肖欣怡,李文俊,肖前刚*,徐志萍,廖兴勇,陈文灵,李 路
(1.成都市农林科学院,四川 成都 611130;2.成都市实验外国语学校,四川 成都 610031)
四川紫花白及无菌播种技术研究
姜丽琼1,肖欣怡2,李文俊1,肖前刚1*,徐志萍1,廖兴勇1,陈文灵1,李 路1
(1.成都市农林科学院,四川 成都 611130;2.成都市实验外国语学校,四川 成都 610031)
以当年成熟白及果荚种子作为外植体,开展组织培养试验研究。结果表明:最佳外植体诱导培养基为改良MS+0.2 mg·L-16-BA+0.2 mg·L-1NAA, 发芽率可达90%~100%;最佳增殖培养基为改良MS+2.0 mg·L-16-BA+0.3 mg·L-1NAA,增殖系数3.4;最佳生根培养基为改良MS+0.2 mg·L-1NAA+1 mg·L-1AC+50 g·L-1香蕉泥培养基,生根率为95.6%。炼苗基质为腐殖土:珍珠岩:椰糠:河沙=5:1:2:2组合,为白芨移栽最佳基质,移栽苗存活率可达97%。
紫花白及;无菌播种
白及[Bletillastriata(Thunb.ex A. Murray)Rchb.f.]又名白芨、甘根、连及草,为兰科白及属多年生草本球根(块根)植物,高20 cm~60 cm,花色有紫红、白、蓝、黄和粉等色。白及一直作为传统中药,以根茎入药,具有收敛止血、补肺、消肿生肌功效;但随着科技发展白及的应用越来越广,白及在生物医药、保健食品、纺织印染、特种涂料和日用化工等具有重要利用价值,其市场需求量逐年增加,市场价格不断攀升。
四川作为白及的主产区之一,种植面积不断扩大。但现有栽培资源多引自云南、贵州等地。由于引种地域与栽培地自然条件差异较大,且多采用传统根茎分株繁殖进行栽培,不仅成本高、耗种量大、繁殖系数低、种茎易退化,且所引入资源多为未经筛选的野生资源,致使四川现有白及种植品种混杂严重,适应性较差,给四川白及种植户带来巨大风险。开展白及无菌播种技术试验研究,为纯化白及品种及种苗质量,白及产业化开发具有重要学术价值和现实意义,尤其发展林下种植和林下经济具有重要的推动作用。
紫花白及为白及的优良品种。以选育的龙门山脉野生的适应性强,且经济效益高的优良品种紫花白及为研究材料,优选其单株上的果荚作为外植体,进行紫花白及实生苗的无菌组培快繁技术研究,以期为四川本土优良紫花白及种苗工厂化繁殖、育种与白及产业发展奠定技术基础。
1 试验材料
秋季于优良紫花白及单株上采集外形饱满、无病虫害且种皮无破损和裂口的成熟果荚进行试验。
2 试验方法
2.1 外植体灭菌与接种
本试验采取两种消毒方法进行外植体消毒。酒精擦拭消毒:先用75%酒精将果荚外种皮反复擦拭干净,入超净工作台,用75%酒精消毒手和果荚外种皮接种到诱芽培养基上培养,注意接种的过程中镊子不可碰触到果荚种皮外侧。传统消毒法:用自来水清洗果荚后,入餐具洗涤剂液中浸泡10 min,并用软毛刷轻轻刷洗果荚表面,流水冲洗30 min。置于超净工作台上,用75%酒精浸泡30 s,再用0.1%的氯化汞浸泡10 min,无菌水冲洗5次~6次,无菌纸吸干水分,用剪刀剪开外种皮,用镊子夹取种子均匀地洒于诱芽培养基表面。每3 d观察一次,及时清除污染的培养瓶,30 d后统计试验结果。
2.2 诱芽培养基的筛选
以改良MS、1/2改良MS、B5为基本培养基,其中蔗糖30 g·L-1、琼脂5 g·L-1,pH值5.6~5.8;每种培养基均设置6-BA和NAA为(0.2 mg·L-1、0 mg·L-1)、(0.2 mg·L-1、0.2 mg·L-1)、(0.5 mg·L-1、0 mg·L-1)、(0.5 mg·L-1、0.2 mg·L-1)共4个激素处理组合,每个处理播种4瓶,重复3次。播种后,先放入暗培养间培养15 d,待种子萌发露绿后转入光照培养间继续培养,培养温度25℃±2℃,光照强度 1 500 lx~2 000 lx,光照时间14 h·d-1。60 d后统计种子萌发生长情况。
2.3 增殖培养基的筛选
采用改良MS为基本培养基,其中蔗糖30 g·L-1、琼脂5 g·L-1,pH值5.6~5.8;分别添加6-BA(1.0 mg·L-1、2.0 mg·L-1、3.0 mg·L-1)和NAA(0.2 mg·L-1、0.5 mg·L-1、1.0 mg·L-1)共9个激素处理。诱芽培养60 d后,将长势健壮且生长情况基本一致的实生小苗接种到增殖培养基上进行增殖培养,每个处理接种10瓶,每瓶接种15株,重复3次。45 d后统计增殖率。
2.4 生根培养基的筛选
当瓶苗高度为3 cm~4 cm时,选择苗高3 cm以上的健壮植株进行生根培养。以改良MS、1/2改良MS为基本培养基,分别设置NAA(0.2 mg·L-1、0.5 mg·L-1)、AC(0 g·L-1、1.0 g·L-1)、香蕉(0 g·L-1、50 g·L-1)的完全试验。每个处理接种10瓶,每瓶接种15株长势基本一致的组培苗,重复3次。暗培养10 d,待其大部分小苗生根后,再转入光照培养室培养, 20 d后统计生根情况。
2.5 炼苗移栽
将瓶苗从生根培养室移至具有遮阳条件的自然光环境下,逐渐打开瓶盖,摆放7 d后,取出,洗净根部培养基,用0.1%多菌灵浸泡根部15 min。设置以腐殖土、珍珠岩、椰糠、河沙为原料的不同配比炼苗基质,每种基质栽植80株,重复3次。移栽后用75%的遮阳网覆盖,栽植后第7 d、15 d及30 d,交替喷施0.1%多菌灵、甲基托布津或百菌清,移栽60 d后统计成活率。
3 结果与分析
3.1 白及果荚的灭菌
从表1可知,用脱脂棉蘸取75%的酒精对白及果荚进行擦拭消毒和用传统氯化汞浸泡灭菌方法相比,不仅操作相对简单方便,且灭菌效果更好,废弃物对环境污染小,处理起来也非常方便。

表1 2种白及果荚消毒方法的比较
3.2 不同诱芽培养基的诱芽效果
由表2可知,在基本培养基筛选上,以改良MS为基本培养基时,白及种子发芽率都很高,可达95%;以1/2改良MS为培养基时,白及种子的发芽率有所下降;而接种于B5培养基中的白及种子发芽率普遍较低,且植株矮小,叶色偏黄。在激素水平上,添加0.2 mg·L-1NAA的处理组在基本培养基相同情况下,发芽率最高,且芽抽长明显,长势相对较好。综上所述,在紫花白及种子诱导阶段,使用改良MS+6-BA 0.2 mg·L-1+0.2 mg·L-1NAA的诱芽培养基可以获得很好的萌发生长效果。
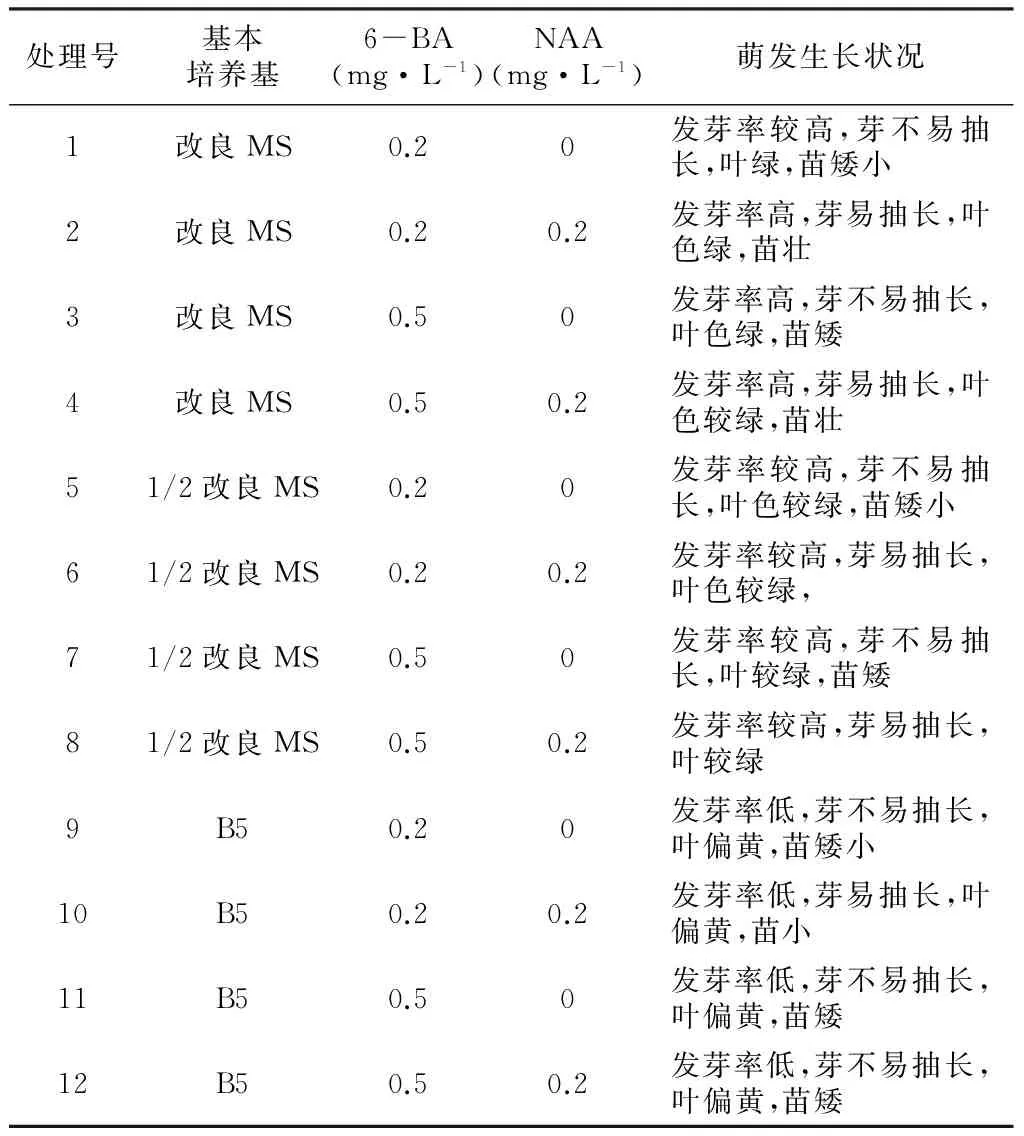
表2 不同培养基下白及种子萌发生长情况
3.3 不同激素组合对增殖系数的影响
由表3可知,随着培养基中6-BA浓度升高,组培苗的增殖系数总体呈现明显的上升趋势,培养基中6-BA的浓度为1.0 mg·L-1时,最大增殖系数为2.51;浓度为2.0 mg·L-1时,最大增殖系数为3.67;当6-BA的添加浓度上升至3.0 mg·L-1时,最大增殖系数为4.76。试验中,当6-BA的浓度超过2.0 mg·L-1时,瓶苗长势弱小且叶色表现偏黄,综合增殖系数和瓶苗生长情况,以改良MS+2.0 mg·L-16-BA+0.3 mg·L-1NAA作为紫花白及的最佳增殖培养基。
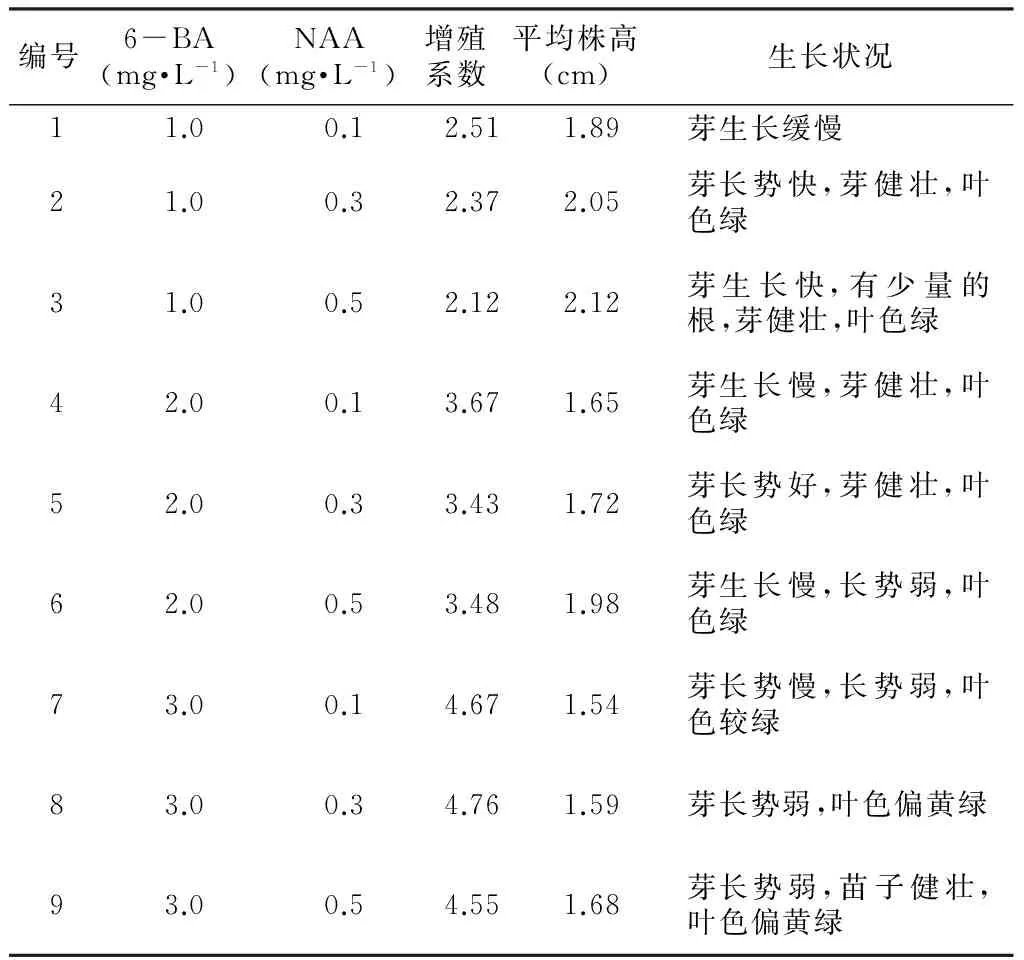
表3 不同激素组合下瓶苗的增殖与生长情况
备注:增殖系数=单个外植体繁殖的个体总数/单个外植体数。
3.4 生根培养试验结果
从表4可知,在白及生根基本培养基的筛选上,所有1/2改良MS处理组瓶苗生长情况均表现为叶色发黄,而以改良MS作为生根阶段基本培养基则叶色正常。在激素水平上,当培养基中NAA浓度由0.1 mg·L-1上升至0.2 mg·L-1时,生根率提高至90%以上,且加入1.0 mg·L-1AC和50g·L-1香蕉泥的处理生根率最高,达到95.6%,平均生根数达到3.71条,瓶苗生根质量好,鳞茎大,根粗壮,叶色浓绿。综上所述,以改良MS+0.2 mg·L-1NAA+1 mg·L-1AC+50 g·L-1香蕉泥培养基为白及最佳生根培养基。
3.5 炼苗移栽
从表5可知,在相同的管理方式下,不同配比炼苗基质下的白及组培苗成活率和生长表现各有不同,在5种不同配比基质中,以腐殖土:珍珠岩:椰糠:河沙为5∶1∶2∶2的组合成活率最高,苗木生长情况最好,最适宜作为白及组培苗的炼苗基质。
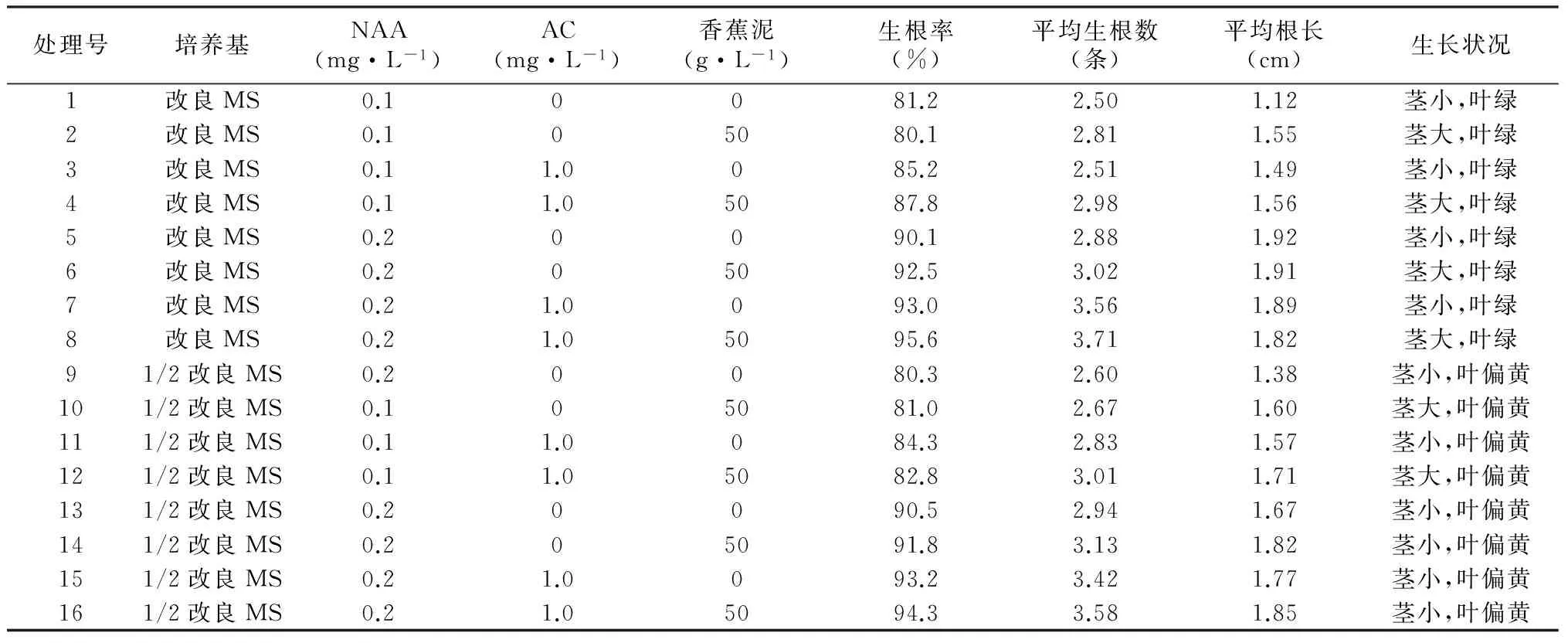
表4 不同生根培养基对白及生根和生长的影响
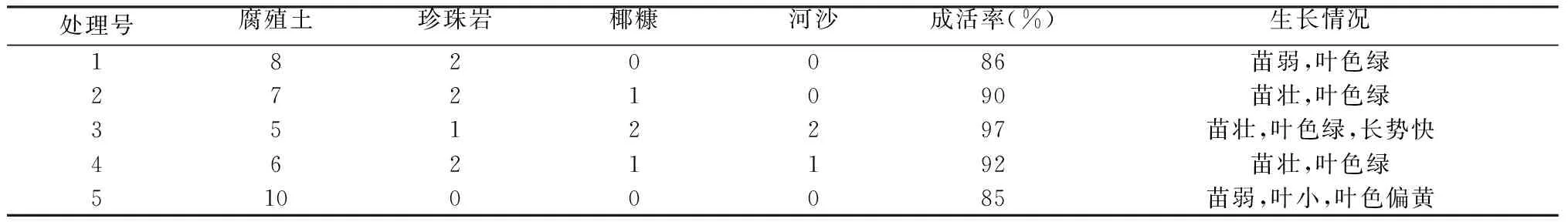
表5 不同移栽基质试验结果
4 结论与讨论
4.1 白及种子无菌接种采用75%的酒精擦拭果荚晾干后,取其种子直接接种,方便、快捷、环保、节约成本、减少开支且接种较均匀,苗子长势好。
4.2 白及种子萌发率与果荚的成熟度呈正相关,成熟度高的白及果荚种子发芽率可达到100%。成熟度低的白及种子发芽率较低,且受培养基的影响较大。芽萌发的基本诱导培养基为改良MS+0.2 mg·L-16-BA+0.2 mg·L-1NAA为最佳。
4.3 继代培养中以改良MS+2.0 mg·L-16-BA+N0.3 mg·L-1AA为白及增殖最佳培养基配方,增殖系数可达3.4以上,且芽苗生长良好。
4.4 生根培养基以改良MS+0.2 mg·L-1NAA+1 mg·L-1AC+50 g·L-1香蕉泥培养基为最佳培养基,生根率达95.6%,平均根数达到3.71条。
4.5 炼苗中选择基质为腐殖土∶珍珠岩∶椰糠∶河沙=5∶1∶2∶2组合,为白及移栽最佳基质,移栽苗存活率可达97%。
[1] 江苏新医学院.中药大辞典[M].上海:上海人民出版社1977:667~670.
[2] 韩学俭.白及药用及其栽培技术[J].农村经济与科技,2004(10):31~32.
[3] 彭丽丽,刘祥东,刘华,等.白及的组培快繁(简报)[J].中国野生植物资源,2004,23(5):65.
[4] 袁宁,何俊蓉,何锐,等.白及组培快繁育苗技术研究[J].西南农业学报,2009,22(3):781~785.
[5] 彭成.中华道地中药材[M].中国中医药出版社,2011.
[6] 陈绍煌.药用植物组培快繁实务[M].中国林业出版社,2016.
ResearchontheAsepticSeedingTechniqueofBletillastriatawithLilacFlowers
JIANG Li-qiong1XIAO Xin-yi2LI Wen-jun1XIAO Qian-gang1*XU Zhi-ping1LIAO Xing-yong1CHEN Wen-ling1LI Lu1
(1.Chengdu Academy of Agriculture and Forestry Science,Chengdu 611130,China;2.Chegndu Experimental Foreign Languages School Class,Chengdu 610031,China)
Taking the ripe seeds that removed from the inflated pods as explant,experiments were conducted on this tissue culture.The results showed that the best inductive medium for explant culture was an improved fromula listed as follows:MS+0.2 mg·L-16-BA+0.2 mg·L-1NAA,and the germination rate could be generally up to 90%~100%;The best enriched medium was an improved formula listed as follows:MS+2.0 mg·L-16-BA+0.3 mg·L-1NAA,and the propagation coefficient was 3.4;The best rooting medium was an improved formula of banana puree substrate listed as follows:MS+0.2 mg·L-1NAA+1 mg·L-1AC+50 g·L-1,and the rate of rooting was 95.6%.The growth substrate was a combination of humus:perlite∶coconut hust∶fluvial sand=5∶1∶2∶2,which was the best transplanting substrate forBletillastriata,and the survival rate of the transplanting reached 97%.
Bletillastriata,Aseptic seeding
2017-07-17
成都市2016年产业集群协同创新重大项目《成都林竹新品种及高效丰产技术研究与示范》支持。
姜丽琼(1978-),女,高级工程师,主要从事林木组培快繁技术研究与应用。
*通讯作者:肖前刚(1968-),男,高级工程师、高级咨询师,主要从事林业生态、林业产业及生态文明建设的应用技术研究与实用技术推广。E-mail:649881440@qq.com
10.16779/j.cnki.1003-5508.2017.06.013
S722.3
A
1003-5508(2017)06-0051-04

