贵州水稻纹枯病菌对噻呋酰胺和己唑醇的敏感性测定
谭清群,何海永,陈小均,陈 文,王莉爽,黄 露,杨学辉
(贵州省植物保护研究所,贵阳 550009)
贵州水稻纹枯病菌对噻呋酰胺和己唑醇的敏感性测定
谭清群,何海永,陈小均,陈 文,王莉爽,黄 露,杨学辉*
(贵州省植物保护研究所,贵阳 550009)
【目的】研究贵州省不同稻区水稻纹枯病菌对噻呋酰胺和己唑醇的敏感性情况,可为水稻纹枯病的科学防治和药剂的合理使用提供参考。【方法】从贵州不同水稻产区采集水稻纹枯病菌标样,对其进行分离、纯化并保存菌株,采用菌丝生长速率法测定38株水稻纹枯病菌对噻呋酰胺和己唑醇的敏感性及其交互抗性。【结果】所有供试菌株对噻呋酰胺的EC50值介于(0.026 4~0.380 2)μg/mL之间,平均 EC50为(0.071 2±0.059 4)μg/mL;所有供试菌株对己唑醇的EC50值介于(0.003 6~0.090 7)μg/mL之间,平均 EC50为(0.025 1±0.015 8)μg/mL。不同地区菌株对噻呋酰胺和己唑醇的敏感性不同,贵阳的菌株对噻呋酰胺的敏感性最高,铜仁地区的最低;黔南州的菌株对己唑醇的敏感性最高,黔东南州的最低。供试菌株对噻呋酰胺和己唑醇的敏感性无显著相关性。【结论】供试菌株对噻呋酰胺和己唑醇具有较高的敏感性,不同地区菌株间敏感性不同。两药剂未产生交互抗性,可以在生产上交替使用。
水稻;纹枯病菌;噻呋酰胺;己唑醇;敏感性
水稻纹枯病是全球普遍发生的水稻重要病害之一,能侵染水稻叶鞘和叶片引起枯斑,也侵染穗颈、茎秆和叶片,使水稻结实率降低,瘪谷率增加,粒重下降,严重影响水稻的产量和品质,发病田块一般减产10%~30%,严重时产量损失可达50%,在我国部分地区,其危害已超过稻瘟病而居首位[1-2]。病原菌无性阶段为立枯丝核菌(Rhizoctonia solani Kühn)半知菌亚门丝核菌属,有性阶段为瓜亡革菌[Thanatephorus cucumeris(Frank)Donk],担子菌亚门亡革菌属[1]。病菌以菌核或菌丝体在土壤、病稻草和其他寄主残体上越冬,并在高温、高湿条件下迅速蔓延,造成纹枯病的大面积发生。近年来,由于感病品种的大面积种植、氮素化肥用量的增加以及全球气候条件的变化,水稻纹枯病发生危害逐年加重,尤其在我国南方稻区的湖南、广东、广西、江西等地,水稻纹枯病已位居水稻三大病害之首[3-4]。目前,水稻纹枯病防治最有效最广泛的方法依然是使用化学药剂[5]。井冈霉素是我国用于防治水稻纹枯病应用最广的微生物源抗生素[6],但由于单一药剂的长期使用将会增加病原菌的抗药性风险[7]。河南、福建等地[8-9]已有井冈霉素抗药性菌株的报道,使得井冈霉素能否继续广泛可持续使用受到挑战。为此,我国近年相继登记了许多井冈霉素的替代药剂,如噻呋酰胺和己唑醇等的单剂及其复配制剂,以缓解井冈霉素用量增加、防效降低[10-11]等问题,从而确保水稻高产稳产。噻呋酰胺属于琥珀酸脱氢酶抑制剂类杀菌剂,具有强内吸传导特性和长持效性,对水稻纹枯病有特效[12],己唑醇属于三唑类脱甲基抑制剂,是一类广谱、高效、内吸性杀菌剂,该药能有效防治子囊菌、担子菌和半知菌引起的病害,尤其对纹枯病、炭疽病等病害防治效果显著[13]。田间药效试验表明,这些药剂对水稻纹枯病的防治效果较好[14-16],但是随着药剂使用年限的延长和剂量的提高,病原菌对药剂的敏感性可能会降低,甚至产生抗药性菌株或群体,给病害防治带来巨大困难。因此,检测水稻纹枯病菌对噻呋酰胺和己唑醇的敏感性,对水稻纹枯病的科学防治和这两种药剂的合理使用具有指导意义。国内外关于水稻纹枯病菌对噻呋酰胺的敏感性研究较少,魏松红等测定了吉林省102株水稻纹枯病菌对噻呋酰胺的敏感性,初步确定将多核菌株的 EC50平均值(0.063 0±0.038 8)μg/mL 作为吉林省水稻纹枯病菌对噻呋酰胺药物的敏感基线[17];Chen Y等通过菌丝生长速率法对安徽省128株水稻纹枯病菌对噻呋酰胺的敏感性进行测定,结果显示所有菌株对噻呋酰胺极其敏感,平均EC50值为(0.05±0.012)μg/mL[18];赵丽静等测定了不同药剂对一株水稻纹枯病菌的毒力,结果表明,水稻纹枯病菌对己唑醇的敏感性最高,其EC50值为0.036 1 μg/mL[19],而水稻纹枯病菌群体对己唑醇的敏感性研究尚未见报道。目前在贵州省实际生产上普遍利用噻呋酰胺和己唑醇及其复配制剂防治水稻纹枯病,但是水稻纹枯病菌对这两种药剂的敏感性及药剂间的交互抗性尚不清楚。从贵州不同水稻产区采集水稻纹枯病标样,并对其进行分离鉴定,测定所获菌株对噻呋酰胺和己唑醇的敏感性,以期为贵州省水稻纹枯病的科学防治与药剂的规范使用提供理论依据,并为农药的减施和少施奠定基础。
1 材料和方法
1.1 供试材料
供试菌株:供试菌株共38株,全部来自贵州省贵阳市、遵义市、铜仁地区、安顺市、黔东南州和黔南州的17个县,其中3株于2013年分离,35株于2014年分离,具体见表1。
供试药剂:96%噻呋酰胺原药、95%己唑醇原药均由张家港保税区百龙达化学品有限公司提供;丙酮(分析纯,重庆川东化工集团有限公司化学试剂厂)。
供试培养基:马铃薯蔗糖琼脂培养基(PSA),配方为:马铃薯200 g,蔗糖20 g,琼脂粉12 g,水1 L。
1.2 研究方法
菌株的分离:参照周而勋等[20](1998)的水琼脂分离法对2013年9-10月和2014年9-10月在贵州省贵阳市、遵义市、铜仁地区、安顺市、黔东南州和黔南州采集的水稻纹枯病菌标样进行病原菌的分离和纯化,共获得38株有效菌株,用马铃薯蔗糖培养基斜面保存于4℃冰箱中,使用时在含有PSA培养基的培养皿上活化。
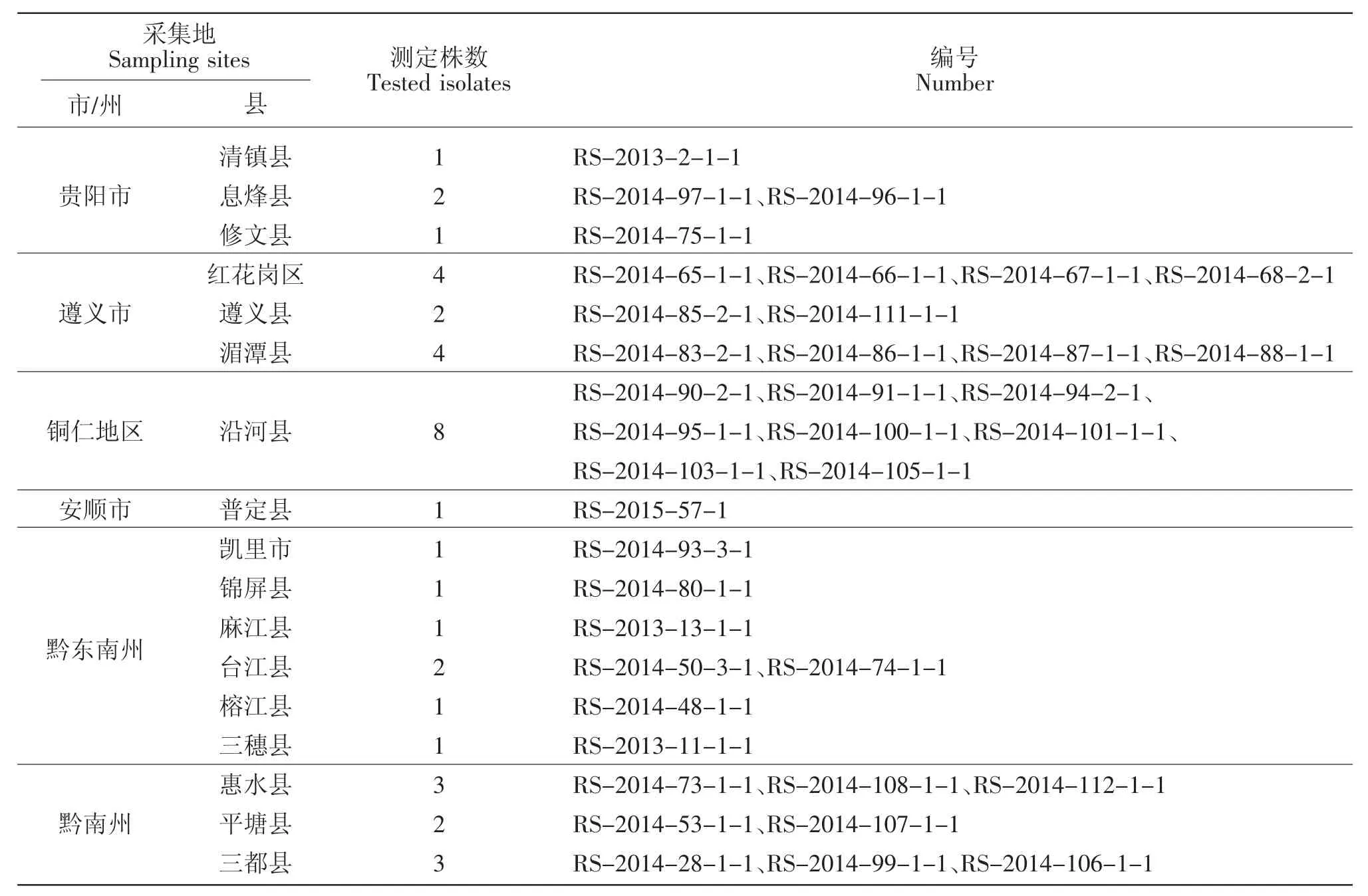
表1 供试菌株来源、数量与编号Table 1 The source,quantity and number of all strains
含药培养基的配置:噻呋酰胺原药(96%)、己唑醇原药(95%)用丙酮分别配置成1 000 μg/mL的母液。待完全溶解后向PSA培养基中添加不同体积的噻呋酰胺和己唑醇母液,分别制成质量浓度为0.007 8、0.015 6、0.031 3、0.062 5、0.125、0.25、0.5和1 μg/mL的含药培养基。
水稻纹枯病菌对噻呋酰胺和己唑醇的敏感性测定:采用菌丝生长速率法[21]测定水稻纹枯病菌的敏感性。将保存的供试菌株接种于PSA培养基平板上,28℃避光培养2 d后,用打孔器沿菌落边缘打取直径5 mm的菌丝块,菌丝面朝下接种于含药培养基培养皿中央,以不含药剂的处理为空白对照,每个处理设置 3个重复,28℃下培养48 h,待对照菌落即将长满培养皿时,采用十字交叉法测量菌落直径。
统计方法:计算各处理的菌落直径均值,并按照下列公式计算菌丝生长平均抑制率:菌丝生长平均抑制率(%)=[(对照菌落直径均值-处理菌落直径均值)/(对照菌落直径均值-接种菌饼直径)]×100%。利用DPS软件,对各处理药剂浓度的对数值(X)和菌丝生长抑制率的概率值(Y)进行回归分析,计算出噻呋酰胺和己唑醇对水稻纹枯病菌菌丝生长抑制的回归方程和抑制中浓度(EC50值)[17]。利用DPS软件的配对T检验比较水稻纹枯病菌对噻呋酰胺和己唑醇的敏感性间有无显著性差异。通过比较两者EC50对数值之间的相关系数和显著性来判断噻呋酰胺和己唑醇之间有无交互抗性。
2 结果与分析
2.1 水稻纹枯病菌对噻呋酰胺的敏感性及其频率分布
采用菌丝生长速率法测定38株水稻纹枯病菌对噻呋酰胺的敏感性,结果显示(见表2):供试菌株的 EC50值介于(0.026 4~0.380 2)μg/mL 之间,平均EC50值为0.071 2 μg/mL,其中采自贵阳市修文县的菌株RS-2014-96-1-1敏感性最高,采自铜仁地区沿河县的RS-2014-73-1-1敏感性最低,两菌株的EC50值相差14.4倍。
在水稻纹枯病菌对噻呋酰胺的敏感性范围内,将所有菌株EC50值等分为几个阶段,以每个阶段EC50的中值为横坐标,统计每阶段菌株的频率,绘制其敏感性频率分布图(见图1),结果显示81.58%的菌株 EC50值介于 0.026 4~0.097 2 μg/mL 之间,表明大部分纹枯病菌菌株对噻呋酰胺的敏感性较高。
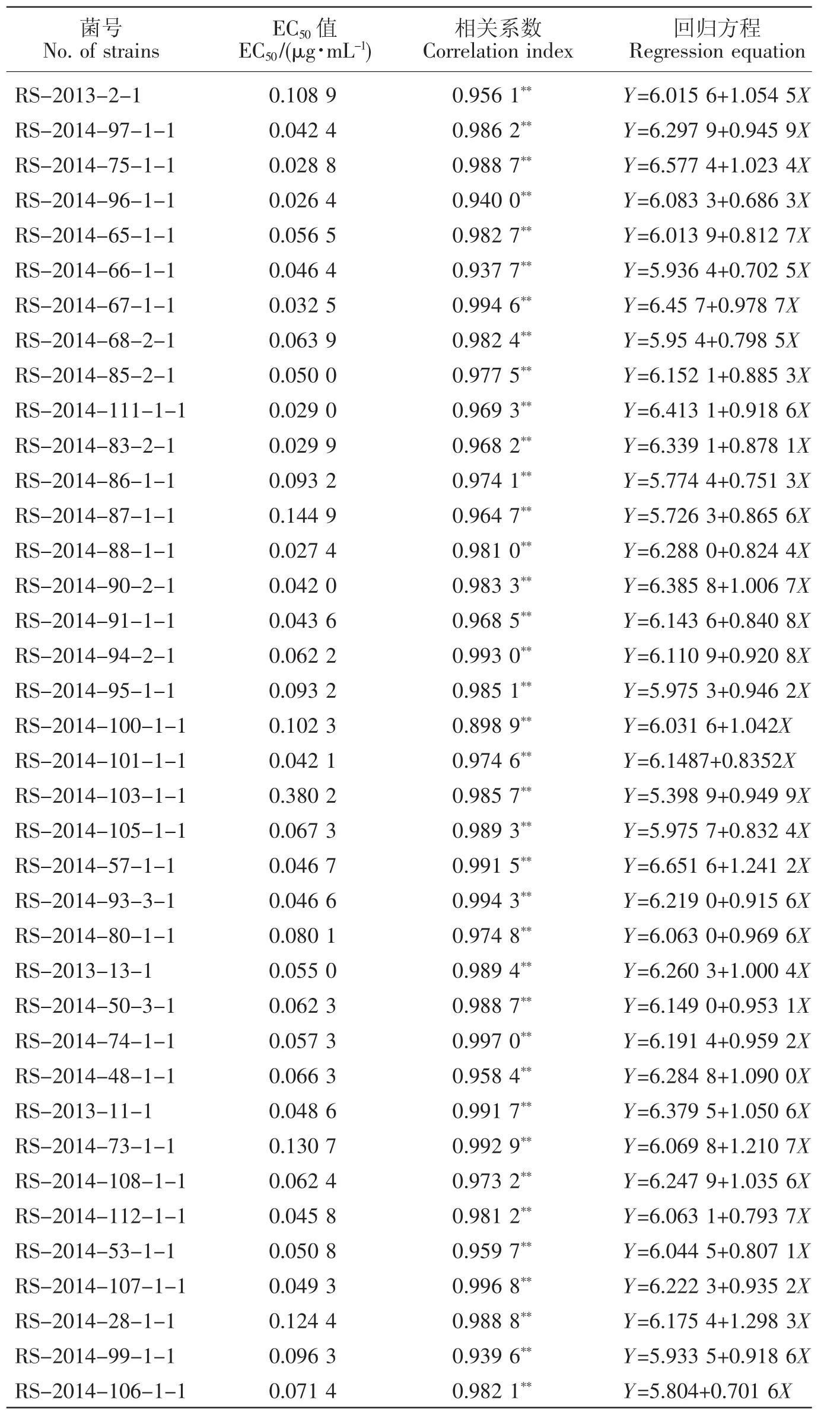
表2 不同水稻纹枯病菌菌株对噻呋酰胺的敏感水平Table 2 The sensitivity of Rhizoctonia solani to thifluzamide
分析不同地区菌株对噻呋酰胺的敏感性可知(由于安顺地区仅有1个菌株,因此未做比较),不同地区菌株的平均EC50值间差异明显(见表3),贵阳地区的菌株对噻呋酰胺的敏感性最高,平均EC50值为(0.052 6±0.030 1)μg/mL,铜仁地区菌株对噻呋酰胺的敏感性最低,平均 EC50值为(0.104 1±0.113 9)μg/mL,平均EC50值高于供试菌株平均EC50值的地区有铜仁地区和黔南州,而贵阳市、遵义市和黔东南州菌株的平均EC50值略低于供试菌株的平均EC50值。各地区菌株平均EC50值的大小关系为:铜仁地区>黔南州>黔东南州>遵义市>贵阳市。

图1 噻呋酰胺对水稻纹枯病菌EC50值的频率分布Figure 1 Frequency of distribution of EC50in Rhizoctonia solania to thifluzamide
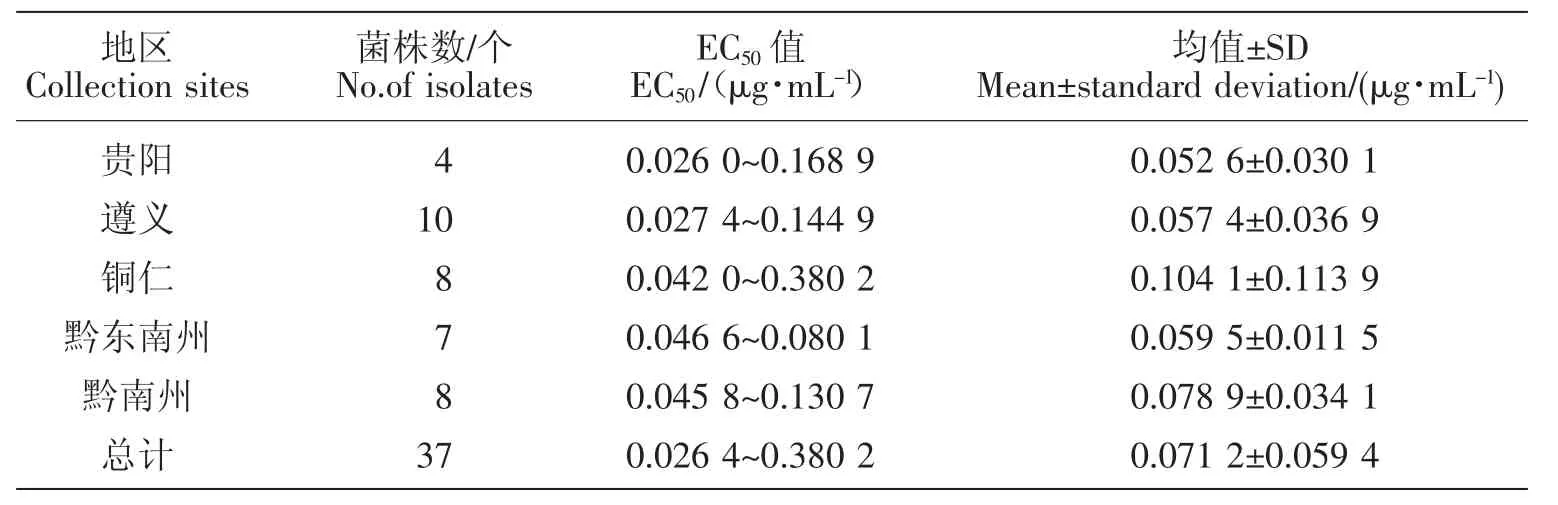
表3 不同地区水稻纹枯病菌对噻呋酰胺的敏感性比较Table 3 Comparison of sensitivity of Rhizoctonia solanito thifluzamide from different regions
2.2 水稻纹枯病菌对己唑醇的敏感性及其频率分布
采用菌丝生长速率法测定38株水稻纹枯病菌对己唑醇的敏感性,结果显示各菌株对己唑醇的敏感性有一定差异(表 4)。平均 EC50值为 0.025 1 μg/mL,来自铜仁地区的菌株RS-2014-101-1-1的EC50值最小,为 0.003 6 μg/mL,EC50值最大(0.090 7 μg/mL)的菌株RS-103-1-1同样也来自铜仁地区,两菌株EC50值相差25.2倍。
在水稻纹枯病菌对己唑醇的敏感性范围内,将所有菌株EC50值等分为几个阶段,以每阶段EC50的中值为横坐标,统计每阶段菌株的频率,绘制其敏感性频率分布图,从水稻纹枯病菌对己唑醇的敏感性频率分布图可知(见图2),各菌株的EC50值分布比较集中,其中 EC50值分布于(0.003 6~0.021 1)μg/mL范围内的菌株数占供试菌株数的39.47%,EC50值分布于(0.021 1~0.038 6)μg/mL范围内的菌株数占供试菌株数的44.74%。

表4 不同水稻纹枯病菌菌株对己唑醇的敏感水平Table 4 The sensitivity of Rhizoctonia solani to hexaconazole

续表(4)

图2 己唑醇对水稻纹枯病菌EC50值的频率分布Figure 2 Frequency of distribution of EC50in Rhizoctonia solani to hexaconazole
比较不同地区菌株对己唑醇的敏感性(由于安顺地区仅有1个菌株,因此未做比较),发现不同地区菌株对己唑醇的敏感性不同见表5,其中黔南州菌株敏感性最高,平均 EC50值为(0.020 9±0.011 4)μg/mL,黔东南州菌株敏感性最低,平均EC50值为(0.029 0±0.008 4)μg/mL,除黔东南州菌株平均EC50值高于供试菌株平均EC50值外,其余地区菌株的平均EC50值均低于供试菌株的平均EC50值。各地区菌株平均EC50值的大小关系为:黔东南州>铜仁地区>遵义市>贵阳市>黔南州。
2.3 水稻纹枯病菌对噻呋酰胺和己唑醇的交互抗性
分别将病原菌对噻呋酰胺和己唑醇的EC50值取对数后计算两者之间的相关系数,结果表明(见图3),两者数据之间无显著相关性(R=0.426 0,P=0.000 2),即噻呋酰胺与己唑醇之间未产生交互抗性,生产上可交替使用。

表5 不同地区水稻纹枯病菌对己唑醇的敏感性比较Table 5 Comparison of sensitivity of Rhizoctonia solani to hexaconazole from different regions
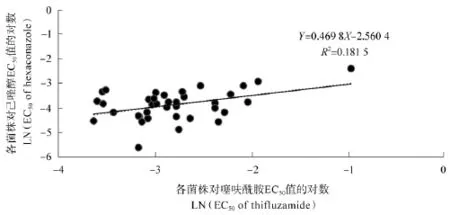
图3 噻呋酰胺和己唑醇的交互抗性Figure 3 Cross-resistance between thifluzamide with hexaconazole
3 讨论与结论
本研究对2013年和2014年采自贵州省贵阳市、遵义市、铜仁地区、黔南州和黔东南州的38个水稻纹枯病菌对噻呋酰胺的敏感性进行了测定,结果表明,供试菌株的 EC50值介于(0.026 4~0.380 2)μg/mL之间,平均 EC50值为(0.071 2±0.059 4)μg/mL。研究测定结果表明,贵州水稻纹枯病菌的平均EC50值高于魏松红等[17],Chen Y.等[18]的结果,可能由于不同地区用药年限、用药量、用药频次和施药方式不同所导致,也可能是水稻纹枯病菌敏感性下降的缘故。不同菌株对噻呋酰胺的敏感性差异也较大,最大 EC50值与最小EC50值间相差14.4倍,表明水稻纹枯病菌对噻呋酰胺存在抗药性风险。因此,应加强水稻纹枯病菌的抗性监测,为指导水稻纹枯病的田间用药奠定基础。
本研究通过分析贵州省不同水稻种植区水稻纹枯病菌对己唑醇的敏感性,发现供试菌株对己唑醇的 EC50值介于(0.003 6~0.090 7)μg/mL 之间,平均EC50为(0.025 1±0.015 8)μg/mL,低于赵丽静等的测定结果,表明贵州水稻纹枯病菌对己唑醇的敏感性较高,尚未产生抗药性[19]。生产上可继续使用己唑醇单剂或复配制剂防治水稻纹枯病,同时应继续多点监测水稻纹枯病菌对己唑醇的敏感性。
贵州不同地区水稻纹枯病菌对噻呋酰胺和己唑醇的敏感性差异明显,对噻呋酰胺而言,贵阳市菌株敏感性最高,铜仁地区菌株敏感性最低,而己唑醇则是黔南州菌株对其敏感性最高,黔东南州菌株对其敏感性最低,这可能与各地使用这两种药剂的年限和频次不同有关,可在采样时对当地农药售卖情况和农民对水稻纹枯病化学防治习惯进行问询调查。
贵州水稻纹枯病菌对噻呋酰胺和己唑醇的敏感性较高,未产生抗药性,两药剂间也未产生交互抗性,因此,这两种药剂可在该地区继续轮换使用。但是,为了防止病原菌快速产生抗药性,生产上除了轮换用药外,还应合理地减少使用剂量和次数。
本研究结果表明,所有供试菌株对噻呋酰胺和己唑醇具有较高的敏感性,不同地区菌株间敏感性不同。噻呋酰胺与己唑醇间未产生交互抗性,可以在生产上交替使用。
[1]陈利锋,徐敬友.农业植物病理学(南方本)[M].北京:中国农业出版社,2001:105-107.
[2]孟庆忠,刘志恒,王鹤影,等.水稻纹枯病研究进展[J].沈阳农业大学学报,2001,32(5):376-381.
[3]TAN W Z,ZHANG W,OU Z Q,et al.Analyses of the temporal development and yield losses due to sheath blight of rice(Rhizoctonia solani AG1.1a)[J].Agricultural Sciences in China,2007,6(9):1074-1081.
[4]廖皓年,肖陵生.水稻纹枯病发生历史及演变原因简析[J].广西植保,1997,10(3):35-38.
[5]陈燕芳.酚菌酮对水稻纹枯病的田间防效[J].浙江农业科学,2016,57(7):1002-1004.
[6]陈小龙,方夏,沈寅初.纹枯病菌对井冈霉素的作用机制,抗药性及安全性[J].农药,2010,49(7):481-483.
[7]BRENT K J,HOLLOMON D W.Fungicide resistance:the assessment of risk[M].Brussels:GCPF,1998:2-23.
[8]张穗,周梅先,宋万昌,等.河南固始等地稻纹枯病菌对井冈霉素敏感性[J].植物保护学报,1999,26(2):189-190.
[9]胡秀荣.水稻纹枯病菌对井冈霉素的抗监测及其风险评估[D].福建:福建农林大学,2006.
[10]孙雪,侯志广,赵晓峰,等.多种药剂对水稻纹枯病菌的毒力测定及田间药效[J].农药,2015,54(2):139-142.
[11]潘战胜,涂子华,张乐雄.6种农药对水稻纹枯病和稻曲病的防治效果[J].生物灾害科学,2015,38(2):140-142.
[12]张宗磊,张建军,郑仕军,等.烯肟菌胺与噻呋酰胺防治水稻纹枯病的室内毒力测定及田间试验[J].农药,2015,54(8):603-605.
[13]张仙平.水稻后期用己唑醇防病又增产[J].农药市场信息,2009(18):43.
[14]张安存,沈礼,秦龙,等.水稻纹枯病防治药剂的筛选试验[J].江苏农业科学,2012,40(1):119-120.
[15]孙祖雄,郑德剑,谢乃官,等.几种药剂防治水稻纹枯病田间药效试验[J].广西农学报,2013,28(5):12-14.
[16]戴德江,王晔青,姚晓明.6种新药剂防治水稻纹枯病效果调查[J].中国植保导刊,2014,34(1):64-65.
[17]魏松红,王海宁,胡积祥,等.吉林地区水稻纹枯病菌对噻呋酰胺药物的敏感基线探讨[J].沈阳农业大学学报,2016,47(3):278-282.
[18]CHEN Y,ZHANG A F,WANG W X,et al.Baseline sensitivity and efficacy of thifluzamide in Rhizoctonia solani[J].Annals of Applied Biology,2012,161(3):247-254.
[19]赵丽静,杨晓楠,李祥英,等.11种杀菌剂对水稻纹枯病菌的毒力比较[J].农药研究与应用,2009,13(5):27-29.
[20]周而勋,杨媚.从植物病组织中分离立枯丝核菌的快速、简便技术[J].华南农业大学学报,1998,19(1):125-126.
[21]陈年春.农药生物测定技术[M].北京:北京农业大学出版社,1991:1-270.
Study on Sensitivity of Rhizoctonia solani of Rice to Thifluzamide and Texaconazole in Guizhou Province
TAN Qing-qun,HE Hai-yong,CHEN Xiao-jun,CHEN Wen,WANG Li-shuang,HUANG Lu,YANG Xue-hui*
(Institute of Plant Protection,Guizhou Academy of Agricultural Sciences,Guiyang 550009,China)
【Objective】In order to to investigate the sensitivity of Rhizoctonia solani to thifluzamide and hexaconazole in Guizhou Province.【Method】The isolates were collected from different regions in Guizhou province,then we separated,purified and saved these isolates.Through mycelial growth rate methods,38 strains were detected the sensitivity and cross-resistance to trifluzamide and hexaconazole.【Results】The results indicated the effective concentration values(EC50) of thifluzamide ranged from 0.026 4 to 0.380 2 μg/mL,with an average value of(0.071 2±0.059 4)μg/mL;And the EC50values of hexaconazole ranged from 0.003 6 to 0.090 7 μg/mL,with a mean of(0.025 1±0.015 8)μg/mL.We found that isolates from different area showed different sensitivities against these two fungicides.The isolates from Guiyang showed the highest sensitivity to thifluzamide while isolates from Tongren was the lowest;The sensitivity of the isolates in Qiannan to hexaconazole was the highest while that in Qiandongnan was the lowest.There was no significiant correlation between the EC50values to thifluzamide and hexaconazole.【Conclusion】The isolates from Guizhou showed high sensitivity against to thifluzamide and hexaconazole and the sensitivity was various in different isolates.Furthermore,no obvious crossresistance observed in these two fungicides,so we can be alternatively used for disease control.
rice;Rhizoctonia solani;thifluzamide;hexaconazole;sensitivity
S432.1 文献标志码:A 文章编号:1000-2650(2017)02-0159-08
10.16036/j.issn.1000-2650.2017.02.004
2016-12-05
贵州省联合基金(黔科合J字LKN[2013]08号)。
谭清群,助理研究员,主要从事植物病原物致病机理及病害防控研究,E-mail:tanqingqun123@126.com。*责任作者:杨学辉,博士,研究员,主要从事蔬菜及水稻病害防控研究,E-mail:yxuehui66@163.com。
(本文审稿:段红平;责任编辑:刘诗航;英文审稿:刘诗航)

