小麦ITMI重组自交系群体的叶片叶绿素含量QTL定位研究
耿小红,武艳芍,杨 林
(1.运城农业职业技术学院,山西运城 044000;2.成都农业科技职业学院现代农业分院,四川成都 611130)
小麦ITMI重组自交系群体的叶片叶绿素含量QTL定位研究
耿小红1,武艳芍1,杨 林2
(1.运城农业职业技术学院,山西运城 044000;2.成都农业科技职业学院现代农业分院,四川成都 611130)
【目的】定位发掘优异的小麦叶片叶绿素含量相关位点,为小麦高抗及高光合育种提供分子基础。【方法】利用已构建的重组自交系群体的高密度遗传连锁图谱对小麦拔节期、抽穗期及灌浆期进行叶片叶绿素含量QTL定位。【结果】结果表明:2013-2014,2014-2015两个环境及3个时期下共检测到18个叶片叶绿素含量相关QTL位点。其中位于小麦染色体 2D(Xcdo534-Xbcd1716)、4D(Xfba177-Xbcd1431)、6A(Xfbb170-Xmwg934)及 6D(Xcdo534-Xbcd1716)4个区段上的叶绿素相关位点在两个环境中都被稳定检测到。位于染色体2D(Xbcd262-Xbcd102)、3D(Xbarc8-Xfba241与Xfbb147-Xgwm3)及6A(Xfbb170-Xmwg934)上4个区段上的叶绿素相关位点在抽穗期及灌浆期均被检测到。【结论】小麦中不同叶片的叶绿素含量受不同遗传机制调控。
小麦;叶绿素含量;QTL;重组自交系群体
小麦是(Triticum aestivum L.)世界上最主要的粮食作物之一。伴随世界人口的急剧增长及作物种植面积的日趋减小,选育突破性高产品种是目前小麦育种的主要目标[1]。植物光合作用通过光合色素(如叶绿素)将CO2和水转为可存储的有机物质,因此光合作用在植物干物质的累积过程中发挥重要作用。过去研究显示,延缓叶绿素降解时间可以增加作物产量,和作物籽粒重量显著正相关[2-3]。除叶绿素稳定周期外,旗叶中叶绿素含量也与籽粒中光合产物累积、籽粒饱满度及单株产量显著相关[4-5]。在小麦中,叶片光合产物对籽粒产量贡献率为67%~73%,旗叶光合产物对籽粒产量贡献达到50%[6]。叶片光合系统容易因过氧化或其他环境胁迫而受到严重破坏,该类破坏可以导致作物的严重减产,产量损失甚至超过50%[7-8]。因此研究高抗且耐环境胁迫的优质种质资源,以发掘到小麦中表达稳定的参与光合作用的基因,对提高小麦抗性及产量稳定性具有重大意义。普通小麦(AABBDD)是由四倍体小麦(AABB)和节节麦(DD)杂交后产生的异源六倍体物种。但仅有极少数四倍体小麦及节节麦的资源参与普通小麦进化历程中,但是大多数普通小麦祖先种或祖先近缘种优异资源尚还未被利用发掘。本研究拟通过以人工合成小麦为亲本构建的重组自交系群体,对小麦灌浆期进行干旱处理后的叶绿素含量进行QTL定位,以发掘到优异的叶绿素含量相关基因,为小麦高抗及高光合育种提供分子基础。
1 材料和方法
1.1 供试材料
本研究采用的主要研究对象为国际小麦作图群体(international titiceae mapping initiative,ITMI),该群体是包括110个株系的F12的重组自交系群体,亲本为人工合成六倍体小麦“W7984”及普通小麦“Opata85”,该群体及其亲本材料由美国农业部种质资源库提供(http://www.ars-grin.gov/)。
重组自交系群体株系、群体亲本“W7984”及“Opata85”于2013—2014,2014—2015年种植于成都农业科技职业学院实验农场。田间设计采用单粒播种,种植行长2 m,单株间距0.1 m,行间距0.3 m,每株系种植5行,常规肥水管理及病虫害防治。
1.2 表型鉴定
叶绿素含量测定采用叶绿素仪(SPAD-502 Plus,Minolta,Japan)测定。每个株系随机采取10株测量,取其平均值。测定时期为拔节期、抽穗期及灌浆期。其中拔节期取样部位为完全展开的倒2叶,抽穗期及灌浆期取样部位为旗叶。
1.3 遗传连锁图谱及QTL定位分析
所有数据均采用SPSS16.0分析软件进行方差分析;ITMI群体遗传连锁图谱来自GrainGenes数据库(http://wheat.pw.usda.gov)[9];QTL 作图采用IciMapping 2.2的完备区间作图法[10];QTL检测步移速度为1.0 cM,LOD阈值为2.5。
2 结果与分析
人工合成小麦“W7984”在拔节期时其倒2叶中叶绿素含量显著高于普通小麦“Opata85”,在抽穗期时旗叶中叶绿素含量显著高于“Opata85”,但灌浆期时“W7984”旗叶中叶绿素含量较“Opata85”低。各生育期下叶片中叶绿素含量在ITMI群体中呈连续性分布,且都存在超亲分离现象(见表1),因此该群体适宜于目标性状的QTL定位研究。相关分析中,拔节期叶绿素含量与抽穗期叶绿素含量及灌浆期相关性不显著,其表型相关系数分别为0.140 3和0.124 1,遗传相关系数分别为0.110 9和0.103 3。抽穗期叶绿素含量及灌浆期叶绿素含量显著相关,其表型相关系数和遗传相关系数分别为0.689 1(P<0.05)和 0.523 0(P<0.05)。结果显示,3 个时期叶片叶绿素遗传力均较高。
两个环境下共检测到5个拔节期叶片叶绿素含量相关QTL,分别位于1D、2A、3A、5B和6D染色体上,解释表型变异率为6.09%~12.79%(见表2,图1)。其中,Qcs-6D在两个环境下都被检测到。Qcs-3A和Qcs-6D对该时期叶绿素含量贡献率超过10%。Qcs-5B和Qcs-6D正向加性效应来源于人工合成亲本“W7984”,其余3个位点正向加性效应来源于普通小麦亲本“Opata85”。
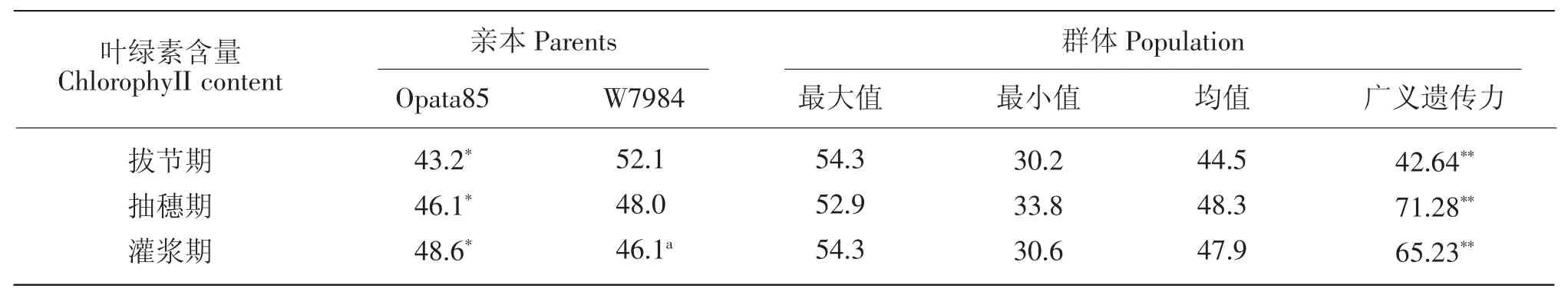
表1 ITMI群体及其亲本表型测定值Table 1 Phenotypic value of ITMI population and their parents
7个抽穗期旗叶叶绿素含量相关QTL被定位于 1B、2D、3D、4D、5D 及 6A 染色体上,其表型贡献率为7.40%~15.27%(见表 2,图1)。其中 Qch-2D、Qch-3D.2、Qch-4D及Qch-5D上QTL对旗叶叶绿素含量表型变异解释率超过10%。Qch-2D及Qch-4D在两个供试环境中都有表达。Qch-1B、Qch-3D.1、Qch-5D及Qch-6A正向加性效应来源于亲本“W7984”,其余3个位点正向加性效应来源于亲本“Opata85”。

表2 ITMI群体目标性状QTL定位结果Table 2 QTLs for objective traits in ITMI population
6个灌浆期旗叶叶绿素含量相关QTL被定位于2D、3D、6A、6B和7B染色体上,解释表型变异率为6.21%~9.54%(见表2,图1)。其中Qcf-2D 及Qcf-6A在两个供试环境中都有表达,除Qcf-2D及Qcf-3D.2两个位点正向加性效应来源于亲本“Opata85”外,其余4个位点正向加性效应来源于亲本“W7984”。
3 讨论与结论
因为叶绿素含量的遗传力较高,且与叶片叶绿素含量相关的主效QTL位点已有报道[6]。V.Verma等[2]在2B染色上发现叶片衰老相关的QTL位点,M.Graziani等检测到2BL染色体上Xgwm1027-Xwmc361区段内存在叶绿素含量相关QTL位点[11]。Zhu X.F.等[6]利用 Jing411×Hongmangchun21 重组自交系群体在2B上克隆到由7个外显子和6个内含子组成的Tabas1-B1基因,该基因控制叶绿素含量及千粒重性状表达,与SSR标记Xgwm47和Xgwm319连锁[12-13]。本研究定位结果中,Qch-2B位于Xgwm319和Xgwm47之间,与Tabas1-B1基因有较高等位性。
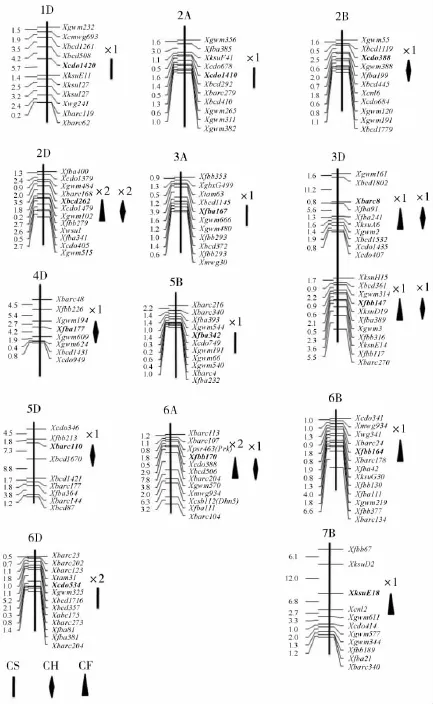
图1 ITMI群体目标性状QTL定位结果Figure 1 QTLs for objective traits in ITMI population
除与控制叶绿素含量相关的主效基因外,微效QTL位点报道也较多。S.Tahmasebi等利用167份F7重组自交系群体(SeriM82×Babax) 在 1B、2B、2D、3B、4B、4D、5A、6A、6D、7A 和 7D 上检测到 11 个灌浆期叶片叶绿素含量相关QTL位点[14]。M.Graziani等利用249份重组自交系群体在16个地中海环境中共检测到8个成熟期旗叶叶绿素相关QTL位点,其中4个在所有供试环境中都表达的QTL分别位于1B、2B、3B 和 6B 染色体上[11]。Yu M.等利用 ITMI群体在苗期检测到3个叶片叶绿素相关位点分别位于染色体5B及7B上[15]。本研究中发掘到的2D、5B、6A、6B、6D及7B上QTL位点与以上位点可能位于同一区间或具有较高等位性,而位于1D、2A、3A、3D、4D及5D上相关位点可能是尚未报道的新位点。
本研究中共检测到的2D(Xbcd262-Xbcd102)、3D(Xbarc8-Xfba241 和 Xfbb147-Xgwm3)及 6A(Xfbb170-Xmwg934)上4个区段同时在抽穗期和灌浆期都有表达。而拔节与抽穗期及灌浆期无公共位点检测,遗传相关分析也得出一致结果,这可能归咎于小麦中发育不同时期的叶片叶绿素含量受到不同遗传机制调控。此外,本研究中检测到的公共位点可能与叶片抗衰老相关,位于2B上的Tabas1-B1基因就被报道具有调控衰老机制[17],因此进一步研究此类位点,对解析小麦抗衰老机制及抗逆境育种具有十分重要意义。
[1]GUPTA P K,RUSTGI S,KUMAR N.Genetic and molecular basis of grain size and grain number and its relevance to grain productivity in higher plant[sJ].Genome,2006,49(6):565-571.
[2]VERMA V,FOULKES M J,CALIGARI P,et al.Mapping QTLs for flag leaf senescence as a yield determinant in winter wheat under optimal and drought environments[J].Euphytica,2004,135(3):255-263.
[3]ZHANG K,ZHANG Y,CHEN G,et al.Genetic analysis of grain yield and leaf chlorophyII content in common wheat[J].Cereal research communication,2009,37(4):499-511.
[4]WANG H,MCCAIG T N,DEPAUW R M,et al.Flag leaf physiological traits in two high-yielding Canada western red spring wheat cultivars[J].Canadian Journal of Plant Science,2008,88(1):35-42.
[5]FENG B,LIU P,LI G,et al.Effect of heat stress on the photosynthetic characteristics in flag leaves at the grain-filling stage of different heat-resistant winter wheat varieties[J].Journal of Agronomy Crop Science,2014,200(2):143-155.
[6]ZHU X F,ZHANG H P,HU M J,et al.Cloning and characterization of Tabas1-B1 gene associated with flag leaf chlorophyII content and thousand-grain weight and development of a gene-specific marker in wheat[J].Molecular Breeding,2016,36(10):142.
[7]CHEN X,ZHANG W,ZHANG B,et al.Phosphoproteins regulated by heat stress in rice leaves[J].Proteome Science,2011,9(1):37.
[8]MURCHIE E H,ALI A,Herman T.Photoprotection as a trait for rice yield improvement:status and prospects[J].Rice,2015,8(1):1-9.
[9]SONG Q J,SHI J R,SINGH S,et al.Development and mapping of microsatellite(SSR) markers in wheat[J].Theoretical Applied Genetics,2005,110(3):550-560.
[10]LI H H,YE G Y,WANG J K.A modified algorithm for the improvement of composite interval mapping[J].Genetics,2007,175(2):361-374.
[11]GRAZIANI M,MACCAFERRI M,ROYO C,et al.QTL dissection of yield components and morpho-physiological traits in a durum wheat elite population tested in contrasting thermopluviometric conditions[J].Crop and Pasture Science,2014,65(1):80-95.
[12]BALLESTEROS D C,MASON R E,ADDISON C K,et al.Tolerance of wheat to vegetative stage soil waterlogging is conditioned by both constitutive and adaptive QTL[J].Euphytica,2015,201(3):329-343.
[13]YANG D L,JING R L,CHANG X P,et al.Quantitative trait loci mapping for chlorophyll fluorescence and associated traits in wheat(Triticum aestivum L.)[J].Journal of Integrative Plant biology,2007,49(5):646-654.
[14]TAHMASEBI S,HEIDARI B,PAKNIYAT H,et al.Mapping QTLs associated with agronomic and physiological traits under terminal drought and heat stress conditions in wheat(Triticum aestivum L.)[J].Genome,2017,60(1):26-45.
[15]YU M,MAO S L,CHEN G Y,et al.QTLs for waterlogging tolerance at germination and seedling stages in population of recombinant inbred lines derived from a cross between synthetic and cultivated wheat genotypes[J].Journal of Integrative Agriculture,2014,13(1):31-39.
[16]BALLESTEROS D C,MASON R E,ADDISON C K,et al.Tolerance of wheat to vegetative stage soil waterlogging is conditioned by both constitutive and adaptive QTL[J].Euphytica,2015,201(3):329-343.
[17]DIANA C,BALLESTEROS R,MASON E,et al.Tolerance of wheat to vegetative stage soil water logging is conditioned by both constitutive and adaptive QTL[J].Euphytica,2015,201(3):329-343.
QTL Mapping for Leaf ChlorophyII Content in ITMI Recombinant Intercross Lines Population of Wheat
GENG Xiao-hong1*,WU Yan-shao1,YANG Lin2
(1.Yuncheng Vocational and Technical College of Agriculture,Yuncheng 044000,Shaanxi,China;2.Chengdu Agricultural College,Agriculture and Horticulture Department,Chengdu 611130,China)
【Objective】 The objective of this study was to expound genetic basic of leaf chlorophyII content in wheat.【Method】A recombinant intercross lines population contain 110 lines were used to perform QTL analysis based on a high density genetic map at jointing stage,heading stage,and filling stage.【Results】12 QTLs for leaf chlorophyII content were identified during 3 periods in both environments of 2013-2014 and 2014-2015.Four QTLs on 2D(Xcdo534-Xbcd1716),4D(Xfba177-Xbcd1431),6A(Xfbb170-Xmwg934),and 6D(Xcdo534-Xbcd1716)were identified in both 2 environments,and 4 common QTLs on chromosomes 2D(Xbcd262-Xbcd102),3D(Xbarc8-Xfba241 and Xfbb147-Xgwm3),and 6A(Xfbb170-Xmwg934)were expressed in both heading stage and filling stage.【Conclusion】Taken together,the chlorophyII content in different leaf are regulated by different genetic mechanism.
wheat;leaf chlorophyII content;QTL;RIL population
S512.1 文献标志码:A 文章编号:1000-2650(2017)02-0139-05
10.16036/j.issn.1000-2650.2017.02.001
2017-01-09
山西省重点研发计划(一般项目)(201603D221001-4)。
耿小红,讲师,主要从事作物遗传育种研究,E-mail:gengxiaohong126@126.com。
(本文审稿:武 晶;责任编辑:刘诗航;英文编辑:刘诗航)

