猪圆环病毒3型半巢式PCR方法的建立和应用
张 志,郝占武,2,杨旭兵,张美晶,吴发兴,李晓成
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛农业大学,山东青岛 266019;3. 青岛易邦生物工程有限公司,山东青岛 266114)
猪圆环病毒3型半巢式PCR方法的建立和应用
张 志1,郝占武1,2,杨旭兵3,张美晶1,吴发兴1,李晓成1
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛农业大学,山东青岛 266019;3. 青岛易邦生物工程有限公司,山东青岛 266114)
为建立快速检测猪圆环病毒3型(PCV-3)的方法,以GenBank上登陆的我国PCV-3全基因组为参考毒株,设计3条引物,建立了 PCV-3半巢式PCR诊断方法。本方法可以扩增出大小为249 bp的特异性条带,与预期大小一致,而猪圆环病毒1型和2型、猪伪狂犬病病毒、猪细小病毒等对照样品均未扩增出特异性条带。将PCV-3的阳性DNA稀释后作为模板,发现半巢式PCR的检测极限可以达到5×10-3μg/mL。对临床80份样品进行检测,发现半巢式PCR的阳性检出率可以达到27.5%(22/80),而常规PCR的检出率仅为6.25%(5/80)。检测结果表明,本文建立的半巢式PCR方法较为准确、特异和敏感,适用于PCV-3的快速检测和流行病学调查。
猪圆环病毒3型;半巢式-聚合酶链式反应;快速检测;流行病学调查
圆环病毒(Circovirus)是目前最小的单链环状DNA病毒,感染宿主比较广泛,可感染家禽、猪、狗、狐狸、鱼类、昆虫等多种动物[1-4]。据报道,感染猪的圆环病毒(Porcine circovirus,PCV)主要有PCV-1和PCV-2两个亚型。其中,PCV-1感染后不引起任何临床症状,PCV-2感染后则会引起断奶仔猪多系统衰竭综合症(PMWS)、皮炎性肾病、渐进性消瘦、呼吸道症状、黄疸、生长发育不良等[5-8]。PCV-2自1998年在我国首次被发现以来,在我国猪群中迅速蔓延,呈现出覆盖面广、感染率高的特征,已成为危害我国猪群的主要病原之一[9-11]。2016年美国学者Phan等[12]报道了一种新猪圆环病毒亚型(PCV-3)。携带该病原的猪呈现生长发育不良、心脏和多系统炎性浸润等病理变化。随后Palinski等[13]也从表现皮炎肾病综合症的猪体内检测到了PCV-3。2017年我国首次从发病猪样品中检测到PCV-3,并测定了该毒株的全基因组[14],然后提交到了GenBank中(PCV3-China/GD2016)。这些研究工作为建立PCV-3的PCR诊断方法提供了借鉴。PCR作为诊断病原最常用的方法,早已在疫病诊断方面被广泛应用,但鉴于PCV-3是一种新发病原,尚没有开展PCR方法的相关研究。本实验室根据此序列,以及前期检测到PCV-3阳性样品的基础上,创建了普通的PCV-3 PCR诊断方法,但是在检测中又发现普通PCR 的敏感性难以满足临床实践需要,因此又进一步研发了半巢氏PCR诊断方法,从而为开展PCV-3在猪群中的流行病学调查、检测和诊断提供了技术支持。
1 材料和方法
1.1 病毒和样品
PCV-3阳性样品(SD66):本实验室鉴定和保存。80份猪临床样品:采集自福建、山东、河南等省份的猪腹泻样品或健康组织。PCV-1、PCV-2、猪伪狂犬病病毒(PRV)、猪细小病毒(PPV):中国动物卫生与流行病学畜病监测室分离鉴定和保存。
1.2 主要试剂
Premix Ex Taq试剂盒:TaKaRa公司产品;病毒DNA提取试剂盒(DNAzol):Life公司产品。
1.3 引物设计和合成
以NCBI 上公开的我国PCV-3全基因组序列(KY418606.1,即PCV3-China/GD2016病毒株)为参考序列,利用DNAStar软件设计3条引物,用于进行半巢式PCR反应。引物序列由北京睿博生科有限公司合成(表1),其中PCV3-F1/2-582为一扩和二扩的共同上游引物。

表1 用于半巢氏PCR扩增的PCV-3引物
1.4 样品DNA提取
根据DNAzol说明书,从猪样品中提取总基因组DNA,−20 ℃保存备用。
1.5 PCR方法和巢式PCR方法的建立
1.5.1第1次PCR扩增 以从PCV-3阳性样品中提取的DNA为模板,用设计引物PCV3-F1/2-582和PCV3-R1-1158作为上下游引物,进行第1次PCR扩增。反应体系:Premix EX-Taq反应液12.5 μL,上游引物和下游引物各1 μL(10 μmol/L),DNA 2 μL,用 ddH2O 补充至 25 μL。反应扩增条件:95 ℃预变性5 min,35个扩增循环(95 ℃ 20 s、55 ℃ 30 s、72 ℃ 35 s),72 ℃ 10 min 。
1.5.2半巢氏PCR方法的建立 以1.5.1获得的PCR扩增产物为模板,以PCV3-F1/2-582和PCV3-R2-830为上下游引物,进行第2次PCR扩增。反应体系:Premix EX-Taq反应液12.5 μL,上游引物和下游引物各 1 μL(10 μmol/L),一扩产物 0.5 μL,用ddH2O 补充至25 μL。巢氏扩增条件:95 ℃预变性5 min,30个扩增循环(95 ℃ 20 s、54 ℃ 30 s、72 ℃ 30 s),72 ℃ 10 min。
1.6 灵敏性试验
将检测为阳性的样品DNA模板分别进行10倍倍比稀释,从50 μg/mL稀释到5×10-6μg/mL共8个稀释度;以不同稀释度为模板,进行半巢式PCR扩增;对扩增产物进行琼脂糖电泳,以能检出清晰特异性的最大稀释倍数为本方法的最小检测极限。
1.7 特异性试验
用已经建立好的方法,同时扩增PCV-1、PCV-2、PRV、PPV等DNA模板,观察巢氏PCR反应结果,确定本方法的特异性。
1.8 重复性试验
用所建立的半巢式PCR法,对3份PCV-3阳性样品分别进行5次重复性试验,检验该方法的重复性和稳定性。
1.9 巢式PCR方法的应用
采用建立的半巢式PCR方法检测临床采集的猪样品,评价本方法的实际临床应用效果。
2 结果
2.1 半巢式PCR方法的建立
以PCV-3阳性DNA为模板,进行温度梯度PCR扩增。第1次、第2次扩增的退火温度分别为55、54 ℃时,第2次扩增可以扩增出与预期大小相符的249 bp的特异性目的条带(图1)。
2.2 半巢式PCR方法的特异性试验
使用半巢式PCR方法,对PCV-1、PCV-2、PPV、PRV进行扩增,均未扩增出特异性条带,而阳性样品则可以扩增出1条大小为249 bp的特异性条带,提示该方法有较高的特异性(图2)。
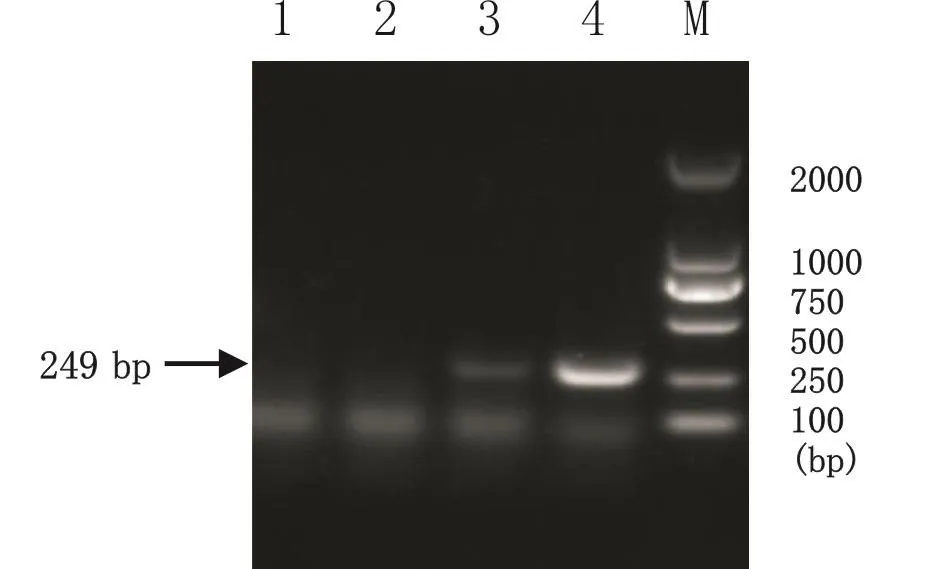
图1 PCV-3的半巢式PCR扩增结果

图2 半巢式PCR方法的特异性试验结果
2.3 半巢式PCR方法的敏感性试验
本方法用10倍倍比稀释递减的阳性样品DNA为模板,进行半巢式PCR扩增和电泳,发现当DNA样品稀释到5×10-3μg/mL时,半巢式PCR还能检测到目的条带,但当DNA样品继续稀释到5×10-4μg/mL时,已经检测不到目的条带,表明本方法的敏感性为5×10-3μg/mL(图3)。
2.4 半巢式PCR的临床应用检测
用本文建立的方法,对80份临床样品进行检测,从中检测到22份阳性样品,PCV-3的感染率为27.5%;从这些特异性条带中挑取5条比较亮的条带送去测序和进行进化树分析,发现这些特异性条带与PCV-3基因组的同源性为95.1%~98.6%。结果表明,这些条带均为PCV-3毒株的特异性序列,也表明本方法具有较高的特异性,可用于临床样品的检测(图4)。

图3 半巢式PCR方法检测PCV-3的敏感性

图4 部分样品用半巢氏PCR的扩增结果
3 讨论
PCR以及由此衍生的巢式PCR等方法是常用的检测病原方法。相对于荧光PCR方法,PCR方法操作简便、容错性高。即使引物上存在少量碱基与靶基因的不同时问题,PCR方法仍可以扩增出靶基因的特异性条带。因此,这种PCR特性给扩增和检测变异毒株提供了便利。这一特性在新发病原的检测中尤其重要。由于新发病原的背景资料一般较少,其基因组结构往往与已知病原存在一定差异,因此PCR方法在新发疫病诊断中能够发挥其独特的作用。本文最初的目的是想建立一种可以在基层推广使用的PCV-3常规PCR检测方法,但用建立的常规PCR方法进行敏感性和临床检测时发现其敏感性不高,对临床样品的检出率非常低,如80份临床样品,用常规PCR仅能检测出5份阳性,阳性率为6.25%(图5)。

图5 部分样品用普通PCR的扩增结果
为了提高灵敏性,在此基础上又进一步研发了半巢式PCR方法,利用两次扩增检测病原,大大提供了敏感性。对上述同样的80份样品进行半巢式PCR检测,能检出22份阳性,阳性率提高到27.5%(图4)。同时进行的敏感性、特异性、重复性等相关试验,均取得了满意效果。随机挑选5条比较亮的扩增特异性条带条进行测序分析,发现该序列与已知PCV-3的同源性为95.1%~98.6%,进一步表明该方法用于临床是可行的。
4 结论
综上研究表明,本文建立的半巢式PCR检测方法具有特异性强、敏感性高、重复性好的特点,可以用于猪群PCV-3的流行病学调查、检测和诊断等领域。
[1] LI L,KAPOOR A,SLIKAS B,et al. Multiple diverse circoviruses infect farm animals and are commonly found in human and chimpanzee feces[J]. Journal of virology,2010,84:1674-1682.
[2] DECARO N,MARTELLA V,DESARIO C,et al.Genomic characterization of a circovirus associated with fatal hemorrhagic enteritis in dog,Italy[J]. Plos one,2014,9:e105909.
[3] BEXTON S,WIERSMA L C,GETU S,et al. Detection of circovirus in foxes with meningoencephalitis,United Kingdom,2009—2013[J]. Emergence infection disease,2015,21:1205-1208.
[4] LORINCZ M,CSAGOLA A,FARKAS S L,et al. First detection and analysis of a fish circovirus[J]. Journal of general virology,2011,92:1817-1821.
[5] TISCHER I,GELDERBLOM H,VETTERMANN W,et al. A very small porcine virus with circularsinglestranded DNA[J]. Nature,1982,295(5844):64-66.
[6] MOROZOVL Z,SIRINARUMITR T,SORDEN D,et al.Detection of a novel strain of porcine circovirus in Pigs with Postweaning multisystemic wasting syndrome[J].Journal of microbiology and biotechnology,1998,36(8):2535-2541.
[7] ELLIS J A,HASSARD L,CLARK E,et a1. Isolation of circovirus from lesions of pig with postweaning multisystemic wasting syndrome [J]. Canadian veterinary journal,1998,39(1):44-51.
[8] CHAE C. A review of porcine circovirus 2-associated syndromes and diseases[J]. Veterinary journal,2005,169(3):326-336.
[9] 郎洪武,张广川,吴发权,等. 断奶猪多系统衰弱综合征血清抗体检测[J]. 中国兽医科技,2000,30(3):3-5.
[10] 陆国林,朱家新,俞国乔,等. 浙江省规模养猪场圆环病毒2型感染的病原学调查[J]. 中国动物检疫,2003,20(8):28-29.
[11] 王忠田,杨汉春,郭鑫. 规模化猪场猪圆环病毒2型感染的流行病学调查[J]. 中国兽医杂志,2004,38(10):3-4.
[12] PHAN T G,GIANNITTI F,ROSSOW S,et al.Detection of a novel circovirus PCV3 in pigs with cardiac and multi-systemic inflammation[J]. Virology journal,2017,14(1):87. Doi:10.1186/s12985-017-0756-y.
[13] PALINSKI R,PIÑEYRO P,SHANG P,et al. A novel porcine circovirus distantly related to known circoviruses is associated with porcine dermatitis and nephropathy syndrome and reproductive failure [J]. Journal of virology,2016,91(1):e01879.
[14] SHEN H,LIU X,ZHANG P,et al. Genome characterization of a porcine circovirus type 3 in South China [J]. Transboundary and emerging diseases,2017:1-3. Doi:10.1111/tbed.12639.
[15] DEZEN D,RIJSEWIJK F A,TEIXEIRA T F,et al.Comparative evaluation of a competitive polymerase chain reaction(PCR)and a SYBRGreen-based realtime PCR to quantify Porcine circovirus-2 DNA in swine tissue samples[J]. Journal of veterinary diagnostic investigation,2011,23(6):1160-1167. Doi:10.1177/1040638711425582.
[16] ZHENG L L,WANG Y B,LI M F,et al. Simultaneous detection of porcine parvovirus and porcine circovirus type 2 by duplex real-time PCR and amplicon melting curve analysis using SYBR Green[J]. Journal of virology methods,2013,187(1):15-19. Doi:10.1016/j.jviromet.2012.06.024.
Establishment and Application of Half Nested-PCR for Porcine Circovirus 3
Zhang Zhi1,Hao Zhanwu1,2,Yang Xubing3,Zhang Meijing1,Wu Faxing1,Li Xiaocheng1
(1. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032,China;2. Qingdao Agricultural University,Qingdao,Shandong 266109,China;3. Qingdao Yebio Biological Engineering Co.,Ltd.,Qingdao,Shandong 266114,China)
In order to establish a method for rapid detection of Porcine circovirus type 3(PCV-3),a new half nested-PCR method was constructed to detect the virus of Porcine circovirus 3(PCV-3)on the base of three primers designed by the conference strain genome from the GenBank. The special band of 249 bp was amplified as the same size as expected. The specific bands were not amplified in the control samples,including PCV-1,PCV-2,PRV and PPV. After series dilution of positive DNA of PCV-3,the available limit of dilution DNA could reach 5×10-3µg/mL to amplify the special band. Meanwhile,application of 80 clinical samples also showed that the positive rate of half nested-PCR could reach 27.5%(22/80),while the detection rate of conventional PCR was only 6.25%(5/80). The results indicated that the half nested-PCR in this research was accurate,sensitive and special,and was suitable for rapid detection and epidemiology investigation of PCV-3.
Porcine circovirus 3;half nested-PCR;quick detection;epidemiological survey
科技部科技基础性工作专项(2012FY111000)
李晓成
S851.3
B
1005-944X(2018)01-0081-04
10.3969/j.issn.1005-944X.2018.01.023
朱迪国)

