上海市规模猪场猪伪狂犬病传播风险因素调查
夏炉明,孙泉云,陈 琦,沈朝建,张 毅,朱九超,卫龙兴,戴连群,赵洪进,沈素芳,卢 军,王曲直
(1. 上海市动物疫病预防控制中心,上海 201103;2. 中国动物卫生与流行病学中心,山东青岛 266032;3. 上海市奉贤区动物疫病预防控制中心,上海 201400)
上海市规模猪场猪伪狂犬病传播风险因素调查
夏炉明1,孙泉云1,陈 琦1,沈朝建2,张 毅2,朱九超1,卫龙兴3,戴连群3,赵洪进1,沈素芳1,卢 军1,王曲直1
(1. 上海市动物疫病预防控制中心,上海 201103;2. 中国动物卫生与流行病学中心,山东青岛 266032;3. 上海市奉贤区动物疫病预防控制中心,上海 201400)
为评估上海市规模猪场(母猪存栏量≥350头)猪伪狂犬病(PR)场群流行率,探寻PR传播的风险因素,通过两阶段随机抽样策略,抽取91个规模猪场,采集母猪血清样品1 349份;采用gpI-ELISA方法进行猪伪狂犬病病毒(PRV)野毒感染抗体检测,同步对采样规模猪场进行问卷调查;将调查的风险因素转换成二分类变量,用Epi infoTM7软件进行单因素分析;筛选出P<0.05的变量,对其进行多因素Logistic回归分析,并建立ROC曲线,计算模型的预测概率。抗体检测结果显示,上海市规模猪场PR场群流行率为62.76%(95%CI:52.82%~72.69%)。多因素Logistic回归分析结果显示:1年内引进种猪(OR:4.84,95%CI:1.53~15.3,P=0.007)、引进公猪精液(OR:10.63,95%CI:0.88~130.41,P=0.06)、病死猪收集场所位于场区内(OR:3.65,95%CI:1.15~11.59,P=0.03)和场内有流浪犬猫(OR:5.12,95%CI:1.47~17.81,P=0.01)是导致PR传播的主要危害性因素;引种/引进精液时检测PRV gE抗体(OR:0.31,95%CI:0.09~1.12,P=0.07)为主要保护性因素。多因素Logistic回归模型建立的ROC曲线下面积为0.844(95%CI:75.3%~93.5%)。本研究掌握了上海市规模猪场PR的流行和分布情况,建立了规模猪场PR场间传播的多因素Logistic风险模型,为上海市规模猪场的PR防控和净化工作提供了依据。
规模猪场;猪伪狂犬病;场群流行率;横断面研究;风险因素
猪伪狂犬病(Porcine pseudorabies,PR)是由伪狂犬病毒(Pseudorabies virus,PRV)引起的急性传染病,主要感染猪、牛、羊、犬,以及野生哺乳动物,其中猪是主要传播者和自然宿主[1-2]。猪群感染PRV后,其临床症状因性别和生长阶段不同而异。如:母猪感染后常出现返情或屡配不孕;怀孕母猪易发生流产,产死胎或木乃伊胎;幼龄仔猪表现为腹泻及神经症状,死亡率可高至100%;育肥猪表现为生长迟缓、饲料报酬降低等[3]。
北美和欧洲的许多国家(如美国、丹麦、德国等)通过实施严格的PR净化计划、大规模免疫gE基因缺失疫苗、监测野毒抗体、淘汰阳性猪只、加强生物安全等策略,已成功在家猪中净化了该病[4]。而我国规模猪场目前仍普遍存在PRV感染。从2012—2015年PRV感染调查结果可以发现,我国华东和华南地区猪群PRV野毒感染率总体呈现上升趋势[5]。我国在《国家中长期动物疫病防治规划(2012—2020)》中,将PR列为优先防治的动物疫病病种,并将其列为种畜禽净化的重点疫病,要求到2020年全国所有种猪场达到净化标准。这给规模猪场PR防控带来严峻挑战和重要机遇[6]。
上海市对2010—2014年采用gE基因缺失疫苗免疫的部分规模猪场母猪群的PRV gE抗体血清学调查显示,母猪群PRV感染抗体居高不下,并呈现逐年上升趋势[7]。为掌握上海市目前规模猪场PRV感染状况,了解场群流行率和分布,寻找场间传播风险因素,本研究通过血清学检测和问卷调查,对上海市91个规模猪场开展了针对性研究,旨在为PR防控和净化提供基础数据和技术支撑。
1 材料与方法
1.1 目标群与研究单元
将上海市所有的128个规模猪场(母猪存栏量≥350头)作为研究的目标群。由于母猪是PR高风险群[8],本研究的研究单元是规模猪场的母猪。
1.2 抽样策略和样本量
采用两阶段随机抽样策略:第一阶段,确定规模猪场抽样数;第二阶段,确定抽取规模猪场内的母猪个体数。规模猪场群体水平抽样框为上海市所有规模猪场(母猪存栏量≥350头)。采用估计流行率方法计算抽样猪场数量,按照95%置信水平,50%预期流行率和5%可接受误差,用Win Episcope 2.0软件计算需要抽取的规模猪场数量为97个。
对于母猪个体水平抽样数量,根据规模猪场母猪数量,按照95%置信水平,18%预期流行率,用发现疫病的方法进行计算,用Win Episcope 2.0计算每场需采集母猪血清样品15份。采用系统随机抽样方法,按照一定间隔,抽取定位栏中的母猪个体。
1.3 检测方法
2015年9—11月,采用横断面研究方法,对规模猪场的生产母猪进行抽样;对血清样品,采用美国IDEXX公司的PRV gE-ELISA抗体检测试剂盒进行PRV野毒感染抗体检测,获得上海市规模猪场PR场群表观流行率和样品阳性率。试验的敏感性Se=98%,特异性Sp=99%[9]。
1.4 病例定义
PR阳性场:PRV gE-ELISA抗体检测试剂盒检出1份及以上母猪阳性个体的规模猪场定义为PR阳性场。
PR阴性场:PRV gE-ELISA抗体检测试剂盒未检出母猪阳性个体的规模猪场定义为PR阴性场。
1.5 潜在风险因素调查
设计《上海市规模猪场猪伪狂犬病风险因素调查表》,对基础信息、饲养管理、生物安全、PR检测和免疫等方面的42个风险因素,展开问卷调查。
1.6 数据分析
1.6.1场群流行率估计 场群表观流行率(HAP)为阳性规模猪场数与总抽样规模猪场数的比值。对场群真实流行率(HTP),结合群敏感性(HSe)和群特异性(HSp)计算,公式为:HTP=(HAP+HSp−1)/(HSe+HSp−1);HSe=1−[1−pSe−(1−p)(1−Sp)]n;HSp=Spn。其中,p是群内预期流行率,Se是ELISA试剂盒的试验敏感性,Sp是试验特异性,n为场内猪只抽样数量[10]。
1.6.2风险因素分析 将血清学检测结果和问卷调查中收集到的猪场饲养管理和生物安全防护等相关信息输入Microsoft excel 2010(所有变量均为二分类变量),以PR阴性场和阳性场为因变量,用Epi infoTM7软件进行单因素分析;将疾病状态和每个解释变量之间的关联通过χ2检验,筛选出P<0.05的变量,对其进行多因素Logistic回归分析;将筛选出P<0.05的变量进行双变量Pearson相关性检验;如果相关系数>0.4,就选择1个最符合生物学逻辑的因素进入Logistic回归模型。应用SPSS 22对最终筛选的变量进行多因素Logistic回归分析。采用Hosmer-lemeshow方法,对建立的模型进行拟合优度检验,选择χ2最大的模型作为最终Logistic模型;对建立的Logistic模型制作ROC曲线,检验模型的预测概率。
2 结果
2.1 规模猪场母猪PR场群流行率
此次调查抽取的97个规模猪场中,由于个别规模猪场未配合采样,以及部分规模猪场的调查问卷填写质量不佳,剔除了6个规模猪场,共检测91个规模猪场1 349份生产母猪血清样品,发现59个规模猪场为PR阳性场,452份母猪血清样品为阳性,规模猪场场群表观流行率(HAP)为64.84%,母猪样品阳性率为33.51%。通过公式计算得到HSe=95%,HSp=86%,HTP=62.76%(95%CI:52.82%~72.69%)。
2.2 不同区域规模猪场母猪PR群流行率分布
将91个规模猪场按照地理区域分类,发现闵行区规模猪场PR场群流行率和母猪PR样品阳性率最高,其次是奉贤区。崇明县由于地理屏障优势,PR场群流行率和母猪PR样品阳性率较其它各区县低。各区县规模猪场PR场群流行率和样品阳性率检测结果见表1。利用ArcGIS 9.3软件,将上海市各区县母猪PRV gE抗体样品阳性率制作成空间分布图(图1)。

表1 不同区域规模猪场PR场群流行率和样品阳性率检测结果
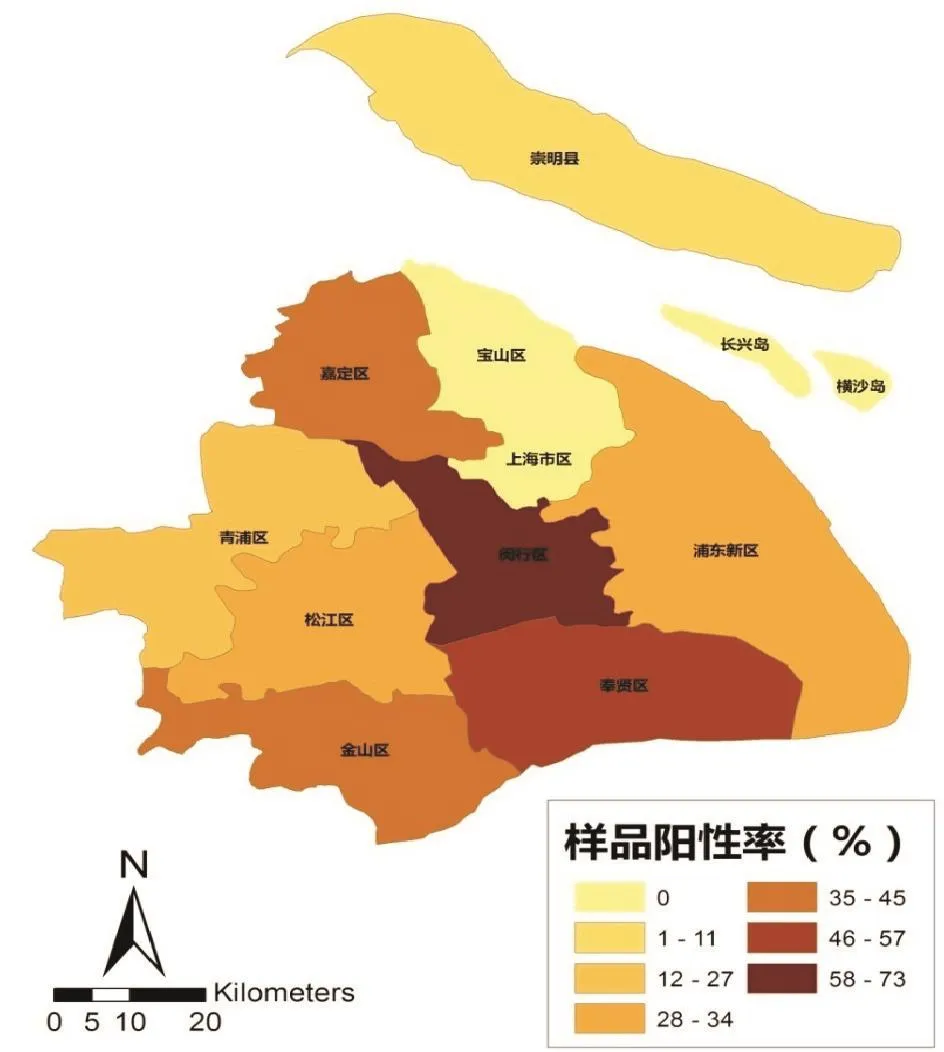
图1 上海市各区县规模场母猪PRV gE抗体样品阳性率空间分布
2.3 风险因素分析
2.3.1单因素分析 对问卷调查收集的23个与PR场间传播相关风险因素进行单因素分析,筛选到12个有统计学意义的风险因素(P<0.05),其中4个风险因素为保护性因素。导致规模猪场PR阳性的危害性风险因素分别是:(1)1年内引进种猪;(2)引进种猪隔离时间<30 d;(3)引进公猪精液;(4)猪场距离主干道≤3 km;(5)驻场人员人均出入场区频率≥4次/月;(6)病死猪收集场所位于场区内;(7)全场定期消毒频率≤4次/月;(8)场区内有流浪犬猫。此外,单因素分析得出4个保护性因素:(1)引种/引进精液时检测PRV gE抗体:(2)外来人员经淋浴后进入生产区;(3)外来车辆喷雾消毒后进入场区;(4)商品猪免疫次数≤2次。具体结果见表2。
2.3.2多因素Logistic回归分析 筛选出单因素分析P<0.05的12个因素;对这12个变量进行Pearson相关性检验,发现“引进公猪精液”和“引进种猪隔离时间<30 d”的Pearson相关系数>0.4,说明“引进公猪精液”更符合生物学逻辑,因此选择该风险因素进入Logistic回归模型。另外发现,“商品猪免疫次数≤2次”单因素分析为保护性因素。原因是PR阳性规模场防控压力大,从而更倾向于提高商品猪免疫次数,具有一定的干扰性。因此,该因素不进入Logistic模型分析。多因素Logistic回归结果显示:最终进入Logistic回归模型的危害性风险因素为“1年内引进种猪”“引进公猪精液”“病死猪收集场所位于场区内”和“场内有流浪犬猫”;保护性因素为“引种/引进精液时检测PRV gE抗体”(表3)。Hosemer-lemeshow拟合优度检验χ2=7.58(df=7,P=0.37>0.05),说明进入模型的风险因素与预期风险因素无统计学差异,模型拟合优度较好。根据以上变量建立上海市规模猪场PR传播概率模型:Log P/(1−P)= −1.36+1.57X1+2.36X2−1.16X3+1.3X4+1.63X5。ROC曲线显示,该模型预测PR的场间传播概率为84.4%(95%CI:75.3%~93.5%,图2)。
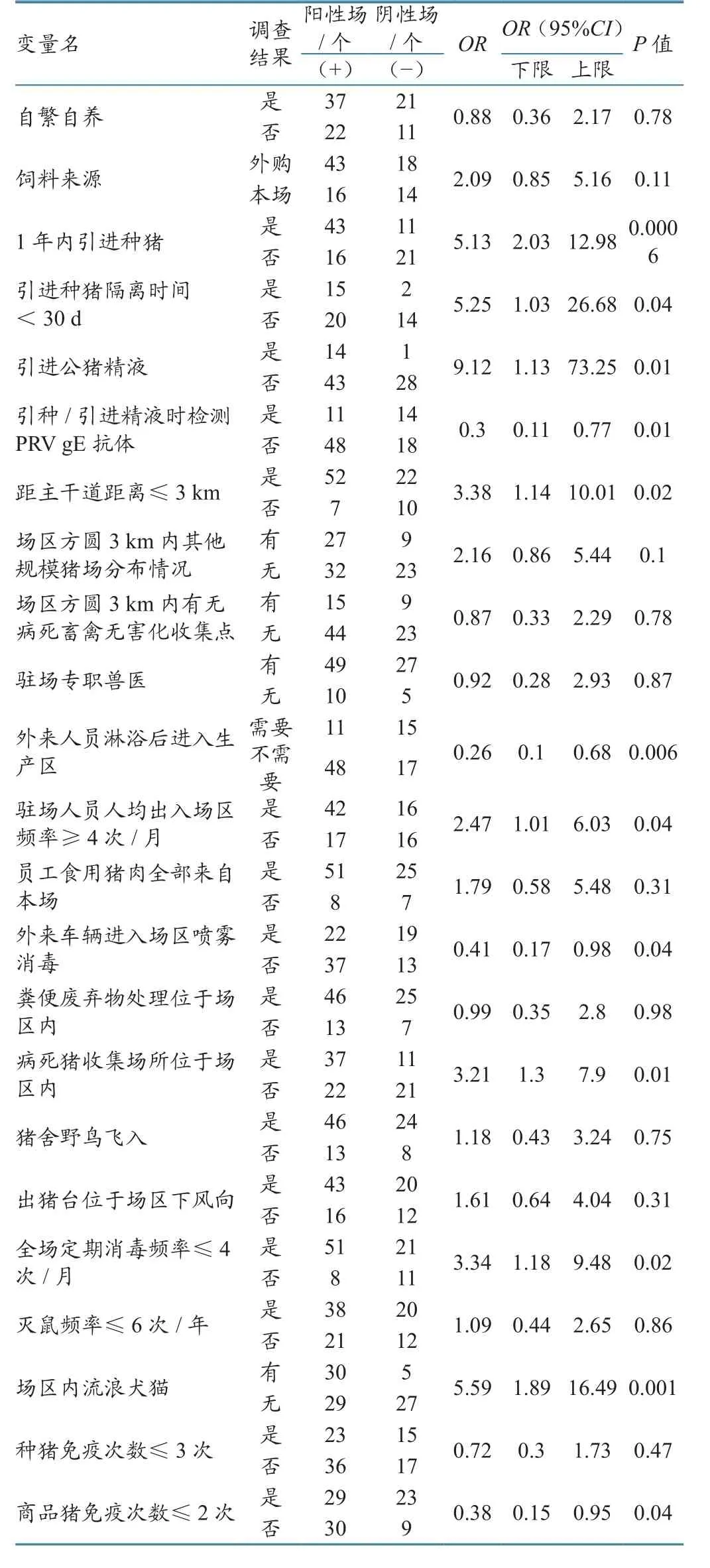
表2 上海市规模猪场PR场间传播风险因素单变量分析结果
3 讨论
本研究首次将上海市所有128个规模猪场(母猪存栏量≥350头)作为研究的目标群,通过概率抽样的方法,来了解PR场群流行率,并结合问卷调查对导致规模猪场PR场间流行的风险因素进行研究。结果显示,上海市规模猪场PR场群流行率高达62.76%(95%CI:52.82%~72.69%),表明上海市规模猪场PRV感染状况不容乐观,污染面较大。本研究建立的规模猪场PR场间传播风险因素Logistic回归模型发现,“1年内引进种猪”“引进公猪精液”“病死猪收集场所位于场区内”和“场内有流浪犬猫”为主要危害性因素[11],同时发现“引种/引进精液时检测PRV gE抗体”为主要保护性因素。这些关键风险因素获得,将对上海市规模猪场下一步的PR防控和净化具有指导和实践意义。

表3 上海市规模猪场PR场间传播风险因素多变量Logistic回归分析结果

图2 回归模型的ROC曲线(曲线下面积0.844)
结合单因素分析和Logisitic回归分析结果,建议上海市规模猪场PR防控和净化应从以下几个方面加强各项措施落实:首先,谨慎引种或引进公猪精液,在必须引种或引进公猪精液的情况下,要做好引种和引进精液前PRV gE抗体的检测工作。其次,加强生物安全措施。如:外来人员(销售人员,官方兽医等)进入生产区必须淋浴并更换工作服后方可进入;驻场人员出入场区的频率不高于4次/月;全场定期消毒频率不低于4次/月;驱逐场区内的流浪犬、猫。由于上海市病死畜禽是统一送市动物无害化处理中心集中处理,收集病死猪的无害化车辆串场可能会带来一定的疫情隐患,因此规模猪场病死猪的收集场所要距场外200 m以上为宜。最后,要做好主要疫病的定期监测,严格淘汰PRV gE抗体阳性猪只[12]。
本研究的局限性在于:一是用发现疫病方法抽取群内母猪个体时,预期流行率设定为18%,导致群内流行率低于18%的规模猪场很难被发现而被认定为阴性场。结合PRV生物学特征,该病毒除可通过直接接触传播外,还可经空气传播。有研究显示,PRV在拥挤、中等湿度和低空气更换量猪舍,通过气溶胶传播的能力很强[13],极易迅速蔓延,因此18%的预期流行率对阳性场的鉴别影响不大。二是在群内个体抽样检测方面,针对的是生产母猪,未选择种公猪、仔猪及育肥猪。规模猪场母猪由于饲养周期长,妊娠母猪感染本病时,还可通过垂直传播方式感染胎儿,因此母猪群是PRV感染的高风险群,也是PR防控净化的关键群[7,14]。本研究针对规模猪场母猪群开展的PRV野毒感染抗体血清学调查,有助于了解和评估上海市猪群的整体感染状态。从血清流行病学调查的角度而言,母猪的血清学调查结果更为准确。因为仔猪体内的gE抗体既可能是由于PRV感染所致的,也可能是来源母源抗体。三是问卷调查结果存在一定的信息偏倚。本研究在风险因素问卷设计上,综合了近年来上海市规模猪场PR防控和净化工作的短板和瓶颈,并经专家多次讨论后定稿。但本次问卷调查,主要依靠本市各区县动物疫病控制中心去开展,加上问卷的预调查和培训工作比较欠缺,从而导致调查人员和规模猪场技术人员对某些问卷问题的理解不一致、不全面。
4 结论
上海市规模猪场PR场群流行率为62.76%,PRV污染面较广。“1年内引进种猪”“引进公猪精液”“病死猪收集场所位于场区内和场内有流浪犬猫”是导致PRV场间传播的主要危害性因素;“引种/引进精液时检测PRV gE抗体”为主要保护性因素。综合问卷调查和风险因素分析结果,建议规模猪场谨慎引种或引进公猪精液;在引种/引进公猪精液前,需要进行PRV gE抗体检测;加强生物安全措施;做好主要疫病定期监测工作,严格淘汰PRV gE抗体阳性猪只。
[1] 陈溥言. 兽医传染病学[M]. 5版. 北京:中国农业出版社,1980:218-220.
[2] 吴发兴,邹敏,董雅琴,等. 犬源伪狂犬病病毒的分离鉴定及主要毒力基因分子特征分析[J]. 中国动物检疫,2017,34(9):96-100.
[3] 李春华,王英,蒋凤英,等. 猪伪狂犬病研究进展[J].动物医学进展,2008,29(3):68-72.
[4] ARJAN S. Aujeszky's disease(pseudorabies)virus eradication campaign in the Netherlands[J].Veterinary microbiology,1997,55:175-180.
[5] WU R,BAI C Y,SUN J Z,et al. Emergence of virulent pseudorabies virus infection in Northern China[J]. Journal of veterinary science,2013,14(3):363-365.
[6] 国务院办公厅. 关于印发国家中长期动物疫病防治规划(2012—2020)的通知》:国办发[2012]31号[A]. 北京:国务院,2012.
[7] 夏炉明,陈琦,戴连群,等. 2010—2014年上海规模猪场母猪群猪伪狂犬狂犬病毒感染抗体血清学调查[J].中国传染病学报,2015,23(5):75-78.
[8] KRAMER T,GRECO T M,LYNN W E,et al.Proteomic characterization of pseudorabies virus extracellular virions[J]. Journal of virology,2011,85(13):6427-6441.
[9] MOYNAGH O S,FODOR N,FODOR I. Indirect ELISAs based on recombinant and affinity-purified glycoprotein E of Aujeszky's disease virus to differentiate between vaccinated and infected animals[J]. Acta veterinaria hungarica,1999,47(1):137-150.
[10] 沈朝建,王幼明. 兽医流行病学调查与监测抽样技术手册[M]. 北京:中国农业出版社,2013:22-24.
[11] WU T,GUO X L,CHAO L,et al. A live,attenuated pseudorabies virus strain JS-2012 deleted for gE/g Iprotects against both classical and emerging strains[J].Antiviral research,2016,130:110-117.
[12] SUN Y,LUO Y Z,WANG C H,et al. Control of swine pseudorabies in China:Opportunities and limitations[J].Veterinary microbiology,2016,183:119-124.
[13] GILLESPIE R R,朱庆虎. 猪伪狂犬病气溶胶感染及排毒[J]. 国外畜牧学-猪与禽,1997,17(1):15-17.
[14] GARY S. Preferential sexual transmission of pseudorabies virus in feral swine populations may not account for observed seroprevalence in the USA[J]. Preventive veterinary medicine,2012,103:145-156.
A Survey on the Risk Factors of Porcine Pseudorabies Transmission in Scaled Swine Farms of Shanghai City
Xia Luming1,Sun Quanyun1,Chen Qi1,Shen Chaojian2,Zhang Yi2,Zhu Jiuchao1,Wei Longxing3,Dai Lianqun3,Zhao Hongjin1,Shen Sufang1,Lu Jun1,Wang Quzhi1
(1. Shanghai Animal Disease Prevention and Control Center,Shanghai 201103,China;2. China Animal Health and Epidemiology Center,Qingdao,Shangdong 266032,China;3. Fengxian District Animal Disease Prevention and Control Center,Shanghai 201400,China)
In order to evaluate the herd prevalence of Porcine pseudorabies(PR)in scaled swine farms(sow number≥ 350)of Shanghai City and to identify the risk factors of PR transmission,1 349 sow serum samples were collected in 91 scaled swine farms by two-stage random sampling strategy. Detection of antibody to PRV field strain was carried out by gpI-ELISA,and the questionnaire survey on the scaled swine farms was implemented at the same time.All the risk factors were converted to binary variables and univariate analysis was carried out by Epi infoTM7. Variables(P< 0.05)were screened and analyzed by multivariate logistic regression analysis,and the ROC curve was established to calculate the predicted probability of Logistic regression model. The antibody test results showed that the herd prevalence of PR in Shanghai City was 62.76%(95%CI:52.82%-72.69%). The multivariate Logistic regression analysis results indicated that the introduction of boar in 1 year(OR :4.84,95%CI:1.53-15.30,P=0.007),the introduction of boar semen(OR :10.63,95%CI:0.88-130.41,P=0.06),the collection station of dead swine was located in swine farm(OR:3.65,95%CI:1.15-11.59,P=0.03),the street dogs and cats were found in farm(OR:5.12,95%CI:1.47-17.81,P=0.01)were significant risk factors of PRV transmission,and testing the gE antibody while introducing boar semen(OR :0.31,95%CI:0.09-1.12,P=0.07)was a significant protective factor. The area under ROC curve was 0.844(95%CI:75.3%-93.5%). Through this study,the prevalence and distribution of PR in scaled swine farms of Shanghai City were recognized,and a multi-factor Logistic risk model of PR field spread in scaled swine farms was established,which could provide guidance for PR prevention,control and purification of scaled swine farms in Shanghai City.
scaled swine farm;porcine pseudorabies;herd prevalence;cross-sectional study;risk factor
S851.3
A
1005-944X(2018)01-0001-06
10.3969/j.issn.1005-944X.2018.01.001
国家重点研发计划项目(2017YFC1200500);上海市生猪产业体系建设(沪农科产字(2017)第6号)
朱迪国)

