320排CT双入口灌注参数预测肺癌纵隔淋巴结转移的应用价值
刘佩, 宋雅信, 常丽洋, 高剑波, 岳松伟
·胸部影像学·
320排CT双入口灌注参数预测肺癌纵隔淋巴结转移的应用价值
刘佩, 宋雅信, 常丽洋, 高剑波, 岳松伟
目的探讨肺癌原发灶的双入口技术灌注成像参数与纵隔淋巴结转移的关系及其诊断效能。方法对61例经术后病理证实的肺癌患者行320排CT灌注成像(CTPI)检查,运用双入口(dual-input,DI)模式对图像进行后处理,采用两独立样本t检验分析纵隔淋巴结转移与肺癌原发灶的DI-CTPI参数的关系,并运用ROC曲线分析DI-CTP参数对肺癌合纵隔淋巴结转移的诊断效能。结果有淋巴结转移组(27例)支气管动脉血流量(BAF)高于无淋巴结转移组(34例),差异有统计学意义(t=4.173,P<0.001);有淋巴结转移组的灌注指数(PI)低于无淋巴结转移组,差异有统计学意义(t=-3.378,P=0.001);两组肺动脉血流量(PAF)间的差异无统计学意义(P>0.05)。三个参数中,BAF的ROC曲线下面积(AUC)最大(0.773),以BAF>56.42mL/(min·100mL)作为预测肺癌纵隔淋巴结转移的临界值时,敏感度为74.1%,特异度为76.5%;PI的AUC为0.739,以PI<41.57%作为预测纵隔淋巴结转移的临界值时,敏感度为82.4%,特异度为66.7%。结论肺癌DI-CTPI参数对术前预测肺癌是否发生纵隔淋巴结转移有重要参考价值,从而可为肺癌的术前分期及治疗方案的制定等提供参考。
体层摄影术,X线计算机; 灌注成像; 肺癌; 淋巴结转移
近年来肺癌的发病率及死亡率仍居于所有恶性肿瘤的首位。由于患者的早期临床症状不典型,一经发现大多数已处于病程中晚期,2/3患者在确诊时已无手术机会、预后较差。因此早发现、早诊断、早治疗对肺癌患者的预后及生活质量的提高有重要的临床价值。临床治疗方案的制定及预后评估与肺癌的准确分期、分级密切相关。术前如能对肿瘤作出明确的诊断和精确的分级、分期有助于治疗方案的选择,从而可改善患者的生存质量、提高生存期。
材料与方法
1.一般资料
搜集本院经病理证实且行淋巴结清扫术的61例肺癌患者的病例资料。其中男36例、女25例,年龄32~67岁,中位年龄57岁。61例中腺癌24例、鳞癌21例、小细胞肺癌15例、神经内分泌癌1例;有纵隔淋巴结转移者27例,无纵隔淋巴结转移者34例。
纳入标准:①患者年龄18~70岁,身高体重指数(body mass index,BMI)小于30kg/m2;①经病理证实;②临床资料完整;③无碘对比剂过敏;④无近期服用二甲双胍等药物史;⑤无心、肝、肾功能不全及精神障碍;⑥检查前未行任何治疗;⑦呼吸频率过快,经呼吸训练后仍不能配合者。
2.检查方法及图像后处理
检查前详细向患者说明检查方式、步骤及目的,取得患者同意,避免患者产生紧张情绪。②检查前对患者进行呼吸训练,嘱患者深吸气后屏住呼吸,持续时间至少约30 s,如患者不能配合屏气,嘱其轻慢呼吸。
使用Toshiba Aquilion One 320排螺旋CT机。先进行行CT平扫,扫描参数:80 kV,80 mA,0.5 s/r。根据平扫图像明确病变部位,确定肺灌注扫描范围(应包括肺动脉干、左心房、病变及胸主动脉),然后行肺灌注成像(CT perfusion imaging,CTPI)扫描:患者取仰卧位,深吸气后屏住呼吸,同时采用高压注射器经肘静脉依次注入对比剂碘海醇(350 mg I/mL)35~40 mL和生理盐水30 mL,注射流率5 mL/s;对比剂注射2 s后启动灌注扫描,每隔2 s扫描一个序列,共扫描15个序列,总扫描时间为30 s。
将扫描数据传入随机软件包中的体部肿瘤灌注软件(dual-input body perfusion,DI)中,先进行图像对位,以消除呼吸及运动伪影。然后将主动脉、肺动脉干认定为输入动脉,以左心房内对比剂达峰值的时间点作为区分体循环(峰值时间后)与肺循环(峰值时间前)的界值。经后处理获得三个灌注参数的伪彩图,包括肺动脉血流量(pulmonary artery flow,PAF)、支气管动脉血流量(bronchial artery flow,BAF)及灌注指数(perfusion index、PI)。在肺肿块内手动勾勒感兴趣区(ROI)进行灌注参数值的测量,每个病灶选取3个ROI进行测量,取其平均值。选取ROI时需避开肉眼可见的血管、肺组织、钙化和液化坏死等。
3.统计学分析
采用独立样本t检验分析纵隔淋巴结转移与肺癌原发灶的灌注参数值的关系,并运用ROC曲线分析各项灌注参数对肺癌合并纵隔淋巴结转移的诊断效能。
结 果
两组患者的灌注参数值及统计分析结果见表1。有纵隔淋巴结转移组(图1)的BAF高于无转移组(图2),PI低于无转移组,差异均有统计学意义(P<0.05);两组间PAF的差异无统计学意义(P>0.05)。三个灌注参数中,BAF的ROC曲线(图3)下面积最大(0.773),当以BAF=56.42 mL/(min·100mL)作为预测肺癌纵隔淋巴结转移的临界值时,敏感度为74.1%,特异度为76.5%;PI的曲线(图4)下面积为0.739,以PI=41.57%作为预测纵隔淋巴结转移的临界值时,敏感度为82.4%,特异度为66.7%。
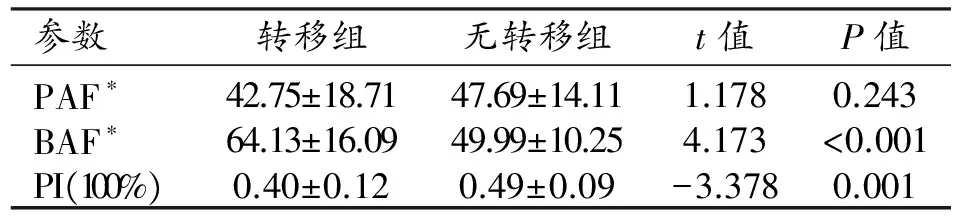
表1 两组的DI-CTPI参数的比较
注:*单位为mL/(min·100mL)。
讨 论
肺内有两套血液循环系统,包括体循环和肺循环。体循环主要作用是为淋巴结、支气管和胸膜等组织结构提供营养物质;肺循环的主要作用是气体交换,其占肺脏血液总灌注量的98%左右。虽然体循环仅占肺组织血流量的微小部分,但在维持气道及肺功能方面具有重要意义[1]。
目前,对肺癌组织是仅由体循环供血,还是体循环和肺循环同时参与供血,尚没有形成统一的定论。多数学者倾向于肺癌仅由体循环供血[2-3]。也有学者认为肺癌不仅有体循环供血,肺循环也参与其中[4-5]。另有学者认为肺循环主要为病变较小的周围型肺癌供血[6-7]。实际上,早在20世纪70年代初,就有研究者通过尸检证实肺癌组织同时由体循环和肺循环参与供血。虽然在活体上验证肺癌的双重血供特点罕见有相关报道,但有研究发现[8],肺癌组织的强化早于主动脉的强化,这一表现提示肺循环可能参与肺癌组织的供血。
常规CT灌注成像技术由于探测器宽度的限制,在活体组织中定量测量肺癌组织的PAF、BAF及PI是不可行的,而且,在数据分析中通常只能选择主动脉为输入动脉,得到一系列灌注参数。这种单入口模式的灌注分析忽略了肺动脉的供血作用,不能反映肺癌双重血供的特点,因此难以准确反映病变的血流灌注特点。320排CT扫描仪在Z轴方向有较宽的覆盖范围(16 cm),一次曝光即可覆盖大部分或全部病灶、主动脉、肺动脉及左心房,时间分辨率高达0.175 s,容积内每个像素在时相上完全一致,使得在活体组织中研究肺癌组织的双重血供成为可能。有研究表明,双入口灌注技术对肺癌的鉴别诊断有重要价值[9]。

图1 男,52岁,左肺鳞癌合并纵隔淋巴结转移。a) 常规CT平扫,显示左下肺内类圆形肿块,密度不均匀,边缘有浅分叶,纵隔内可见肿大淋巴结(箭); b) 增强图像,显示左下肺肿块呈不均匀强化; c) PAF伪彩图,显示病灶呈不均匀低灌注(蓝紫色为主); d) BAF伪彩图,显示病灶呈中等灌注,主要呈蓝绿色;e)PI伪彩图,显示肿瘤的PI值较高,主要呈红黄色。
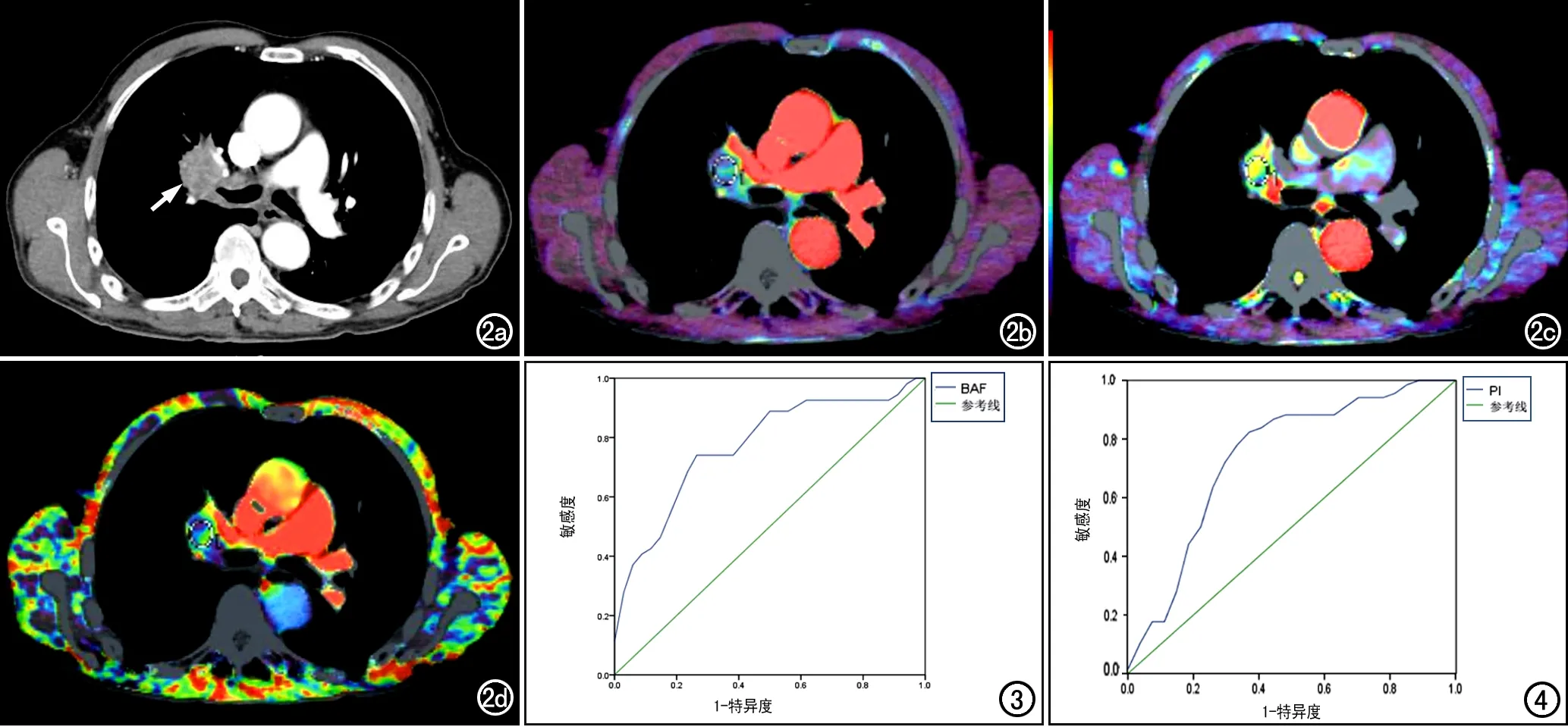
图2 男,68岁,右肺鳞癌,无纵隔淋巴结转移。a) 常规增强图像,显示右肺门肿块呈不均匀强化(箭); b) PAF伪彩图,显示右肺门肿块血流灌注偏低呈蓝紫色; c) BAF伪彩图,显示病灶呈中等灌注,主要呈黄色; d) PI伪彩图,显示肿块的PI值偏低,主要呈蓝紫色。 图3 肺癌双入口灌注参数BAF预测纵隔淋巴结转移的ROC曲线。 图4 肺癌双入口灌注参数PI预测纵隔淋巴结转移的ROC曲线。
影响肺癌的预后因素有肿瘤的病理学类型、临床分期及患者的功能状态等,其中,是否发生淋巴结转移是影响患者预后的重要因素。然而,由于肺癌患者的早期症状通常不典型,多数患者在确诊时已经处于IV期,即已经发生转移。如果在手术过程中进行仔细探查,会发现部分低分期的肿瘤就已出现血管受侵征象,从而导致复发率的增加并缩短患者的生存期[10]。虽然淋巴结转移是肺癌转移最常见的方式,但确切的发生机制尚未完全弄清楚。有研究结果显示,CCR7表达与HIF-1α和HIF-2α的表达呈正相关,并且这3个指标都与淋巴结转移相关[11],另外,缺氧可诱导HIF-1α和HIF-2α的表达及CCR7的上调,抑制HIF-1α和 HIF-2α的表达可导致CCR7的降低,进而抑制肿瘤细胞的迁移和入侵。除此之外,淋巴结转移还与基因突变有关。
肿瘤细胞的转移是个多步骤、多因子参与的复杂过程,首先随着肿瘤细胞的增生,肿瘤体积增大,在各种分泌因子的作用下,癌细胞与癌细胞之间的黏附力降低。基质金属蛋白水解酶(MMP2)活性增加,溶解基底膜层的黏连蛋白,导致癌细胞脱离原发病灶并穿过基底膜,侵入毛细血管或淋巴管腔。由于新形成的毛细血管存在缺陷,如内皮细胞的间隙大、不连接或缺乏基底膜等,癌细胞更容易进入新形成的毛细血管。为了促进血管生成,肿瘤细胞可直接释放血管生成因子如VEGF,从而直接刺激新生血管的形成,除此之外,还可与巨噬细胞协同作用,释放血管生成因子[12]。因此理论上肺癌的淋巴结转移与原发肿瘤的血流动力学状态密切相关,常规CT主要是通过测量淋巴结的短径鉴别是否为转移性淋巴结,其诊断标准是短径大于10 mm[13]。研究表明,淋巴结的大小和是否发生转移关系不大,仅通过形态学特点评价淋巴结良恶性其特异性和灵敏度均较低[14-15]。另外,部分隐匿性转移性淋巴结的影像学和常规病理学诊断都可能存在漏诊,从而影响患者的预后。肿瘤的生长离不开新生血管的形成,微血管密度(micro vessel density,MVD)是衡量肿瘤新生血管形成的金标准。多项研究表明:CTPI参数与MVD间存在相关性[16-17]。也有研究表明MVD与肺癌的淋巴结转移及预后密切相关[18-19]。然而,CTPI技术在预测肺癌纵隔淋巴结转移方面的研究较少。Zhou等[20]研究结果提示,有淋巴结转移组BV值较无淋巴结转移组高,当以BV≥7 mL/100g作为预测淋巴结转移的临界值时,诊断敏感度为78%,特异度为83%。也有研究结果显示,CTPI参数中PV和BV可预测是否存在纵隔淋巴结转移,其敏感度分别为80.0%和86.7%,特异度分别为83.3%和75.0%,PV>5.76 mL/(min·mL)、BV>6.73mL/100g可作为预测纵隔淋巴结转移的诊断指标[21]。除此之外,有研究结果表明有淋巴结转移组中肺癌病灶的MVD、强化峰值以及主动脉与肺动脉强化峰值的比值均较无淋巴结转移组高[22]。由此可见,CT灌注成像技术对术前评估淋巴结转移有重要参考价值,可在术前预测是否发生淋巴结转移,并可为治疗方案的选择及预后评估提供参考。
本研究通过对肺癌原发灶的DI-CTPI参数进行分析,结果表明有纵隔淋巴结转移组中原发灶的BAF高于无纵隔淋巴结转移组,差异有统计学意义;有转移组的PI低于无转移组,差异有统计学意义。ROC曲线可用来评估某一指标对某一疾病的诊断效能[23],曲线下面积越大,诊断性能越好,在肺癌原发灶的3个灌注参数中,原发灶的BAF及PI对预测纵隔淋巴结转移的诊断价值较高,曲线下面积分别为0.773和0.739,当以BAF>56.42 mL/(min·mL)、PI<41.57%作为预测纵隔淋巴结转移的诊断阈值时,有较高的敏感度和特异度。提示有纵隔淋巴结转移的肺癌以支气管动脉供血为主;PI与BAF有关,因此BAF的升高可导致PI的降低。血流量是指单位时间内定量组织内的血容量,反映组织中毛细血管的数量。恶性肿瘤的发生发展及转移是在新生血管不断形成的基础上进行的,主要表现为小血管数量的增加及结构的异常。所以有纵隔淋巴结转移的肺癌病灶的血流灌注增高。支气管动脉是肺癌的主要供血动脉,故在双输入灌注成像参数中,BAF及PI可作为预测淋巴结是否转移的重要参数,并为治疗方案的制定提供参考,同时也可避免手术过程中不必要的淋巴结清扫。而周晖等[24]的研究结果显示,有淋巴结转移组中肺癌的BF值低于无淋巴结转移组,且差异有统计学意义(t=3.490,P=0.015),分析其原因可能是因为Zhou等采用的是单入口灌注成像模式,与本研究所采用的双入口灌注成像模型的原理不同,因此有不同的结论。另外,有研究表明肺癌的病理分型、发生部位和T分期等都会对肺癌是否发生纵隔淋巴结转移产生影响[25],本研究由于病例数较少,未进行单因素及多因素回归分析,因此可能导致研究结果有误差。
[1] Mccullagh A,Rosenthal M,Wanner A,et al.The bronchial circulation——worth a closer look: a review of the relationship between the bronchial vasculature and airway inflammation[J].Pediatr Pulmonol,2010,45(1):1-13.
[2] Hong SP,Kim YI,Kim HY,et al.Bronchial artery and systemic artery embolization in the management of primary lung cancer patients with hemoptysis[J].Cardiovasc Interv Radiol,2007,30(4):638-643.
[3] 董伟华,肖湘生,李惠民,等.支气管动脉和肺动脉多层螺旋CT血管造影对肺癌血供的研究[J].中华放射学杂志,2003,37(7):612-614.
[4] Remyjardin M,Bouaziz N,Dumont P,et al.Bronchial and nonbronchial systemic arteries at multi-detector row CT angiography:comparison with conventional angiography[J].Radiology,2004,233(3):741-749.
[5] Yoon YC,Lee KS,Jeong YJ,et al.Hemoptysis: bronchial and nonbronchial systemic arteries at 16-detector row CT[J].Radiology,2005,234(1):292-298.
[6] Ma SH,Le HB,Jia BH,et al.Peripheral pulmonary nodules:relationship between multi-slice spiral CT perfusion imaging and tumor angiogenesis and VEGF expression[J].BMC Cancer,2008,8(1):1-17.
[7] Tacelli N,Remy-Jardin M,Copin MC,et al.Assessment of non-small cell lung cancer perfusion:pathologic-CT correlation in 15 patients[J].Intern J Med Radiol,2011,257(3):863-871.
[8] Kiessling F,Boese J,Corvinus C,et al.Perfusion CT in patients with advanced bronchial carcinomas:a novel chance for characte-rization and treatment monitoring?[J].Eur Radiology,2004,14(7):1226-1233.
[9] 周舒畅,吴维,胡琼洁,等.RSNA2015胸部影像学[J].放射学实践,2016,31(3):194-201.
[10] Gabor S,Renner H,Popper H,et.al.Invasion of blood vessels as significant prognostic factor in radically resected T1-3N0M0 non-small-cell lung cancer[J].Eur J Card Thor Surg,2004,25(3):439-442.
[11] Li Y,Qiu X,Zhang S,et al.Hypoxia induced CCR7 expression via HIF-1alpha and HIF-2alpha correlates with migration and invasion in lung cancer cells[J].Cancer Biol Ther,2009,8(4):322-330.
[12] Niethammer AG,Xiang R,Becker JC,et al.A DNA vaccine against VEGF receptor 2 prevents effective angiogenesis and inhibits tumor growth[J].Nature Med,2002,8(12):1369-1375.
[13] Langen AJ,Raijmakers P,Riphagen I,et al.The size of mediastinal lymph nodes and its relation with metastatic involvement:a meta-analysis[J].Eur J Cardio Thor Surg,2006,29(1):26-29.
[14] Fengfeng Yang,Jie Dong,Xiuting Wang,et al.Non-small cell lung cancer:spectral computed tomography quantitative parameters for preoperative diagnosis of metastatic lymph nodes[J].Eur J Radiol,2017,89:129-135.DOI:10.1016/j.ejrad.2017.01.026.
[15] Renzel KL,MöNig SP,Sinning JM,et al.Lymph node size and metastatic infiltration in non-small cell lung cancer[J].Chest,2003,123(2):463-467.
[16] Daniel S,Helge N,Sven Michael S,et al.Assessment of tumor vascularity in lung cancer using volume perfusion CT (VPCT) with histopathologic comparison:a further step toward an individualized tumor characterization[J].J Comput Assist Tomogr,2013,37(1):15-21.
[17] Sauter AW,Winterstein S,Spira D,et al.Multifunctional profiling of non-small cell lung cancer using18F-FDG PET/CT and volume perfusion CT[J].J Nucl Med,2012,53(4):521-529.
[18] 周鹏,罗红兵,左佳明,等.肺癌灌注参数与肿瘤血管密度及纵隔淋巴结转移相关性分析[J].四川医学,2013,34(5):582-584.
[19] Kreuter M,KroPAFF M,Fischaleck A,et al.Prognostic relevance of angiogenesis in stage III NSCLC receiving multimodality treatment[J].Eur Respirat J,2009,33(6):1383-1388.
[20] Zhou SL,Gu Y,YUAN G,et al.Correlations between computed tomography perfusion enhancement parameters and lymph node metastasis in non-small cell lung cancer[J].Intern J Clin Exper Med,2016,9(7):12896-12903.
[21] 王玉涛,张建,赵晓东,等.低剂量256层CT灌注成像预测肺癌纵隔淋巴结转移的初步研究[J].现代实用医学,2014,26(8):971-973.
[22] 邓东,武莹莹,黄仲奎,等.多层螺旋CT首过期灌注成像和肿瘤微血管密度在评价周围型肺癌TNM分期的临床价值[J].临床放射学杂志,2011,30(6):804-808.
[23] He H,Lyness JM,Mcdermott MP.Direct estimation of the area under the receiver operating characteristic curve in the presence of verification bias[J].Statist Med,2009,28(3):361-376.
[24] 周晖,刘进康,陈胜喜,等.非小细胞肺癌CT灌注成像血流量与肿瘤微血管超微结构特点的关系初探[J].中华肿瘤杂志,2013,35(3):193-197.
[25] 贺政,赵俊华,任慧雯,等.448例肺癌淋巴结转移规律分析及意义[J].山东医药,2011,51(26):72-74.
ThevalueofCTdual-inputperfusionimagingtopredictthemediastinallymphnodemetastasisofthelungcancer
LIU Pei,SONG Ya-xin,CHANG Li-yang,et al.
Department of Radiology,the First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
Objective:To analyze the relationship between the CT perfusion parameters of lung cancer and the pre-sence of mediastinal lymph node metastasis.MethodsSixty-one patients with lung cancer confirmed by postoperative pathological diagnosis were included in the study.All patients underwent 320-row multidetector CT perfusion imaging of lung,then use the dual-input CT perfusion analysis model was used to calculate the perfusion parameters.The difference of perfusion parameters between the group with lymph node metastasis and the group without lymph node metastasis was analyze using independent simplet-test,and receiver-operating characteristic (ROC) curve was used to determine the diagnosis effciency of dual-input perfusion parameters.ResultsBronchial artery flow (BAF) was higher in the group with lymph node metastasis (27 cases) than that in the group without lymph node metastasis (34 cases),and the difference was statistically significant (t=4.173,P<0.001);perfusion index (PI) was lower in the group with lymph node metastasis than that in the group without lymph node metastasis,and the difference was statistically significant (t=-3.378,P=0.001);and there was no significant difference in the pulmonary artery flow (PAF) between the two groups (P>0.05).If setting BAF>56.42mL/(min·100mL) as the critical value of predicting lung cancer with mediastinal lymph node metastasis,the sensitivity was 74.1%,specificity was 76.5%,and the area under the ROC curve was 0.773.If setting PI<41.57% as the critical value of predicting lung cancer with mediastinal lymph node metastasis,the sensitivity was 82.4%,specificity was 66.7%,and the area under the ROC curve was 0.739.ConclusionDual-input CT perfusion imaging can be used as an important reference index for preoperative diagnosis of lymph node metastasis.
Tomography,X-ray computed; Perfusion imaging; Lung cancer; Lymph node metastasis
450052 郑州,郑州大学第一附属医院放射科
刘佩(1989-),女,河南许昌人,硕士研究生,主要从事胸腹部影像诊断工作。
岳松伟,E-mail:ysw197281@sina.com
R734.2; R814.42
A
1000-0313(2017)12-1261-05
10.13609/j.cnki.1000-0313.2017.12.012
2017-05-05
2017-06-30)