CT纹理分析对鉴别直肠癌患者K-ras基因突变的可行性研究
王国蓉, 王志伟, 薛华丹, 金征宇,吴焕文
·影像组学专题·
CT纹理分析对鉴别直肠癌患者K-ras基因突变的可行性研究
王国蓉, 王志伟, 薛华丹, 金征宇,吴焕文
目的探讨CT纹理分析(CTTA)技术对鉴别直肠癌患者K-ras基因突变的可行性研究。方法回顾性分析33例经病理证实的直肠癌患者的CT图像,其中K-ras突变型18例、野生型15例。使用TexRad软件对病灶最大层面的平扫及门静脉期图像进行分析,获得基于不同空间缩放因子(SSF=0和2~6)的6个特征性纹理参数值,包括均值(mean)、标准差(standard deviation,SD)、熵值(entropy)、偏度值(skewness)、峰值(kurtosis)及正像素均值(mean of positive pixels,MPP)。比较两组间各参数值的差异。结果平扫CT图像:当SSF取2~4时,野生型组中病灶的熵值(分别为4.3、4.2、4.3)高于突变型(分别为4.1、4.0和4.0),差异均有统计学意义(P<0.05);当SSF=2、熵取界值4.245时,诊断敏感度及特异度均为73.3%;当SSF=3、熵取界值4.095时,诊断敏感度及特异度分别为80.0%、61.1%;当SSF=4、熵取界值4.205时,诊断敏感度为73.3%、特异度为72.2%。增强CT图像上各纹理参数值在两组间的差异均无统计学意义(P>0.05)。结论CT纹理分析能够对预测直肠癌患者有无K-ras基因突变提供一定的诊断信息。
直肠癌; 纹理分析; 体层摄影术,X线计算机; K-ras基因突变
直肠癌是消化系统常见的恶性肿瘤之一,一般按直肠息肉-腺瘤-癌的方式进展,涉及多种原癌基因及抑癌基因的突变。结直肠癌在全球范围内的发病率、死亡率分别居第三、第四位,我国结直肠癌发病率和死亡率分别为14.2/10万和7.4/10万[1],且随着人民生活水平及饮食结构的改变,发病率呈逐年升高的趋势[2]。尽管对病灶的早期发现和干预可以达到治愈的效果,但对于晚期患者而言,术后复发及远处转移仍是直肠癌致死的主要原因之一[3]。因此,寻求更加合理有效的治疗方法来延长患者的生存期,显得尤为重要。近年来,分子靶向药物如西妥昔单抗(爱必妥)在临床中的使用日益广泛,它主要作用于肿瘤细胞表面的生长因子受体(EGFR),从而阻断细胞信号传导通路,达到抗肿瘤的效果[4-5]。已经有研究证实此类药物与化疗药物联合使用后,对晚期直肠癌尤其是不伴有K-ras基因突变(K-ras野生型)的患者具有良好的治疗效果[6-9],所以目前K-ras基因检测对于晚期直肠癌患者具有重要意义。本研究对CT纹理分析(CT texture analysis,CTTA)技术判断直肠癌患者是否伴有K-ras基因突变的可行性进行观察,旨在为临床治疗提供参考。

表1 CT平扫图像不同SSF值时病灶的各项纹理参数值
注:表格内纹理参数值不符合正态分布,故以“中位数(四分位数间距)”表示。
材料与方法
1.研究对象
将2014年12月-2017年4月在北京协和医院就诊的经手术病理证实的33例直肠癌患者纳入研究。其中男21例,女11例,平均年龄(57.9±13.2)岁;15例为无K-ras基因突变型,18例为K-ras基因突变型。所有患者在术前行腹盆部CT增强扫描及基因检测。
2.扫描方法
使用Siemens Somatom Definition双源CT机进行腹盆部CT平扫和增强扫描,扫描参数:层厚5 mm,层间距5 mm,扫描范围自膈肌水平至耻骨联合处。采用高压注射器经肘前静脉注入对比剂碘海醇(300 mg I/mL)100 mL,注射速率为5 mL/s,注药后延迟60 s行门静脉期扫描。
3.纹理分析
将所有图像传至TexRAD工作站,采用TexRAD软件(TexRAD Ltd,www.texrad.com,part of Feedback Plc,Cambridge,UK)进行纹理分析。由两位分别具有5年和10年工作经验的放射科医师进行阅片分析,二者意见不一时通过协商达成一致意见。由另一位熟悉Texrad软件操作的放射科医师进行数据测量。在每例患者的CT平扫及门静脉期增强扫描图像中选择病灶最大层面,沿肠壁异常增厚区放置感兴趣区域(region of interest,ROI),ROI面积尽可能大。通过设定阈值,将ROI内所有像素中CT值低于-50 HU的部分自动滤过。纹理分析利用高斯-拉普拉斯算法进行选择性图像滤波处理,然后通过灰度直方图分析获得定量的纹理参数值,包括均值(mean)、标准差(standard deviation,SD)、熵值(entropy)、偏度值(skewness)、峰值(kurtosis)及正像素均值(mean of positive pixels,MPP)共6个参数[10-13]。图像滤波处理通过选择不同的空间缩放因子(spatial scaling factor,SSF)来实现 ,代表经滤过器突出显示的图像特征的大小,以主体的滤过半径(通常取值为0、2、3、4、5和6 mm)表示[10,13]。SSF=0为无滤过;SSF=2表示经滤过,显示图像特征为良好;SSF=3~5表示经滤过,显示图像特征为中等;SSF=6表示经滤过,显示图像特征为粗糙[10]。测量并记录不同的SSF值时两期图像上病灶的各项纹理参数值。
4.统计分析
使用SPSS 20.0软件进行统计分析。符合正态分布的计量资料用均值±标准差表示,不符合正态分布的数据采用中位数及四分位数间距表示。采用Mann-Whitney U检验比较平扫及门静脉期图像上各项纹理参数值在K-ras基因突变(+)组和无突变(-) 组间的差异,P<0.05表示差异有统计学意义。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)来评估各项纹理参数对判断直肠癌患者有无K-ras基因突变的效能。
结 果
在CT平扫和增强扫描静脉期图像上不同SSF获得的两组病灶的6项纹理参数值见表1~2、图1~4,统计分析结果见表3~4。在CT平扫图像上,仅熵值在SSF值取2~4时,在两组间的差异有统计学意义(P值分别为0.005、0.033和0.030);在不同SSF值图像上其它纹理参数值在两组间的差异均无统计学意义(P>0.05)。在CT增强门静脉期图像上,在不同的SSF值图像上各项纹理参数值在两组间的差异均无统计学意义(P>0.05)。
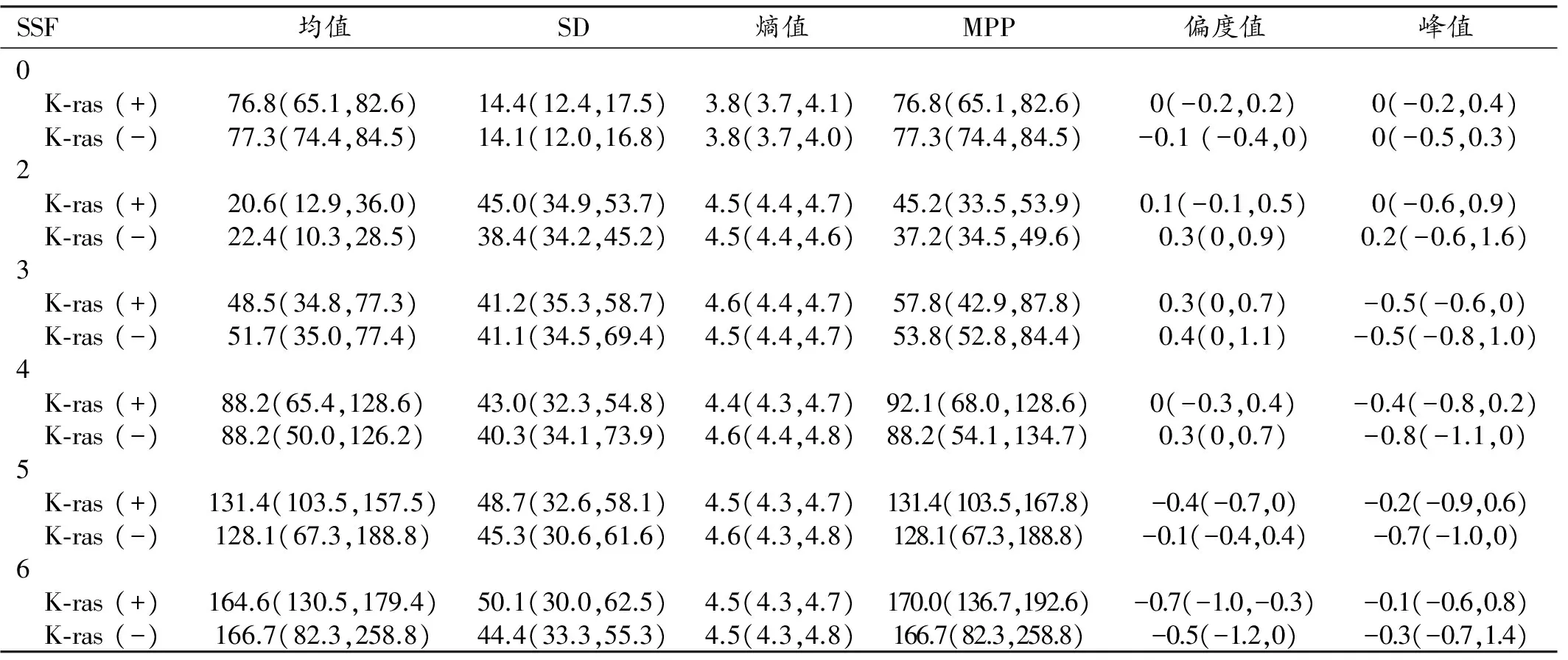
表2 CT增强图像上不同SSF值时的各项纹理参数值
注:表格内纹理参数值不符合正态分布,故以“中位数(四分位数间距)”表示。

表3 两组病变在平扫CT图像上的纹理参数值的统计分析结果

表4 两组病变在增强CT图像上的纹理参数值的统计分析结果
在平扫CT图像上熵值的ROC曲线分析结果见表5、图5。当SSF=2,熵的界值取4.245时的ROC曲线下面积(area under curve,AUC)最大 ,相应的诊断敏感度及特异度均为73.3%;当SSF=3,熵的界值取4.095时AUC最大,诊断敏感度及特异度分别为80.0%和61.1%;当SSF=4,熵的界值取4.205时AUC最大,诊断敏感度为73.3%、特异度为72.2%。

表5 熵值在CT平扫不同SSF条件下的ROC曲线分析
讨 论
分子靶向治疗是针对肿瘤组织靶点的一种特异性治疗方法,可以提高治疗效果并减少副作用、改善患者预后,是目前肿瘤治疗的热点领域。多项研究表明西妥昔单抗联合化疗能有效延长直肠癌K-ras野生型患者的生存期[15-17]。因此,K-ras基因的检测对于直肠癌患者显得尤为重要。
对于肿瘤组织的基因突变,影像学检查是否能提供有益的帮助呢?目前常用的临床影像检查方法,包括CT、MRI以及PET-CT检查,其获得的影像数据主要以图像的形式由诊断医生进行阅片分析,可利用的信息包括CT扫描的CT值、MRI上的信号强度以及PET-CT的标准摄取值(standard uptake value,SUV),这些信息是比较有限的。而最近提出的影像组学(Radiomics)是一次对影像图像数据进行挖掘的革命,被视为介于临床与基因之间的第二层重要数据,并且已广泛应用于各类疾病的研究中,尤其是在肿瘤的诊断、治疗和预后等方面的研究中,为肿瘤的精准治疗提供了新的依据。

图1 男,75岁,直肠癌K-ras突变型。a) CT平扫图像,显示直肠壁不均匀增厚(箭); b) 平扫图像ROI内所有纹理参数的综合伪彩图像,显示纹理特征良好; c) 平扫图像ROI内所有纹理参数的综合伪彩图像,显示纹理特征中等; d) 平扫图像ROI内所有纹理参数的综合伪彩图像,显示纹理特征粗糙; e) 增强CT图像,显示异常增厚的直肠壁明显强化(箭); f) 增强扫描ROI内所有纹理特征的综合伪彩图像,显示纹理特征良好; g) 增强扫描ROI内所有纹理特征的综合伪彩图像,显示纹理特征中等; h) 增强扫描ROI内所有纹理特征的综合伪彩图像,显示纹理特征粗糙。 图2 男,57岁,直肠癌K-ras野生型。a) CT平扫图像,显示直肠壁环周增厚,肠腔狭窄(箭); b) 平扫图像ROI内所有纹理参数的综合伪彩图像,显示纹理特征良好; c) 平扫图像ROI内所有纹理参数的综合伪彩图像,显示纹理特征中等; d) 平扫图像ROI内所有纹理参数的综合伪彩图像,显示纹理特征粗糙; e) 增强CT图像,显示环周增厚的直肠壁明显强化(箭); f) 增强扫描ROI内所有纹理特征的综合伪彩图像,显示纹理特征良好; g) 增强扫描ROI内所有纹理特征的综合伪彩图像,显示纹理特征中等; h) 增强扫描ROI内所有纹理特征的综合伪彩图像,显示纹理特征粗糙。

图3 CT平扫不同SSF条件下熵值的ROC曲线。a)SSF=2;b)SSF=3;c)SSF=4。
纹理分析技术作为目前影像领域的新星,最大的亮点在于通过采用特殊的算法,根据不同的滤过半径,来提取一系列基于像素灰度空间分布、人眼所无法辨识的定量纹理参数,如熵值、偏度值、峰值等,它能够深度挖掘原始图像的数据信息,从而能更加全面、细致地反映病灶的特点[18],为影像组学的实现提供了媒介。已经有较多研究结果表明,纹理分析技术可以对肿瘤组织的特性做出较为准确的判断[19-21]。
对于直肠癌患者,腹盆部CT增强检查是临床上最常用的检查手段,可用于判断病灶位置、侵犯范围、周围淋巴结转移及远处转移等情况。本实验拟探讨CTTA用于预测直肠癌患者是否伴K-ras基因突变的可行性,研究结果表明,直肠癌患者行平扫CT检查时,当滤过条件为良好和中等时(SSF=2~4),K-ras野生型组中病灶的熵值均高于突变组(P<0.05),而其它纹理参数值(均值,标准差,正像素均值,偏度值,峰值)在两组患者间的差异均无统计学意义。反观CT增强图像(本实验中指门静脉期图像),任意SSF值条件下各项纹理参数的值在野生型及突变型之间差异均无统计学意义(P>0.05)。这一结果表明,应用纹理分析技术鉴别直肠癌患者有无K-ras基因突变时,对比剂的使用并不能为鉴别诊断提供更多信息,可能是对比剂的使用使得图像的灰度重新分布,从而产生的结果也不尽相同。由此可见,我们可以仅通过CT平扫图像提取病灶的纹理特征参数(熵值)来对直肠癌患者是否表达K-ras基因做出初步诊断。
Lovinfosse等[22]在使用PET-CT分析直肠癌K-ras基因突变的研究中发现,K-ras突变型患者的最大标准摄取值(maximum standardized uptake value,SUVmax)高于野生型。Kwada等[23]分析了PET-CT图像上结直肠癌伴肝转移患者的K-ras基因突变的情况,结果显示,当肝脏病灶直径大于10 mm时,K-ras突变型患者的SUVmax高于野生型。而本研究利用平扫CT图像结合纹理分析技术即可鉴别直肠癌患者有无K-ras突变,相对PET-CT而言,检查成本显著减低、方法简单易行,更有临床推广价值。
本实验的局限性在:入组病例数相对较少;仅对病灶最大截面的单帧CT图像上的纹理特点进行分析,未能够对病变进行三维建模、以获取更多的容积纹理信息。上述不足之处有望在下一步研究中得到改进和完善。
综上所述,CT图像结合纹理分析技术对直肠癌患者有无K-ras基因突变具有一定的鉴别诊断价值。尤其是在CT平扫图像上当滤过半径为2~4 mm时,熵值具有较高的鉴别诊断效能。表明CT平扫即可对直肠癌患者有无K-ras基因突变提供判断依据,较之CT增强检查,减少了对比剂的摄入,从而也降低了对比剂肾毒性损害的发生率[24],对患者而言,受益颇多。
[1] 杨雪君,赵卫,郑凌琳,等.双能量CT对结直肠癌区域淋巴结性质判定的临床研究[J].放射学实践,2016,31(10):957-960.
[2] GLOBOCAN:Estimated Cancer Incidence,Mortality and Prevalence Worldwide in 2012.International Agency for Research on Cancer[S/OL].2012.[cited 2017 October 21].Available from:http://globocan.iarc.fr/Pages/fact_sheets_population.aspx
[3] Liang JW,Shi ZZ,Zhang TT,et al.Analysis of genomic aberrations associated with the clinicopathological parameters of rectal can-cer by arraybased comparative genomic hybridization[J].Oncol Rep,2013,29(5):1827-1834.
[4] Labianca R,Nordlinger B,Beretta GD,et al.Primary colon can-cer:ESMO clinical practice guidelines for diagnosis,adjuvant treatment and follow-up[J].Ann Oncol,2010,21(Suppl 5):S70-S77.
[5] Berger MD,Stintzing S,Heinemann V,et al.Impact of genetic variations in the MAPK signaling pathway on outcome in metastatic colorectal cancer patients treated with first-line FOLFIRI and bevacizumab:data from FIRE-3 and TRIBE trials[J].Ann Oncol,28(11):2780-2785.
[6] Baselga J.The EGFR as a target for anticancer therapy——focus on cetuximab[J].Eur J Cancer,2001,37(Suppl 4):S16-S22.
[7] Napolitano S,Martini G,Martinelli E,et al.Therapeutic efficacy of SYM004,a mixture of two anti-EGFR antibodies in human colorectal cancer with acquired resistance to cetuximab and MET activation[J].Oncotarget,2017,8(40):67592-67604.
[8] Wu B,Yao Y,Zhang K,et al.RAS testing and cetuximab treatment for metastatic colorectal cancer:a cost-effectiveness analysis in a setting with limited health resources[J].Oncotarget,2017,8(41):71164-71172.
[9] Sato Y,Hirakawa M,Ohnuma H,et al.A triplet combination with capecitabine/oxaliplatin/irinotecan (XELOXIRI) plus cetuximab as first-line therapy for patients with metastatic colorectal cancer: a dose escalation study[J].Cancer Chemother Pharmacol,2017,64(4):48-57.
[10] Cremolini C,Schirripa M,Antoniotti C,et al.First-line chemotherapy for mCRC-a review and evidence-based algorithm[J].Nat Rev Clin Oncol,2015,12(10):607-619.
[11] Zhang G,Shi B,Sun H,et al.Differentiating pheochromocytoma from lipid-poor adrenocortical adenoma by CT texture analysis:feasibility study[J].Abdom Radiol,2017,42(9):2305-2313.
[12] Miles KA,Ganeshan B,Rodriguez-Justo M,et al.Multifunctional imaging signature for V-KI-RAS2 Kirsten rat sarcoma viral oncogene homolog (KRAS) mutations in colorectal cancer[J].J Nucl Med,2014,55(3):386-391.
[13] Ng F,Ganeshan B,Kozarski R,et al.Assessment of primary colorectal cancer heterogeneity by using whole-tumor texture analysis:contrast-enhanced CT texture as a biomarker of 5-year survival[J].Radiology,2013,266(1):177-184.
[14] O'Connor J.Cancer heterogeneity and imaging[J/OL].Semin Cell Dev Biol,2017,64:48-57.DOI:10.1016/j.semcdb.2016.10.001
[15] Michl M,Stintzing S,Fischer VWL,et al.CEA response is associated with tumor response and survival in patients with KRAS exon 2 wild-type and extended RAS wild-type metastatic colorectal cancer receiving first-line FOLFIRI plus cetuximab or bevacizumab (FIRE-3 trial)[J].Ann Oncol,2016,27(8):1565-1572.
[16] Li Z,Liu XW,Chi ZC,et al.Detection of K-ras mutations in predicting efficacy of epidermal growth factor receptor tyrosine kinase (EGFR-TK) inhibitor in patients with metastatic colorectal cancer[J/OL].PLoS One,2015,10(5):e101019. DOI:10.1016/j.semcdb.2016.10.001
[17] Lee YS,Chin YT,Yang Y,et al.The combination of tetraiodothyroacetic acid and cetuximab inhibits cell proliferation in colo-rectal cancers with different K-rasstatus[J].Steroids,2016,111(1):63-70.
[18] Kuno H,Qureshi MM,Chapman MN,et al.CT texture analysis potentially predicts local failure in head and neck squamous cell carcinoma treated with chemoradiotherapy[J].AJNR,2017,38(12):2334-2340.
[19] Tsujikawa T,Yamamoto M,Shono K,et al.Assessment of intratumor heterogeneity in mesenchymal uterine tumor by an18F-FDG PET/CT texture analysis[J].Ann Nucl Med,2017,31(10):752-757.
[20] Liu Y,Liu S,Qu F,et al.Tumor heterogeneity assessed by texture analysis on contrast-enhanced CT in lung adenocarcinoma:association with pathologic grade[J].Oncotarget, 2017,8(32):53664-53674.
[21] Kim HS,Kim JH,Yoon YC,et al.Tumor spatial heterogeneity in myxoid-containing soft tissue using texture analysis of diffusion-weighted MRI[J/OL].PLoS One,2017,12(7):e181339.DOI:10.1371/journal.pone.0181339
[22] Lovinfosse P,Koopmansch B,Lambert F,et al.18F-FDG PET/CT imaging in rectal cancer:relationship with the RAS mutational status[J/OL].Br J Radiol,2016,89(1063):e20160212.DOI:10.1259/bjr.20160212
[23] Kawada K,Toda K,Nakamoto Y,et al.Relationship between18F-FDG PET/CT scans and Kras mutations in metastatic colo-rectal cancer[J].J Nucl Med,2015,56(9):1322-1327.
[24] Raju R,Thompson AG,Lee K,et al.Reduced iodine load with CT coronary angiography using dual-energy imaging:a prospective randomized trial compared with standard coronary CT an-giography[J].J Cardiovasc Comput Tomogr,2014,8(4):282-288.
FeasibilityofdetectingK-rasmutationsinrectalcancerbyCTtextureanalysis
WANG Guo-rong,WANG Zhi-wei,XUE Hua-dan,et al.
Department of Radiology,Peking Union Medical College Hospital,Beijing 100730,China
Objective:To investigate the feasibility of using CT texture analysis (CTTA) to differentiate mutated K-ras from wild-type in rectal cancer.MethodsCT unhanced and enhanced images were reviewed retrospectively in 33 cases,18 of which had K-ras mutation,of rectal carcinoma confirmed by operation and pathology.We placed a ROI on selected axial image (the non-enhanced and portal phase image in the same slice of lesion) by using TexRad,and then a series of quantitive paremeters based on different spatial scaling factor (SSF=0 and 2~6) were extracted,including mean,standard deviation (SD),entropy,mean of positive pixels (MPP),skewness and kurtosis.All texture parameters were compared between K-ras mutated group and wild-type group.ResultsFor unenhanced CT,patients who are without K-ras mutation exhibited higher entropy in the condition of different SSF(SSF=2~4; K-ras wild-type group vs mutated group:4.3,4.2,4.3 vs 4.1,4.0,4.0;P<0.05).When SSF was 2,the value of entropy was 4.245,the sensitivity and specificity both was 73.3%;SSF was 3,the value of entropy was 4.095,the sensitivity and specificity was 80.0% and 61.1%,respectively;SSF was 4,the value of entropy was 4.205,the sensitivity and specificity was 73.3% and 72.2%.As for portal phase imagies,there was no significant difference between the two groups.ConclusionCTTA could contribute to differentiating K-ras mutated from wild-type in carcinoma of the rectum,especially in nonenhanced CT image.
Rectal cnacer; Texture analysis; Tomography,X-ray computed; K-ras mutaition
100730 北京,中国医学科学院北京协和医学院北京协和医院放射科(王国蓉,王志伟,薛华丹,金征宇),病理科(吴焕文)
王国蓉(1992-),女,山西朔州人,硕士研究生,主要从事肿瘤功能成像研究工作。
王志伟,E-mail:zhiweiwang1981@sina.com
国家自然科学基金(81401496)
R735.3; R814.42
A
1000-0313(2017)12-1215-06
10.13609/j.cnki.1000-0313.2017.12.002
2017-10-30
2017-11-20)

