中药复方“脊髓康”对神经干细胞分化作用的影响*
苑文超,王 磊,马 勇,2**,黄桂成,郭 杨,
潘娅岚1,杨博元1,董晤训1,宗永刚2
(1.南南京中医药大学骨伤修复与重建新技术实验室 南京 210023;2.扬州大学江苏省中西医结合老年病防治重点实验 扬州 225002)
脊髓损伤(Spinal Cord Injury,SCI)是由汽车事故、跌倒、运动和暴力等高能量损伤引起的疾病[1]。严重的SCI会损伤神经组织,导致神经功能的突然丧失。据流行病学显示,我国SCI的发病率呈逐年上升趋势,且多发于中青年[2,3],SCI的发生不但给患者身体和精神状态带来了极大的影响,而且给家庭和社会带来巨大的经济负担[4]。脊髓损伤后自身神经元大量丢失,且一旦损伤难以修复,因此成为骨科及神经科学领域的研究热点和难点。NSCs是能够实现自我更新、增殖和分化的神经母体细胞,具有产生神经元和胶质细胞的多向分化潜能,在治疗SCI方面具有巨大的应用前景。但研究表明[5],经移植的NSCs在生理状态下,大部分分化为神经胶质细胞,产生神经元的几率较低,从而阻碍SCI部位的恢复。中药复方“脊髓康”为临床验方,用于脊髓损伤患者的治疗,疗效确切[6]。前期研究表明,JSK可促进大鼠SCI后神经功能的恢复、提升SCI后脊髓内脑源性神经营养因子蛋白及mRNA的表达水平[7]。鉴于此,课题组通过对JSK调控大鼠NSCs分化方向的研究,拟为NSCs移植治疗SCI提供新的研究思路和为中医药治疗SCI提供一定的依据。
1 材料与方法
1.1 材料
1.1.1 动物
清洁级SD孕鼠1只,孕期13-15天,体质量300-350 g;清洁级SD大鼠10只,雌雄均可,体质量250-300 g。均购自南京青龙山动物繁殖中心,动物生产许可证号:SCXK(苏)2012-0008。
1.1.2 药物及试剂
脊髓康(生黄芪30 g,当归12 g,丹参20 g,地鳖虫10 g,赤芍12 g,淫羊藿10 g,蜈蚣1条等)为我们临床经验方(国家发明专利ZL200910026193.7)(鉴定人:马勇;工作单位:南京中医药大学;职称:教授),其生药由南京中医药大学附属医院药剂科提供。DMEM/F12(1:1)培养基、B-27(无血清添加剂)、多聚赖氨酸(PLL)、谷氨酰胺(Glutamin)、FBS、HBSS溶液均购自美国Gibco公司;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表 皮 生 长 因 子(epidermal growth factor,EGF)均购于美国 PeproTech公司;二脒基苯基吲哚(4′6-diamidino-2-phenylindole,dihydrochloride,Dapi),购于Sigma公司,大鼠抗Nestin抗体、GFAP抗体、βⅢ-Tubulin抗体均购于美国CST公司,二抗Alexa488、Alexa 594均购于Abcam公司。
1.2 方法
1.2.1 含药血清的制备
“脊髓康”原方,加10倍水量,常法煎煮,滤液浓缩至2 g·mL-1,4℃保存备用。含药血清组以生药量20 g·kg-1灌胃,连续给药3天。末次给药后1 h经乙醚呼吸麻醉,腹动脉采血,每只大鼠采血5 mL,室温静置2 h[8],3000 r·min-1离心6 min,分离血清,0.22 μm 微孔滤膜过滤除菌,分装,-40℃保存备用。按照上述方法另取空白血清5 mL以稀释含药血清浓度。
1.2.2 原代NSCs的分离、培养以及鉴定1.2.2.1 原代NSCs的分离、培养
取孕期13-15天SD大鼠,2.5%戊巴比妥钠麻醉,剖腹取出胎鼠,迅速置于冰上;75%乙醇浸泡消毒后,完整取出大脑及脑干;体式显微镜下,暴露海马体,剥离血管膜,剪碎海马体至1-2 mm3大小,暂存于0℃HBSS溶液中;用5 mL注射器缓慢吹打形成细胞悬液;400目滤网过滤,收集悬液;1000 rpm离心5 min,移去上清,以无血清培养基重悬;计数后,以106·mL-1密度接种于培养瓶中,37℃、5%CO2培养箱培养;24 h后全量换液,首次换液后每3天半量换液。约7-8天后形成神经球,以机械吹打法进行传代。
1.2.2.2 原代NSCs鉴定
将部分神经球或消化后的单个细胞接种到PLL(浓度为0.1 mg/mL)处理的盖玻片上,继续培养15 min(神经球)或过夜(单个细胞),4%多聚甲醛固定15 min后,PBS润洗(5 min×3),0.2%Triton×-100室温处理15 min,PBS润洗(5 min×3),1%BSA常温封闭1 h,PBS润洗(5 min×3)加入鼠抗Nestin一抗,4℃过夜。次日,PBS润洗(5 min×3),加入FITC标记山羊抗兔二抗,常温孵育2 h,PBS润洗(5 min×3),DAPI标记细胞核,室温5 min,PBS润洗(5 min×3),封片、拍照。
1.2.2.3 NSCs分化后行免疫化学染色
将NSCs接种于经PLL处理过的24孔培养板中,每孔约接种40个神经球,加入500 μL 10%FBS完全培养基,置于37℃、5%CO2培养箱中,2-3天后全量换液,7天后行βIII-Tubulin、GFAP免疫荧光染色,Alexa 594标记神经元骨架,Alexa 488标记星形胶质细胞相关膜蛋白,免疫荧光显微镜下观察、拍照。
1.2.3 “脊髓康”含药血清干预NSCs的分化情况1.2.3.1 实验分组
10%FBS诱导分化后,每孔分别加入10%、5%、2.5%的脊髓康含药血清,即JSK高、中、低剂量组(JSKH、JSK-M、JSK-L),2.5%、5%含药血清组用空白血清稀释,临用前将各组血清加入培养液中,并使培养液中含药血清终浓度为10%,同时设置不加含药血清(Blank)组(对照组),每组分别重复3次以确保稳定性。
1.2.3.2βⅢ-Tubulin、GFAP免疫荧光染色
(1)不同视野下计算βⅢ-Tubulin、GFAP细胞百分比
待以上两组NSCs贴壁分化7天后,分别行βⅢ-Tubulin、GFAP免疫荧光染色,荧光显微镜下观察、拍照。每组各取30个视野,分别计算出βⅢ-Tubulin、GFAP阳性细胞数占细胞总数的百分比,进行统计分析。
(2)不同视野下对βⅢ-Tubulin、GFAP细胞荧光定量
应用Image-Pro Plus软件对各组βⅢ-Tubulin、GFAP阳性细胞进行Area(Area of interest)、累计光密度(IOD)定量,并计算Area(红光)/Area(绿光)、IOD(红光)/IOD(绿光)的百分比,进行统计分析。
1.2.4 统计学处理
用SPSS19.0统计软件对数据进行处理,实验所得数据以±s表示,采用单因素方差分析进行统计学处理。P<0.05具显著性差异。
2 结果
2.1 原代NSCs培养
原代分离的NSCs,悬浮于无血清培养基中,3-4天后单细胞逐渐形成、大小不一的细胞团,待7-8天后,细胞团逐渐生长成神经球形,如图1所示。
2.2 原代NSCs的鉴定
将生长状态良好的第4代NSCs行免疫化学染色,行Dapi、Nestin双标,如图2所示。
2.3 在“脊髓康”作用下,NSCs的分化情况
NSCs经JSK-H、JSK-M、JSK-L含药血清干预分化7天后,行βⅢ-Tubulin、GFAP免疫荧光双标,如图3所示。
2.4 βIII-Tubulin、GFAP的阳性细胞表达的百分比比较
如表1所示,JSK-H、JSK-M、JSK-L与Blank比较βIII-Tubulin百分比明显增高(P<0.05),JSK-H与JSKM、JSK-L比较均有统计学意义(P<0.01);JSK-H、JSKM、JSK-L与Blank比较GFAP百分比明显降低(P<0.05),JSK-H与JSK-M、JSK-L、比较均有统计学意义(P<0.01)。
2.5 βIII-Tubulin、GFAP的阳性细胞表达荧光定量百分比比较
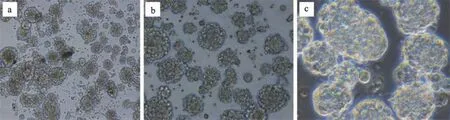
图1 a、b、c分别是NSCs在100、200、400倍显微镜下的生长状态
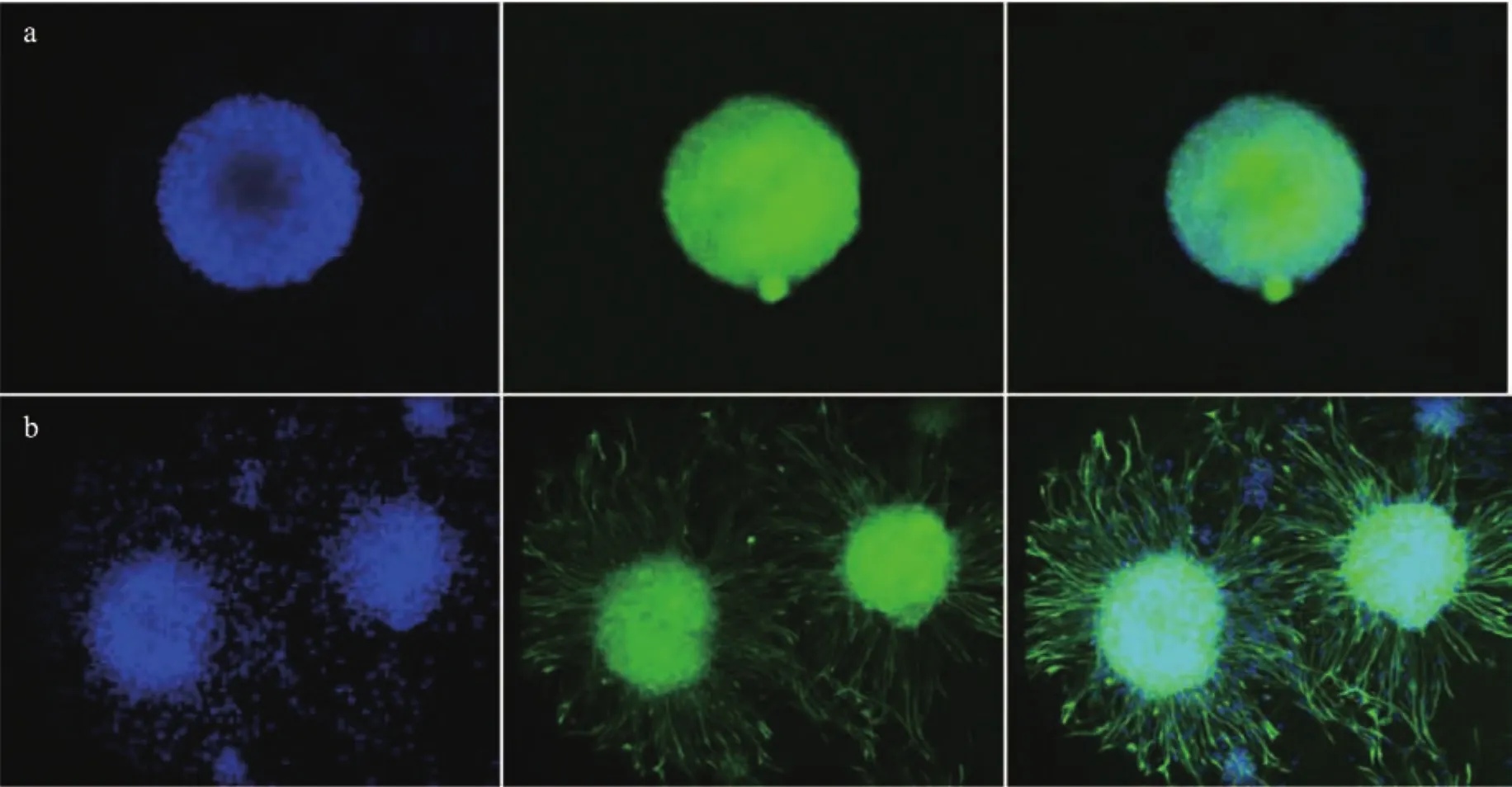
图2 a:NSCs形成神经球后的鉴定;b:NSCs神经球贴壁24 h后的鉴定。
JSK-H、JSK-M、JSK-L与Blank相比有显著差异(P<0.05);JSK-H与JSK-M、JSK-L均有显著差异(P<0.01)。
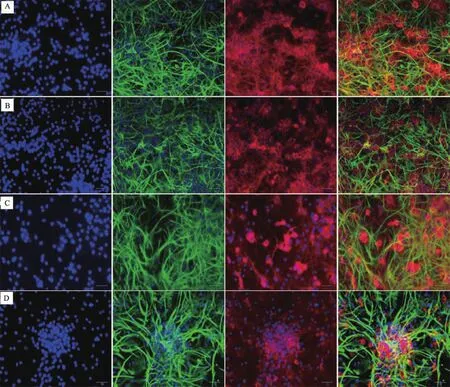
图3 A、B、C、D分别为脊髓康含药血清高、中、低剂量组和空白组。

表1 βIII-tubulin、GFAP阳性细胞百分比比较
3 讨论
NSCs是一类具有分裂潜能和实现自我更新能力的母细胞,可以通过不对等的分裂方式产生神经组织的各类细胞。通过移植的方式将NSCs植入宿主体内,不但能够向神经系统的病变部位迁移、趋化,而且能够存活、增殖,分化为神经元和胶质细胞,进而促进损伤部位功能的部分恢复。目前,NSCs移植技术业已应用于脑梗塞、脑中风、脊髓损伤等疾病的治疗当中,并取得了一定进展[12]。
神经元是构成神经系统结构和功能的基本单位,通过诱导的方法促进神经干细胞向神经元分化,有利于神经受损后神经功能的恢复[13]。然而,在实验过程中,我们发现,诱导NSCs分化后,其形成的大量的胶质细胞,以星形胶质细胞为主,而神经元细胞却很少。在细胞的培养过程中,星形胶质细胞迅速生长,导致神经元细胞生长缓慢,甚至停止生长,最后大量死亡,给后期的NSCs体内回输实验带来了诸多困难。如何有效的抑制胶质细胞增殖,促进神经元细胞的生长俨然已是亟待解决的问题。脊髓损伤后,神经功能的恢复主要依赖于神经元对神经通路的重建,但是神经胶质细胞的大量产生会阻碍神经通路的形成,并且导致脊髓受损部位瘢痕的产生[14]。因此,通过调控因素抑制星形胶质细胞增殖、定向诱导NSCs分化为神经元细胞并促进其生长,对于SCI的治疗意义重大。
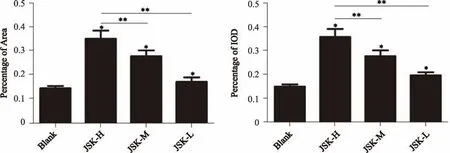
图4 βIII-Tubulin、GFAP的阳性细胞表达荧光定量百分比
JSK是我们结合多年临床实践经验,筛选出具有“祛瘀通督,温肾利湿,调和气血”功效的中药复方。以大补元气之生黄芪为君药;配以理气之枳实,补血之当归,清热凉血之赤芍加强调和气血之力;又配以活血化瘀之川芎、丹参,攻下逐瘀之大黄祛瘀生新;更加搜经剔络之水蛭、蜈蚣和地鳖虫等虫类药通督。诸药配合,共奏“袪瘀通督”之功效。以温补肾阳之肉苁蓉、仙灵脾、益智仁治肾之虚寒;在上之湿治以行气化湿之厚朴;在下之湿治以利水渗湿之泽泻、茯苓,车前子。诸药配合,共奏“温肾利湿”之功效。前期基础研究及临床研究均提示该方对SCI有着良好的功效,在改善脊髓微环境,促进SCI后患者神经功能的恢复方面疗效显著[15-17]。基于该方的良好疗效及神经元在SCI后发挥的重要作用,本实验即尝试探讨JSK治疗SCI是否与其促进NSCs分化为神经元的作用存有一定联系,实验结果(图3、4)显示,JSK能促进NSCs向神经元方向分化,且存在一定的量效关系。NSCs分化的调控机制主要与微环境、基因和信号通路三个方面有关[18]。“脊髓康”改善脊髓微环境的作用已经得到证实[15,19],但其干预NSCs分化的分子机制尚不清楚,仍需进一步探索。
本实验仍存在的问题:1、在取原代NSCs时,为保证孕鼠的孕期的一致性,课题组采用观察未受孕大鼠的动情周期[20]的方法,虽达到了孕期一致的目的,但是浪费了大量时间和精力。目前,课题组也在寻求简便易行的方法;2、虽然JSK含药血清促进了NSCs向神经元分化,但是其具体的分子机制尚不清楚,这是课题组下一步研究的方向;3、人体是一个复杂的环境,如何模拟人体内部环境,进而保证NSCs分化后神经元细胞的存活的问题也是我们努力的方向。
1 PDF(.M).Spinal Cord Injury(SCI)Facts and Figures at a Glance.J Spinal Cord Med,2016,39(2):370-371.
2 Furlan J C,Sakakibara B M,Miller W C,et al.Global Incidence and Prevalence of Traumatic Spinal Cord Injury.Can J NeuroSci,2013,40(4):456-464.
3 Wang H F,Yin Z S,Chen Y.Epidemiological features of traumatic spinal cord injury in Anhui Province.Spinal cord,2013,51(1):20-22.
4 Furlan J C,Noonan V,Cadotte D W,et al.Timing of Decompressive Surgery of Spinal Cord after Traumatic Spinal Cord Injury:An Evidence-Based Examination of Pre-Clinical and Clinical Studies.JNeurotrauma,2011,28(8):1371-1399.
5 Cusimano M,Biziato D,Brambilla E,et al.Transplanted neural stem/precursor cells instruct phagocytes and reduce secondary tissue damage in the injured spinal cord.Brain,2012,135(2):447-460.
6 王建伟,吴毛,马勇.自拟中药方治疗脊髓损伤的实验及临床观察.中国组织工程研究,2006,10(35):16-19.
7 郭杨,马勇,潘娅岚,等.脊髓康对大鼠脊髓损伤后神经功能恢复及脑源性神经营养因子表达的影响.中国康复理论与实践,2014,20(8):701-708.
8 李然,刘立萍,马骥,等.小柴胡汤含药血清对肝癌HepG-2细胞的影响.中国实验方剂学杂志,2013,19(5):217-220.
9 Shi L,Zhao F,Zhu F,et al.Traditional Chinese Medicine Formula"Xiaofeng granules"suppressed gouty arthritis animal models and inhibited the proteoglycan degradation on chondrocytes induced by monosodium urate.Ethnopharmacol,2016,191:254-263.
10 Jing G C,Zhang M R,Ji C,et al.Effect of Chinese herbal compound Naofucong on the inflammatory process induced by highglucose in BV-2 cells.Chin J Integr Med,2016.22(11):832-839.
11 Kigerl K A,Gensel J C,Ankeny D P,et al.Identification of two distinct macrophage subsets with divergent effects causing either neurotoxicity or regeneration in the injured mouse spinal cord.J Neurosci,2009,29(43):13435-13444.
12 Carelli S,Giallongo T,Gerace C,et al.Neural stem cell transplantation in experimental contusive model of spinal cord injury.J Vis Exp,2014,50(94):e52141-e52141.
13 Wang D,Zhang J.Effects of hypothermia combined with neural stem cell transplantation on recovery of neurological function in rats with spinal cord injury.Mol Med Rep,2015,11(3):1759-1767.
14 Ke C,Chen B,Guo S,et al.Differentiation of embryonic versus adult rat neural stem cells into dopaminergic neurons in vitro.NRR,2008,3(8):832-836.
15孙福荣.脊髓康对大鼠脊髓损伤后轴突再生微环境的作用机制研究.南京:南京中医药大学博士学位论文,2013:59-62.
16潘娅岚,马勇,郭杨,等.脊髓康对脊髓损伤大鼠脊髓组织结构及神经生长因子表达的影响.中国实验方剂学杂志,2014,20(15):144-149.
17周龙云.基于小胶质细胞吞噬作用探讨“脊髓康”神经保护效应的研究.南京:南京中医药大学硕士学位论文,2017:28-30.
18 Seki T.Microenvironmental elements supporting adult hippocampal neurogenesis.Anat Sci Int,2003,78(2):69-78.
19吴毛,杨峻峰,王建伟.脊髓康对大鼠脊髓损伤细胞凋亡及生长相关蛋白-43的影响.中华中医药杂志,2015(6):2127-2130.
20陈文俊,谈勇.持续光照影响雌鼠青春期启动及动情周期的机制研讨.中国妇幼保健,2015,30(33):5864-5868.

