中药发挥效应的核心作用方式的科学思考*
王爱云,沈 颖,陈文星,王 旭,华永庆,王 蔚,倪雯婷,吴佳伟,杨 宇,黄 帅,陆 茵**
(1.南京中医药大学药学院药理系江苏省中药药效与安全性评价重点实验室/国家中医药管理局中药药理学重点学科 南京 210023;2.南京中医药大学江苏省中医药防治肿瘤协同创新中心 南京 210023)
长期以来,中药及其复方在临床使用范围广、疗效好,但起效的具体方式和机制仍然不清,阻碍了中医药的进一步研究和被广泛认可。科学阐明中药的起效方式成为中医药学术界迫切需要解决的问题,而学界对于中药起效具体方式的看法也是百家争鸣。中药有效成分大多具有含量低、生物利用度低、非线性量效关系[1]的特点,但临床使用中药却有治疗作用。因而从古至今众多中医药学专家的学术论著试图阐明中药的起效方式,如《神农本草经》提出的“君臣佐使”理论[2]、1996年薛燕等人提出的“霰弹理论”[3]以及张伯礼院士等提出方剂多成分、多靶点的学说[4]等等。当前中药通过多成分、多靶点发挥药效的观点已经成为学术界的共识。对推动中医药的发展有着重要的贡献。
近年来,北京大学蔡少青教授课题组提出中药药效物质“显效形式”的新概念,并提出“叠加作用”的科学假说,认为中药药效物质“显效形式”的“同靶点叠加作用”和“多靶点协同作用”共同构成了中药作用机制的重要内涵[5,6],为中药作用方式和作用特点提供了新解读,引发了中药药理学领域学者和专家的思考和争鸣,对中药药理学的发展起到积极的推动作用。本文根据当前中药研究中的研究成果及临床案例对中药起效的核心方式作了进一步思考。主要有以下个人观点:
1 中药药物成分结构的多样性及作用靶点的复杂性决定了中药药效发挥作用的方式也是复杂多样的
1.1 结构相似的化合物作用在相同的靶点上,但效应不一定会叠加
靶点与成分产生药理活性需要同时满足多个条件,例如:化合物与靶点的亲和力、内在活性、氢键结合情况等,结构上的微小差异会较大程度影响化合物与靶点的结合[7]。研究表明,很多原子组成和排列顺序完全一致的手性异构体成分,却可以作用在截然不同的靶点上。如手性异构体18β-甘草酸(18β-GL)和18α-甘草酸(18α-GL)在靶点结合上存在很大差异,18α-GL由于存在位阻效应,其亲脂性大于18β-GL,在体内易与类固醇激素受体的靶细胞受体结合,抗炎作用比18β-GL强很多,并且18β-GL结合细胞靶点在转录水平可诱导CYP3A1表达,而18α-甘草酸在不同靶标可抑制CYP3A1表达[8](图1)。18β-GL还具有抗补体活性,对补体经典途径有很强的抑制作用,而18α-GL则没有这种活性。
1.2 药效基团相同的化合物,若与同一靶点的不同亚型结合也会产生不同的效应,并不会发挥“叠加效应”
如有相同β-内酰胺药效基团的抗生素(包括青霉素及其衍生物、头孢菌素、单酰胺环类、碳青霉烯类和青霉烯类酶抑制剂等),按照结合靶点不同分为三类:第一种是与青霉素结合蛋白(Penicillin-binding protein,PBP)2特异性结合的β-内酰胺类抗生素(如苯唑西林),能够使细菌的形态变成卵形;第二种是与PBP3优先结合的β-内酰胺类抗生素(如头孢苄胺),能够特异性地抑制细菌细胞的分裂;第三种是与PBP1优先结合的β-内酰胺类抗生素,抑制细胞的延生并引起细胞的裂解(如头孢噻啶)[9,10]。因此,结构相似的成分并不一定能够作用于相同靶点,发挥“叠加作用”。
1.3 结构相似的化合物作用于相同靶点,效应却截然相反
“叠加作用”的一个重要理论前提就是中药经体内代谢之后会产生一系列结构相似的代谢产物,而这些成分能够作用于相同的靶点,从而产生效应的叠加。事实上即使结构类似的成分能够作用在相同的靶点上,其与靶点结合的亲和力和内在活性也存在差别。本文作者通过对PubChem Compound数据库中纳洛酮和吗啡的二维以及三维结构进行软件分析之后发现,纳洛酮与吗啡的三维结构相似度达到86%,而仅有一个基团不一样,属于结构类似物(见表1、2),两者作用在相同的受体——阿片受体上,但效应却不一样,纳洛酮作为纯粹的阿片受体拮抗药,可以竞争性拮抗各类阿片受体激动剂吗啡的兴奋作用。那么中药中的那些结构类似的化学成分,即使作用在相同的靶点上,由于与靶点结合的亲和力以及内在活性不同,最终表现出的效应可能不会是叠加的方式。

图1 甘草酸手性异构体与受体结合差异性示意图

表1 纳洛酮与吗啡二维结构比对结果
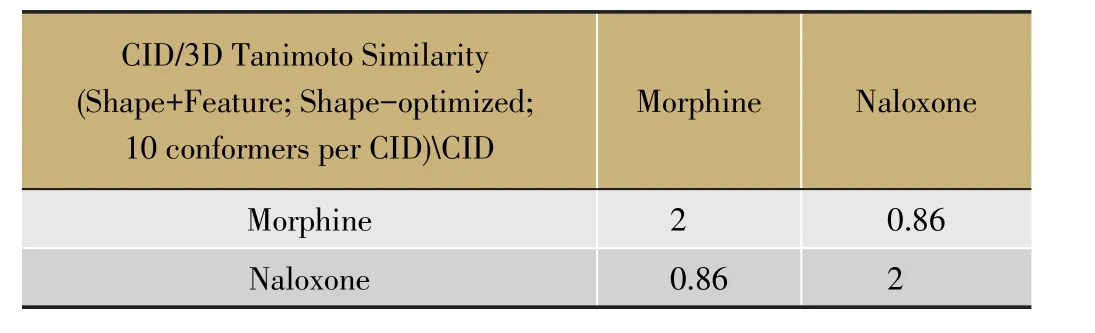
表2 纳洛酮与吗啡三维结构比对结果

图2 药物经肝脏代谢后药效活性差异性
中药每一种成分进入人体可能产生50种甚至100种代谢产物,但代谢产物和原型形式是否都具有相同的药理活性,到目前还缺乏大量的数据来支撑。既往的研究表明,机体对药物代谢的同时会对外来化合物进行水解或者加和,目的是为了加速药物从体内排出到体外。研究表明中药原型成分及其代谢物有时具有相反的药理作用,陈声武[11]等在研究人参皂苷Rg1及其代谢物Rh1对THP-1细胞分泌的肿瘤坏死因子α(TNF-α)的作用时发现,Rg1有促进分泌的作用,相同浓度下,Rh1代谢物有抑制THP-1分泌TNF-α的作用。大量研究表明,丹参酮IIA是隐丹参酮的主要代谢物,而丹参酮IIA和隐丹参酮在抗菌、抗肿瘤作用机制方面都存在较大差异,故效应不会叠加[12]。
1.4 中药成分经过Ⅰ相代谢,很多药效成分结构都发生改变,药效活性丧失
如Liang J[13]等对赤芍在家兔血浆中代谢成分进行质谱分析发现,其中来源于儿茶素的有33种相关代谢产物,然而只有少量以儿茶素-O-葡糖苷酸为代表的代谢产物与儿茶素结构相似,其他很多以硫酸3-羟基苯丙酸为代表的苯丙酸盐类产物,结构和药理活性都与儿茶素有差异(图2)。绝大多数药物经过生物转化后,药理活性减弱或消失,只有极少数的药物被转化后才出现药理活性。
2 中药作用方式复杂而多变是为了适应环境变化进化而来
2.1 进化带来受体杂泛性和中药成分的杂泛性,二者互为因果、相互依存
中药绝大部分来自于自然界,在漫长的进化过程中,遭遇干旱、高盐、营养缺乏等逆境胁迫时能通过自身调节而“努力”使自身适应环境[14,15],逐步演化出适应性的自身结构与能力(即非生物胁迫);同时生物体也受同一环境下其他生物体所影响(即生物胁迫)。因此应当从进化和生态的角度理解中药成分丰富、性质多样、作用复杂的原因,也就是中药成分和受体蛋白杂泛性的原因。
郭宗儒[16]提出,药物产生杂泛性的根源是蛋白的杂泛性,两个方面互为因果而相互共存。杂泛性本身包含了受体(蛋白)杂泛性和配体(药物分子)杂泛性两个方面。受体杂泛性系指结构多样的配体完全有可能作用于同一个靶点,而药物的杂泛性是指一种药物分子也能与多种靶标发生相互作用,因而可以引起相同或不同的药理作用、甚至毒理作用的现象[17]。例如,氯氮平对5羟色胺(5-HT2A,5-HT2C,5-HT6,5-HT7)受体、多巴胺(D4)受体、毒蕈碱(M1-5)受体和肾上腺素能(α1和α2)受体有nmol·L-1水平的作用,通过作用于多个靶点治疗精神分裂症,而不会产生锥体外系的副作用[18]。所以,相比于叠加作用,单个中药成分更有可能是通过作用于不同的靶点发挥协同增效作用而非叠加作用。丹参酮ⅡA在抑制血管平滑肌细胞迁移中有一定作用[19]。通过作用机制研究发现丹参酮ⅡA能同时作用于蛋白激酶B和基质金属蛋白酶9从而抑制人主动脉平滑肌细胞迁移[20]。姜黄素可作用于环氧合酶(COX-1/COX-2)、脂肪氧化酶(LOX)、TNF-α、干扰素γ(IFN-γ)等多个靶点从而发挥协同抗炎作用[21],其抗炎活性可比拟甾体类抗炎药和非甾体类抗炎药且副作用少[22]。小檗碱能够通过作用于胰岛素受体而促进其表达,同时抑制α葡萄糖苷酶活性,通过催化AMPK Thr172磷酸化等方式发挥协同降糖作用[23]。所以“叠加作用”所认为的含有相同药效团的系列化合物会被受体认为是同一物质从而产生叠加作用,仅仅体现了受体杂泛性,而未考虑到系列化合物同样具有杂泛性。相比于叠加作用,中药各成分更有可能是作用于多个靶标,发挥强大的靶点间的协同作用而发挥药效。如中药黄芩中的三种主要成分黄芩苷、黄芩素和汉黄芩苷均能作用于不同的靶点,发挥靶点间协同作用抑制肝癌细胞增殖。其中黄芩苷能够上调p38水平、促进Cyclin A,CDK2,CyclinD1表达,并且激活RelB,p52诱导细胞自噬发挥抗肿瘤增殖作用[24-26];黄芩素能够通过抑制肝癌细胞CD24表达,下调p21/CDKN1A及p27/CDKN1B水平,上调MiR-3127-5p水平诱导S期细胞周期阻滞抑制肿瘤细胞增殖[27,28];汉黄芩苷能够作用于NF-κB及Bcl-2,抑制其表达水平,下调IκB和p65磷酸化水平,同时促进核内c-myc和Nrf2的表达,增强活性氧诱导的细胞凋亡从而抑制肝癌细胞增殖[29,30]。基于以上,黄芩中各成分不仅能够作用于多靶标且各成分之间亦能发挥协同作用抑制肝癌细胞的增殖从而发挥抗肿瘤作用。(见图3)

图3 黄芩多成分协同抑制肿瘤细胞增殖机制
2.2 有些中药成分不经吸收入血就可发挥药理作用
目前大部分中药(复方)以水煎剂口服为主,生物利用度低也是中药治疗的重要瓶颈之一。中药口服吸收入血的成分较少,且水溶性成分在体内的吸收、分布、代谢、排泄较差,文献报道认为,中药成分中很大一部分决定药理效应的主导分子并不需要与其他同系类成分发生叠加就能发挥药效,并且这些起着决定作用的成分有的甚至不需要吸收入血或是不需要达到病变部位的靶器官、靶组织就能发挥作用。其中最典型的成分就是黄连中的主要有效成分小檗碱,药代动力学研究表明,大鼠灌胃小檗碱100 mg/kg后,小檗碱的生物利用度仅为0.68%[31],而人单次口服400 mg后最大血浆浓度也仅为0.4 ng·L-1[32],但却具有很好的抗痢、抗传染性原虫、抗肿瘤、降血糖、调血脂等多种药理活性[33]。按照现代药理学观点,一种药物如果不能进入血液就难以产生药理作用,因为药物作用于细胞需要通过血液循环输送到靶细胞。目前许多研究表明,小檗碱可通过改善肠道菌群结构而产生治疗代谢性疾病的疗效[34-37],例如,小檗碱能够通过增加高脂血症大鼠肠道拟杆菌属、劳特氏菌属,减少埃希氏菌,发挥抗高脂血症作用。另外,最新研究显示小檗碱能够改善肠道菌群结构、促进肠道菌群产丁酸,降低体内血脂和血糖水平从而调节机体能量代谢[38]。说明小檗碱药效的发挥并不主要是通过药物入血,也与改善肠道菌群结构等因素密切相关。类似的例子还有泻下药芒硝,具有泻热通便、润燥软坚、清火消肿之功效[39]。芒硝主要成分为超过90%的硫酸钠,口服后水解生成大量硫酸根离子不易被肠壁吸收,使肠内渗透压升高后致泻,同样芒硝致泻也并不是因为药物成分吸收入血发挥药效的。此外中药姜黄中的姜黄素也是一个非常重要的例子,1978年Bo等[40]研究了姜黄素在生物体内的吸收、分布、代谢和排泄情况,得出姜黄素在胃肠道中吸收极差的结论[41]。Cheng等[42]对患5种恶性疾病的25例患者进行了临床前瞻性研究,服用姜黄素3个月可以明显改善病变组织。另外还有研究表明[43],持续使用姜黄素可以改变肠道菌群的构成,可以调节大肠杆菌、拟杆菌等肠道菌群,使其恢复动态平衡[44]。(如图4)
综上所述,笔者认为:人作为复杂的机体,中药(复方)如何发挥药理效应?中药如何到达机体内靶点?如何分布?吸收入血的成分又是多少?这些问题都需要进一步思考和探究。

图4 中药药效成分不经吸收入血发挥药理效应
2.3 基于锁和钥匙的受体理论,发挥效应的量可以极其微量便可以发挥作用
受体具有灵敏性、特异性、可逆性、饱和性等特征,一旦被激活可以产生瀑布式的级联反应,从而使得生理效应放大(并非叠加作用),因此,激活受体的配体仅需要极微量便可引起信号通路的级联反应从而产生药理效应。同时机体还有负反馈机制,调控其机体的生理反应,使机体处在平衡状态。如交感神经释放的去甲肾上腺素除了可以激活突触后膜的α受体产生生理效应外,还可以激活突触前膜的α2受体,抑制去甲肾上腺素的释放;从而使得机体处于一定的平衡状态。除此以外,机体还有副交感神经系统对器官或者功能的双重支配,互为拮抗,使机体平衡。受体占领学说认为药物的效应是基于药物分子与受体的交互作用的。而“叠加作用”理论认为,相同药效基团的化合物通过叠加使原来血药浓度很低的各个原形成分及代谢产物的浓度叠加而达到起效的必要血药浓度或靶药浓度,从而发挥药效作用。1933年英国药理学家Clark从定量角度首次提出了受体占领学说[45],认为药物效应与药物占领受体的数量存在绝对的线性关系。后来,Stephenson[46]加以纠正,发现药物只需占领一小部分受体即可产生最大效应,同时引入了效能(efficacy)的概念。其后在1956年,Nickson[47]等证明许多激动剂,如组织胺在极低的受体占有率下就可以达到最大效应,从受体学说角度阐述了受体占有率和药效之间存在一种非线性关系。所以笔者认为,具有受体亲和力的微量中药成分很有可能只需要具备一定的内在活性和较低的浓度,能够结合一小部分受体即可产生最大效应,并不需要药物成分在同一靶点上进行叠加发挥出药效。基于受体占领学说,使用“叠加作用”作为中药药效成分起效的核心方式还值得进一步推敲。
此外“叠加作用”认为中药中的显效形式作用于同一受体之间产生药效的叠加。笔者对此提出质疑,因为当显效形式作用于同一受体时,即使受体数量足够多,也肯定会存在竞争性结合。因此笔者认为“显效形式”作用于同一受体时,也应存在竞争结合的现象。除此之外,已经被受体结合的药物既可以因为反应体系中药物浓度的改变而解离,也可以被高亲和力或高浓度的其它特异性药物所置换。“叠加作用”在描述其基于血药浓度的叠加而产生效应的叠加时忽略了药物浓度影响靶点结合的现象。杜晖等在研究5-羟色胺与藁本内酯的亲和作用中发现,5-羟色胺选择性激动剂舒马普坦会与藁本内酯竞争性地结合人体内的5-羟色胺受体,而不是叠加的效果[48];(图5)也有研究表明,双酚A(BPA)以及对-壬基酚(p-NP)这两种外源性的雌激素都能够与雌二醇竞争性地与小鼠体内雌激素受体结合,当BPA或者是p-NP的浓度升高时,BPA与p-NP都可以置换原本结合在雌激素受体上的雌二醇,并最终导致雌二醇与雌激素受体的结合率降低[49]。刘洁等采用竞争置换法研究了盐酸小檗碱和盐酸药根碱与β2-肾上腺素受体的相互作用,发现盐酸小檗碱和盐酸药根碱与β2-肾上腺素受体只存在一类结合位点,虽然受体数量足够,但两者仍会竞争作用位点[50]。
综上所述,许多例子都表明药物与同一受体结合存在相互竞争作用,而中药量效具有非线性关系的特点,因而中药成分对于同一靶点的竞争,无法用“叠加作用”来阐明其中的复杂机理。如何发挥作用还有待进一步思考。
2.4 生物学事件不是由单一的信号通路来决定,而是由复杂的生物网络调控系统来决定的
2.4.1 信号通路之间具有对话功能,抑制了一条信号通路,可以有其它信号通路被激活,从而效应发生反转
例如在肿瘤治疗中十分重要的抗血管生成疗法,倘若靶向VEGF并阻断了VEGF信号通路,根据“种子”与“土壤”假说,看似可以抑制肿瘤血管生成从而达到抑制肿瘤的效果,实则存在着许多问题。临床研究数据表明,抗血管生成治疗存在着严重的耐药现象,且会增加癌细胞侵袭和转移能力。研究人员发现阻断VEGF的信号通路会减少肿瘤的血管密度,从而加重肿瘤的缺氧,进一步激活HGF/c-Met信号通路,促进癌细胞的迁移和浸润,原本的抗肿瘤作用变成了促肿瘤的作用[51];又如有些选择性的BRAF抑制剂,通过抑制BRAF突变来抑制MEK-ERK信号通路,从而抑制了黑色素瘤的增殖与转移。然而,在靶向该通路的同时,也可能会激活PDGFRβ、PI3K/AKT等通路产生耐药,反而促进了肿瘤的生长[52]。因此,在考虑生物学事件时,不能脱离整体观,以单一信号通路来考虑显得有些片面。
2.4.2 生物靶标之间存在遗传协同致死的关系,可以使得效应放大数千倍
协同致死效应是在大约100多年前,在黑腹果蝇(Drosophila melanogaster)实验中观察到的一种现象。当时的科学家们发现,如果有两个非致死基因同时发生了突变,就有可能会带来致死性的结果。在1997年Hartwell等首次将协同致死的概念拓宽到一个基因突变和一种药物干扰另一个基因的正常功能。这在肿瘤的研究中起到了重要的作用,也使得应用该理论的药物大放异彩,其生物学效应也提高许多。最为成功的就是乳腺癌易感基因(BRCA)和多聚ADP核糖聚合酶基因(PARP)之间的协同致死关系,使得药物的效应得到了显著的增强。在2016年引起轰动的抗癌新药Niraparib,就是针对BRCA1/2基因突变的癌症(卵巢癌和乳腺癌)。BRCA与PARP在人体内均为修复DNA突变的主要基因,而一旦产生突变,则会引起高概率的患癌风险。但是,研究发现,当BRCA与PARP同时失去了功能时,则会引起肿瘤细胞死亡,发挥很好的抗肿瘤作用[53]。因此,生物效应也可以通过生物靶标之间的协同致死关系进行放大。

图5 舒马普坦在被不同浓度藁本内酯饱和的色谱柱上的突破曲线[48]
3 从“君臣佐使”的中药配伍理论来看“叠加效应”的局限性
虽然“叠加作用”可以解释一些中药发挥药效的方式,但并不一定是中药起效的核心方式。笔者从中医“君臣佐使”的药物配伍角度发现了“叠加作用”所存在的不足。传统中医理论认为,中药运用须遵循“君臣佐使”配伍理论。君药即主药,是处方的核心;臣药治疗兼证或起到辅助、加强君药功效的作用;佐药是配合君臣药治疗兼证,或抑制君臣药的毒性,或起反佐作用;使药起到调和诸药,引导君药到达病灶的作用。“君臣佐使”能反映中药复方综合用药、对证治疗、直达病灶、相辅相成的特点。复方黄黛片是临床上治疗急性早幼粒细胞白血病的经典中药方剂,该复方主要由雄黄、青黛、丹参三味中药构成。雄黄的活性成分是四硫化砷,青黛的活性成分是靛玉红,丹参的活性成分是丹参酮。其中四硫化砷直接降解癌蛋白PML-RARα,而丹参酮和靛红玉除了作用于癌蛋白PML-RARα之外,还作用于白血病细胞,促进细胞分化成熟,抑制了细胞周期以及分裂增殖,另外又上调通道蛋白AQP9的表达,增加四硫化砷进入白细胞的浓度。可见复方黄黛片也并非是多个成分的简单叠加,而是通过各成分作用于不同的靶点或者通路,发挥中药“君臣佐使”的特点,表现出共同的药理效应[54]。(图6)
中药中以“君臣佐使”为配伍依据,根据“君-反佐”的配伍原则,将两种相反作用的药物同时配伍,却能协同增效。如中成药二妙丸[55]中苍术与黄柏为对,苍术辛烈温燥,散风除湿解郁;黄柏苦寒沉降,入下焦祛湿热。二药一温一寒,相互制约,相互为用,增强药效。因此,宏观层面上,中药成分间药物作用是相辅相成、相互制约的。“君、臣、佐、使”理论在临床中药处方中起到指导性的作用,复方中的每味药物都有各自的功效和作用,对于疾病不同环节产生不同效应,每味药物都是必须的。药群的组成和主次顺序都决定着中药的药效与药性。
因而从中药“君臣佐使”配伍整合的角度,可以发现中药作用的复杂性。“叠加作用”所阐述的中药起效方式并不能完全解释各种中药发挥药效的模式,只能说“叠加作用”是中药众多起效机制之一。

图6 复方黄黛片治疗急性早幼粒细胞白血病“君臣佐使”机制**** http://www.yaozui.com/p/262167
综上所述,人类医学模式在日新月异地变化着,随着系统生物学及网络药理学的发展,文化多元时代的来临,中药的“叠加作用”引发中药药理工作者更多的科学思考,对推动中药药理的发展有着重要的作用,本文从多个角度对“叠加作用”理论进行了剖析和反证,其目的是期望启发更多人去思考,从而可以更好地正确了解中药。许多中药ADME较差,其作用并非通过吸收入血发挥作用的;结构类似的成分并不一定能够作用于相同的靶点,而即使能够作用于相同的靶点,其亲和力和内在活性也会存在差别;仅仅依赖“叠加作用”可能无法全面解释中药“君臣佐使”的配伍规律。“叠加作用”只是中药众多起效方式之一,还有其他更为重要的起效方式,值得我们去思考。
1 范欣生,段金廒,王中越,等.中药量效关系特征问题的探讨.中华中医药杂志,2009,24(03):270-274.
2 李超,樊巧玲.“君臣佐使”源流探析.辽宁中医药大学学报,2011,13(08):162-163.
3 薛燕.以现代科学阐明中药复方作用机理的霰弹理论及其重要意义.中医药博士论坛:中医药现代研究与未来发展,1997.
4 张伯礼,商洪才,王永炎.复方丹参方的药效物质及作用机理研究.世界科学技术,2003,(05):14-17+78-79.
5 徐风,杨东辉,尚明英,等.中药药效物质的“显效形式”、“叠加作用”和“毒性分散效应”——由中药体内代谢研究引发的思考.世界科学技术-中医药现代化,2014,16(04):688-703.
6 蔡少青,王璇,尚明英,等.中药“显效理论”或有助于阐释并弘扬中药特色优势.中国中药杂志,2015,40(17):3435-3443.
7 杨世安.光学异构体与生物活性.医药工业.1987.(03):138-142.
8 茹仁萍,赵灏,陈晓瑾,等.18α-、18β-甘草酸及其不同配比物对大小鼠的抗炎作用.中国医院药学杂志,2009,29(23):1995-1998.
9 张韬,倪孟祥,邵雷,等.β-内酰胺抗生素作用机制的研究进展.中国抗生素杂志,2015,40(10):785-790.
10 Kitano K,Tomasz A.Triggering of autolytic cell wall degradation in Escherichia coli by beta-lactam antibiotics.Antimicrob Agents Ch,1979,16(6):838-848.
11陈声武,王毅,何忠梅.人参皂苷Rg-1和Rh-1抗肿瘤作用的研究.吉林大学学报(医学版),2003,29(01):25-28.
12房其年,张佩玲,徐宗沛.丹参抗菌有效成分的研究.化学学报,1976,34(03):197-209.
13 Liang J,Xu F,Zhang Y Z,et al.The profiling and identification of the absorbed constituents and metabolites of Paeoniae Radix Rubra decoction in rat plasma and urine by the HPLC-DAD-ESI-IT-TOF-MS(n)technique:a novel strategy for the systematic screening and identification of absorbed constituents and metabolites from traditional Chinese medicines.J Pharm Biomed Anal,2013,83(5):108-121.
14蒋妮,覃柳燕,李力,等.环境胁迫对药用植物次生代谢产物的影响.湖北农业科学,2012,51(08):1528-1532.
15齐红艺,李莉,余洁.Xenohormesis:从进化与生态角度理解中药的生物效应.中国中药杂志,2013,38(19):3388-3394.
16郭宗儒.药物的杂泛性.药学学报,2011,46(4):361-369.
17郭宗儒.药物的杂泛性与成药性.2010年中国药学大会暨第十届中国药师周报告集.2010:58-59
18 Roth B L,Sheffler D J,Kroeze W K.Magic shotguns versus magic bullets:selectively non-selective drugs for mood disorders and schizophrenia.Nat Rev Drug Discov,2004,3(4):353-359.
19张海宏,陈玉成,梁玲,等.丹参酮ⅡA对体外兔血管平滑肌细胞增殖和迁移的影响.四川大学学报(医学版),2008,39(02):188-192.
20 Jin U H,Suh S J,Chang H W,et al.Tanshinone IIA from Salvia miltiorrhiza BUNGE inhibits human aortic smooth muscle cell migration and MMP-9 activity through AKT signaling pathway.J Cell Biochem,2008,104(1):15-26.
21 Hanai H,Sugimoto K.Curcumin has bright prospects for the treatment of inflammatory bowel disease.Curr Pharm Des,2009,15(18):2087-2094.
22 Aggarwal B B,Harikumar K B.Potential therapeutic effects of curcumin,the anti-inflammatory agent,against neurodegenerative,cardiovascular,pulmonary,metabolic,autoimmune and neoplastic diseases.Int J Biochem Cell Biol,2009,41(1):40-59.
23丁阳平,叶小利,周洁,等.小檗碱降糖作用机制研究进展.中草药,2013,44(06):763-769.
24 Li X,Zou K,Gou J,et al.Effect of baicalin-copper on the induction of apoptosis in human hepatoblastoma cancer HepG2 cells.Med Oncol,2015,32(3):72.
25 Yu Y,Pei M,Li L.Baicalin induces apoptosis in hepatic cancer cells in vitro and suppresses tumor growth in vivo.Int J Clin Exp Med,2015,8(6):8958-8967.
26 Tan H Y,Wang N,Man K,et al.Autophagy-induced RelB/p52 activation mediates tumour-associated macrophage repolarisation and suppression of hepatocellular carcinoma by natural compound baicalin.Cell Death Dis,2015,6:e1942.
27 Han Z,Zhu S,Han X,et al.Baicalein inhibits hepatocellular carcinoma cells through suppressing the expression of CD24.Int Immunopharmacol,2015,29(2):416-422.
28 Bie B,Sun J,Li J,et al.Baicalein,a Natural Anti-Cancer Compound,Alters MicroRNA Expression Profiles in Bel- 7402 Human Hepatocellular Carcinoma Cells.Cell Physiol Biochem,2017,41(4):1519-1531.
29 Liu X,Tian S,Liu M,et al.Wogonin inhibits the proliferation and invasion,and induces the apoptosis of HepG2 and Bel7402 HCC cells through NF-κB/Bcl-2,EGFR and EGFR downstream ERK/AKT signaling.Int J Mol Med,2016,38(4):1250-1256.
30 Qian C,Wang Y,Zhong Y,et al.Wogonin-enhanced reactive oxygen species-induced apoptosis and potentiated cytotoxic effects of chemotherapeutic agents by suppression Nrf2-mediated signaling in HepG2 cells.Free Radic Res,2014,48(5):607-621.
31 Chen W,Miao Y Q,Fan D J,et al.Bioavailability study of berberine and the enhancing effects of TPGS on intestinal absorption in rats.AAPS PharmSciTech,2011,12(2):705-711.
32 Hua W,Ding L,Chen Y,et al.Determination of berberine in human plasma by liquid chromatography-electrospray ionization-mass spectrometry.J Pharm Biomed Anal,2007,44(4):931-937.
33 Pazhang Y,Ahmadian S,Mahmoudian M,Shafiezadeh M.Berberineinduced apoptosis via decreasing the survivin protein in K562 cell line.Med Oncol.2011.28(4):1577-83.
34 Han J,Lin H,Huang W.Modulating gut microbiota as an anti-diabetic mechanism of berberine.Med Sci Monit.2011.17(7):RA164-7.
35 Li M,Shu X,Xu H,et al.Integrative analysis of metabolome and gut microbiota in diet-induced hyperlipidemic rats treated with berberine compounds.J Transl Med,2016,14(1):237.
36 Sun H,Wang N,Cang Z,et al.Modulation of Microbiota-Gut-Brain Axis by Berberine Resulting in Improved Metabolic Status in High-Fat Diet-Fed Rats.Obes Facts,2016,9(6):365-378.
37 Zhang X,Zhao Y,Xu J,et al.Modulation of gut microbiota by berberine and metformin during the treatment of high-fat diet-induced obesity in rats.Sci Rep,2015,5:14405.
38 Wang Y,Shou J W,Li X Y,et al.Berberine-induced bioactive metabolites ofthe gutmicrobiota improve energy metabolism.Metabolism,2017,70:72-84.
39洪杏花.芒硝腹部外敷治疗重症胰腺炎的疗效观察.中华全科医学.2012.10(08):1262+1273.
40 Wahlström B,Blennow G.A study on the fate of curcumin in the rat.Acta Pharmacol Toxicol(Copenh),1978,43(2):86-92.
41 Vareed S K,Kakarala M,Ruffin M T,et al.Pharmacokinetics of curcumin conjugate metabolites in healthy human subjects.Cancer Epidemiol Biomarkers Prev,2008,17(6):1411-1417.
42 Cheng A L,Hsu C H,Lin J K,et al.Phase I clinical trial of curcumin,a chemopreventive agent,in patients with high-risk or pre-malignant lesions.Anticancer Res,2001,21(4B):2895-2900.
43刘硒碲,夏宁,梁瑜祯.姜黄素通过调节肠道菌群可改善脂多糖诱导糖尿病.基因组学与应用生物学,2014,33(05):970-974.
44徐春明,刘亚,陈莹莹,等.姜黄素生理活性、代谢以及生物利用度的研究进展.中国食品添加剂,2016,(09):203-210.
45 ARIENS E J.Affinity and intrinsic activity in the theory of competitive inhibition.I.Problems and theory.Arch Int Pharmacodyn Ther,1954,99(1):32-49.
46 STEPHENSON R P.A modification of receptor theory.Br J Pharmacol Chemother,1956,11(4):379-393.
47 NICKERSON M.Receptor occupancy and tissue response.Nature,1956,178(4535):697-698.
48杜晖,周娜,李静静,等.细胞膜色谱法研究5-羟色胺受体与藁本内酯的亲和作用.色谱,2015,33(05):530-534.
49黄毅娜,徐培渝,张敏,等.双酚A和对-壬基酚雌激素受体的竞争性结合.中国公共卫生,2004,20(05):51-53.
50刘洁.β2-肾上腺素受体亲和色谱在黄连活性成分筛选及其相互作用研究中的应用.西安:西北大学硕士学位论文,2008.
51 Pàez-Ribes M,Allen E,Hudock J,et al.Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis.Cancer Cell,2009,15(3):220-231.
52闫桂蕊,徐志建,王贺瑶,等.基于靶标BRAF的抗肿瘤研究进展.药学学报,2012,47(12):1567-1574.
53 Nijman S M,Friend S H.Cancer.Potential of the synthetic lethality principle.Science,2013,342(6160):809-811.
54 Wang L,Zhou G B,Liu P,et al.Dissection of mechanisms of Chinese medicinal formula Realgar-Indigo naturalis as an effective treatment for promyelocytic leukemia.Proc Natl Acad Sci U S A,2008,105(12):4826-4831.
55尹莲,徐立,时乐,等.基于二妙丸类方探讨主从方类方配伍规律的研究思路与方法.世界科学技术-中医药现代化,2010,12(05):679-683.

