类风湿关节炎患者外周血滤泡辅助性T淋巴细胞百分率的变化及意义*
邹晓月,熊御云,张龙锋,王 蓓,徐 静
(江苏大学附属医院检验科,江苏镇江 212001)
论著·临床研究
类风湿关节炎患者外周血滤泡辅助性T淋巴细胞百分率的变化及意义*
邹晓月,熊御云△,张龙锋,王 蓓,徐 静
(江苏大学附属医院检验科,江苏镇江 212001)
目的探讨滤泡辅助性T淋巴细胞(Tfh)百分率在类风湿关节炎(RA)患者外周血中的变化及意义。方法选取该院2016年9-11月收治的RA患者,分为RA活动组与RA稳定组,各35例。另选取同期行健康体检者35例作为健康对照组。用流式细胞术检测受试者外周血CD4+CXCR5+ICOS+Tfh细胞的百分率,分析RA患者外周血Tfh细胞百分率与28个关节疾病活动度评分(DAS28)、抗环瓜氨酸肽(CCP)抗体及类风湿因子(RF)水平的相关性。结果RA活动组外周血Tfh细胞百分率[(0.84±0.16)%]明显高于RA稳定组[(0.64±0.15)%]及健康对照组[(0.56±0.14)%],差异均有统计学意义(P<0.01);且RA稳定组亦高于健康对照组(P<0.05)。RA患者外周血Tfh细胞百分率与DAS28及抗CCP抗体水平均呈明显正相关(r=0.355、0.324,P<0.01),与RF水平无明显相关性(r=0.205,P>0.05)。结论外周血中Tfh细胞百分率的增加可能与RA的发生、发展有关。
滤泡辅助性T淋巴细胞;关节炎,类风湿;流式细胞术
类风湿关节炎(rheumatoid arthritis,RA)是以对称性外周多关节病变为主要表现的慢性自身免疫病,自身抗体引发慢性炎症是RA的重要特征[1]。目前认为患者体内淋巴细胞的高度活化及T、B淋巴细胞之间相互作用导致致病性自身抗体的产生是RA发病的重要因素[2]。B淋巴细胞产生抗体需要T淋巴细胞的辅助,近年有学者认为辅助B淋巴细胞产生抗体的最主要T淋巴细胞亚群是滤泡辅助性T细胞( T follicular helper cells,Tfh)[3]。Tfh细胞分布异常或数量增多或功能亢进均可导致自身抗体的产生,引发自身免疫病[4]。鉴于CD4+CXCR5+ICOS+为Tfh细胞为较合适的表面标志[5],本研究用流式细胞术检测了RA患者外周血CD4+CXCR5+ICOS+Tfh细胞百分率,分析外周血Tfh细胞百分率与28个关节疾病活动度评分(DAS28)、抗环瓜氨酸肽(CCP)抗体及类风湿因子(RF)水平之间的相关性,初步探讨Tfh细胞分布、数量的变化与RA之间的关系。
1 资料与方法
1.1一般资料 70例RA患者为本院2016年9-11月的门诊及住院患者,RA诊断符合美国风湿病学会/欧洲抗风湿联盟(ACR/EULAR)2010年修订的最新分类标准[6]。按照DAS28将患者分为RA活动组(DAS28大于或等于2.6分)与RA稳定组(DAS28小于2.6分)。RA活动组患者35例,男2例、女33例,年龄20~61岁,平均(42±13)岁;RA稳定组患者35例,男3例、女32例,年龄21~63岁,平均(43±12)岁;所有患者无其他自身免疫病。另选取35例性别与年龄相匹配的于本院做健康体检者为健康对照组,排除所有自身免疫病。
1.2主要仪器与试剂 异硫氰酸(FITC)标记的鼠抗人CXC型趋化因子受体5(CXCR5)抗体、多甲藻叶绿素蛋白(PerCP)标记的鼠抗人CD4抗体、藻红蛋白(PE)标记的鼠抗人诱导性协同刺激分子(ICOS)抗体及相应的同型对照IgG1-PE(美国BD公司),淋巴细胞分离液(天津灏洋生物制品科技有限公司),抗CCP抗体酶联免疫吸附试验(ELISA)检测试剂盒(上海科新生物技术股份有限公司),RF免疫比浊法检测试剂盒(美国Beckman Coulter公司)。FACS Calibur流式细胞仪(美国BD公司);DRAGON MK3酶标仪(芬兰Denley公司);IMMAGE 800型特种蛋白分析仪(美国Beckman Coulter公司)。
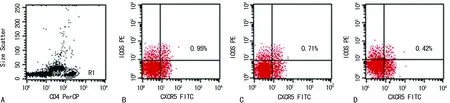
A:设门于CD4+淋巴细胞;B:RA活动组;C:RA稳定组;D:健康对照组
图1流式细胞术检测外周血CD4+CXCR5+ICOS+Tfh细胞
1.3方法
1.3.1外周血单个核细胞(PBMC)的分离 于清晨抽取受试者空腹静脉血4.0 mL,以肝素抗凝。用淋巴细胞分离液分离出PBMC,再以磷酸盐缓冲液(PBS)洗涤3次后,将细胞数调成1×108cells/mL备用。
1.3.2细胞染色 在流式专用试管中加入上述PBMC悬液200 μL、CD4-PerCP 10 μL、CXCR5-FITC 10 μL、ICOS-PE 10 μL后混匀(同时设同型对照管),室温避光静置20 min,加入2 mL PBS洗涤1次后以300 μL PBS重悬细胞待测。
1.3.3流式细胞术检测 用Cellquest软件获取并分析3×106个细胞数据。在CD4-SSC点图上设门于CD4+淋巴细胞,测定其中CXCR5+ICOS+细胞的百分率。
1.3.4抗CCP抗体及RF检测 抗CCP抗体检测按试剂盒说明书进行,RF按试剂盒说明书及特种蛋白分析仪操作规程进行测定。
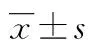
2 结 果
2.1RA患者外周血CD4+CXCR5+ICOS+Tfh细胞百分率 RA活动组外周血Tfh细胞百分率[(0.84±0.16)%]明显高于RA稳定组[(0.64±0.15)%]及健康对照组[(0.56±0.14)%],差异均有统计学意义(P<0.01);RA稳定组亦高于健康对照组,差异有统计学意义(P<0.05),见图1、2。
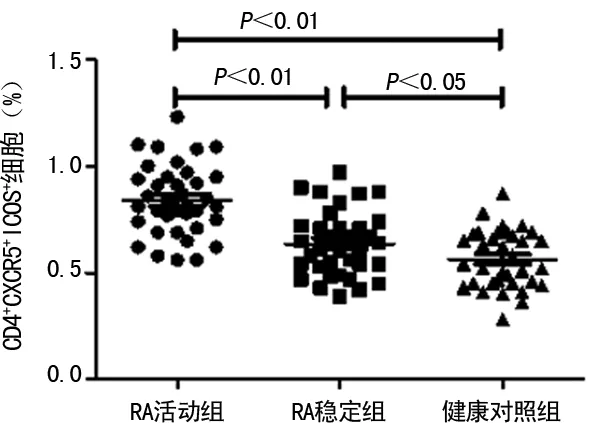
图2 RA患者外周血Tfh细胞的百分率
2.2RA患者外周血Tfh细胞百分率与DAS28、抗CCP抗体及RF水平的相关性 相关性分析显示,RA患者外周血Tfh细胞百分率与DAS28呈明显正相关(r=0.355,P<0.01),与抗CCP抗体水平呈明显正相关(r=0.324,P<0.01),与RF水平之间无明显相关性(r=0.205,P>0.05),见图3。

A:外周血Tfh细胞百分率与DAS28相关性;B:外周血Tfh细胞百分率与抗CCP抗体水平相关性;C:外周血Tfh细胞百分率与RF水平相关性
图3 A患者外周血Tfh细胞百分率与DAS28、抗CCP抗体及RF水平的相关性
3 讨 论
自身抗体导致骨质破坏是RA的重要特征,而自身抗体的产生与T、B淋巴细胞的高度活化及相互作用密切相关[2]。Tfh细胞是新近发现的辅助B淋巴细胞产生抗体的T淋巴细胞亚群,正常情况下该细胞存在于B淋巴滤泡中,当机体发生自身免疫时,会出现在淋巴组织之外[7]。
滤泡归巢受体CXCR5+、ICOS+和CD40配体(CD40L)+是Tfh细胞重要的表面特征[5]。CXCR5是滤泡归巢CXC型趋化因子配体13(CXCL13)的受体,CXCR5同时也表达于B淋巴细胞表面。存在于B淋巴滤泡中的滤泡树突状细胞产生CXCL13继而趋化Tfh细胞与B淋巴细胞一起到B淋巴滤泡中,Tfh细胞与B淋巴细胞相互作用后增殖分化形成生发中心(GC)[8]。在GC中,B淋巴细胞上的诱导性协同刺激分子配体(ICOSL)和CD40分别与Tfh细胞上的ICOS和CD40L 结合,诱导Tfh细胞产生多种细胞因子。Tfh细胞主要的效应因子是其分泌的白细胞介素-21(IL-21),而B淋巴细胞上有IL-21受体,Tfh分泌的IL-21与该受体结合会引发B淋巴细胞增殖,诱导各种B淋巴细胞亚群(记忆B淋巴细胞、生发中心B淋巴细胞、过渡型B淋巴细胞、初始B淋巴细胞、新生B淋巴细胞)分化成免疫球蛋白形成细胞并分泌大量的抗体[9],IL-21还可促使IgG与IgA之间的型别转换[10]。
本研究发现RA活动组外周血Tfh细胞百分率显著高于RA稳定组,RA稳定组亦高于健康对照组,此结果提示RA患者体内存在异位且增多的Tfh细胞,且该细胞数量随疾病活动度的增强而增加。Liu等[9]发现,RA患者除外周血中出现Tfh细胞数量增多外,其血清中的IL-21水平也出现异常升高,且血清IL-21水平与DAS28、抗CCP抗体水平呈显著正相关。本研究虽未检测RA患者IL-21水平与疾病的相关性,但患者外周血Tfh细胞百分率与DAS28、抗CCP抗体水平的相关性可表明,RA患者外周血Tfh细胞数量的增多与病情活动度及RA特异性自身抗体有关。除RA中出现了Tfh细胞异常外,在自身免疫性甲状腺疾病、系统性红斑狼疮等其他自身免疫病中,Tfh细胞数量变化的趋势与本研究相似,且与疾病特异性自身抗体呈显著正相关[11-12]。
由于Th17细胞也分泌IL-21[13],故血清IL-21水平与RA 的相关性并不能代表Tfh细胞与RA 的相关性。在后续工作中,笔者将用流式细胞仪无菌分选出Tfh细胞进行培养,用培养物上清液中的IL-21水平验证Tfh细胞分泌IL-21的能力,并观察IL-21与B淋巴细胞功能之间的关系。
综上所述,RA患者机体内的Tfh细胞可能出现了异位,异位的Tfh细胞可能发生扩增,而扩增的Tfh细胞可能引发B淋巴细胞的过度活化,从而导致B淋巴细胞分泌大量的致病性自身抗体,引起RA患者的免疫损伤。今后,除数量外,笔者将对RA患者Tfh细胞的功能进行研究,以进一步明确Tfh细胞在RA发病机制中的确切作用。
[1]Conigliaro P,Chimenti MS,Triggianese P,et al.Autoantibodies in inflammatory arthritis[J].Autoimmunity Reviews,2016,15:673-683.
[2]Wang J,Shan Y,Jiang Z,et al.High frequencies of activated B cells and T follicular helper cells are correlated with disease activity in patients with new-onset rheumatoid arthritis[J].Clin Exp Immunol,2013,174(2):212-220.
[3]Vinuesa G,Linterman A,Yu Di,et al.Follicular helper T cells[J].Annu Rev Immunol,2016,34:335-368.
[4]Scherm G,Ott B,Daniel Carolin.Follicular helper T cells in autoimmunity[J].Curr Diab Rep,2016,16(8):75.
[5]Zhang X,Lindwall E,Gauthier C,et al.Circulating CXCR5+CD4+helper T cells in systemic lupus erythematosus patients share phenotypic properties with germinal center follicular helper T cells and promote antibody production[J].Lupus,2015,24(9):909-917.
[6]Mueller B,Schiff M,Kaegi T,et al.The new 2010 ACR/EULAR criteria as predictor of clinical and radiographic response in patients with early arthritis[J].Clin Rheumatol,2015,34(1):51-59.
[7]Mesquita D Jr,Cruvinel WM,Resende LS,et al.Follicular helper T cell in immunity and autoimmunity[J].Braz J Med Biol Res,2016,49(5):e5209.
[8]Dan M,Lindestam Arlehamn CS,Weiskopf D,et al.A Cytokine-Independent approach to identify Antigen-Specific human germinal center T follicular helper cells and rare Antigen-Specific CD4+T cells in blood[J].J Immunol,2016,197(3):983-993.
[9]Liu R,Wu Q,Su DL,et al.A regulatory effect of IL-21 on T follicular helper-like cell and B cell in rheumatoid arthritis[J].Arthritis Res Ther,2012,14(6):R255.
[10]Avery T,Bryant L,Ma S,et al.IL-21-induced isotype switching to IgG and IgA by human naive B cells is differentially regulated by IL-4[J].J Immunol,2008,181(3):1767-1779.
[11]Zhu C,Ma J,Liu Y,et al.Increased frequency of follicular helper T cells in patients with autoimmune thyroid disease[J].J Clin Endocrinol Metab,2012,97(3):943-950.
[12]Blanco P,Ueno H,Schmitt N.T follicular helper (Tfh) cells in lupus:Activation and involvement in SLE pathogenesis[J].Eur J Immunol,2016,46(2):281-290.
[13]Raveney J,Oki S,Yamamura T.Nuclear receptor NR4A2 orchestrates Th17 cell-mediated autoimmune inflammation via IL-21 signalling[J].PLoS One,2013,8(2):e56595.
ChangeandsignificanceofperipheralbloodfollicularhelperTlymphocytespercentageinpatientswithrheumatoidarthritis*
ZouXiaoyue,XiongYuyun△,ZhangLongfeng,WangBei,XuJing
(DepartmentofClinicalLaboratory,AffiliatedHospitalofJiangsuUniversity,Zhenjiang,Jiangsu212001,China)
ObjectiveTo investigate the change and significance of follicular helper T cells (Tfh) percentage in the peripheral blood of the patients with rheumatoid arthritis (RA).MethodsThe RA patients treated in this hospital from September to November 2016 were selected and divided into the RA active group and RA stable group,35 cases in each group.Contemporaneous 35 individuals undergoing physical examination were selected as the healthy control group.The percentage of peripheral blood CD4+CXCR5+ICOS+Tfh cells was detected by flow cytometry.The correlations between the percentage of peripheral blood Tfh cells in RA patients with the RA disease activity score 28(DAS28),anti-CCP antibody and rheumatoid factor(RF) levels were analyzed.ResultsThe percentage of peripheral blood Tfh cells in the RA active group was (0.84±0.16)%,which was significantly higher than (0.64±0.15)% in the RA stable group and (0.56±0.14)% in the healthy control group,the difference was statistically significant (P<0.01);moreover the percentage of peripheral blood Tfh cells in the RA stable group was also higher than that in the healthy control group (P<0.05).The percentage of peripheral blood Tfh cells in RA patients had significantly positive correlation with DAS28 score and anti-CCP antibody level (r=0.355,0.324;P<0.01),and had no correlation with the RF level (r=0.205,P>0.05).ConclusionThe percentage increase of peripheral blood Tfh cells in the patients with RA might be related with the pathogenesis and development of RA.
follicular helper T lymphocytes;arthritis,rheumatoid;flow cytometry
10.3969/j.issn.1671-8348.2017.35.007
国家自然科学基金青年基金项目(81301657);江苏省自然科学基金青年基金项目(BK20130476);江苏省检验医学重点实验室开放课题(JSKLM-2014-011)。
邹晓月(1970-),副主任技师,本科,主要从事医学免疫学检验研究。△
, E-mail:191853184@qq.com。
R593.22
A
1671-8348(2017)35-4920-03
2017-07-15
2017-09-15)

