猪圆环病毒2型培养方法的研究
何锡忠,倪建平,李春华,林 鸷,潘 洁,彭丽英*
(1上海市农业科学院畜牧兽医研究所,上海 201106;2上海佳牧生物制品有限公司,上海 201106)
猪圆环病毒2型培养方法的研究
何锡忠1,倪建平2,李春华1,林 鸷1,潘 洁1,彭丽英1*
(1上海市农业科学院畜牧兽医研究所,上海 201106;2上海佳牧生物制品有限公司,上海 201106)
利用有限稀释法从含猪圆环病毒2型(PCV2)的PK15细胞中克隆得到1株含PCV2高感染比例的PK15-A8细胞株,初步研究了该克隆株中PCV2增殖的特性及稳定性。间接免疫荧光试验结果表明,将该克隆株在方瓶中静置培养连续传代40代后病毒滴度最高可达107.5TCID50/mL,用生物反应器培养病毒滴度最高可达108.0TCID50/mL以上。利用常规方瓶培养细胞方法,在37℃培养96 h,收获得到猪圆环病毒2型病毒液。本研究结果为进一步开发高效价的PCV2全病毒灭活疫苗奠定了基础。
猪圆环病毒2型;细胞克隆;病毒培养
以猪圆环病毒2型(Porcine circovirus type 2,PCV2)为主要致病因子引起的疾病统称为猪圆环病毒病(PCV2-associated disease,PCVAD)。目前,PCVAD正在世界各地持续发生与流行,严重危害养猪业健康发展。使用PCV2疫苗免疫是目前防控猪圆环病毒病的主要手段之一,而疫苗的一个重要指标需要高滴度PCV2病毒。目前,对PCV2的培养都建立在猪肾细胞系PK15上,直接培养常因毒价低难以达到制苗所需的效价。
提高PCV2病毒滴度的方法一般是采用D-氨基葡萄糖处理细胞增强病毒的增殖能力,或者采用病毒在细胞上连续培养传代,使分离株随细胞传代次数的递增,病毒滴度有所升高[1-2],但研制周期长,工艺复杂,产品质量较难控制,成本较高,不利于规模化生产。国内多家单位研究通过对PK15母细胞进行有限稀释和细胞克隆,得到对PCV2具有高敏感性的细胞系[2-3],其他类型的细胞系进行有限稀释和细胞克隆的报道也较多。目前,国内外尚无通过含猪圆环病毒2型的PK15细胞进行细胞克隆后培养猪圆环病毒2型的报道。本研究对含猪圆环病毒2型的PK15细胞通过有限稀释法方式克隆得到1株含PCV2高感染比例的PK15细胞株,进行培养猪圆环病毒2型,毒价可达到107.5TCID50/mL,利用微载体培养病毒毒价可达108.0TCID50/mL以上,种细胞扩大培养收获液即为疫苗的原液。
1 材料与方法
1.1 材料
1.1.1 细胞与毒株
PK15细胞(无PCVl污染)由国外引进,PCV2/SN07-12株(微生物保藏登记号:CCTCC NO:V201304)由上海市农业科学院畜牧兽医研究所保存。
1.1.2 主要试剂及仪器
DMEM培养基和胎牛血清为GIBCO公司产品;特异性抗PCV2血清、PCV2间接免疫荧光试剂(韩国JBT生物技术公司)。
Retiga 2000R高敏感度冷CCD荧光数码显微镜(日本OLYMPUS)、Centrifuge 5804(R)台式高速冷冻离心机(德国Eppendorf)。生物反应器购自New Brunswick Scientific Co.Ltd.,USA。
1.2 方法
1.2.1 单个含猪圆环病毒2型PK15细胞克隆及其亚群的培养
将PCV2 SN07-12种毒接种于PK15细胞(无PCVl污染),37℃培养72 h,胰酶消化PK15细胞,采用有限稀释法,按照每孔100μL含20%牛血清细胞生长液、0.5个细胞/孔的细胞数加入96孔板,37℃、5%CO2培养箱中培养,取有单个细胞生长的细胞孔中细胞继续克隆培养,待细胞初步长成单层后胰酶消化,加入含10%牛血清的DMEM培养基,再一传二对应接种到另外一96孔细胞培养板中,37℃、5%CO2饱和湿度培养箱中培养96 h,其中一块板收获,进行筛选鉴定。高阳性细胞孔连续克隆2次。
1.2.2 阳性含猪圆环病毒2型PK15细胞克隆株的筛选
取长满单层96孔细胞培养板,弃去培养液,PBS洗涤细胞3次,经无水乙醇在-20℃固定2 h,封闭液洗涤1次,再用封闭液在37℃作用30 min,加PCV2特异性血清100μL,37℃作用1 h,PBS洗涤细胞3次后,加入荧光标记抗体,在37℃作用1 h,洗涤3次后加封片液(Mounting-Fluid),荧光显微镜下挑选荧光数量最多的克隆株为猪圆环病毒2型高感染性的PK15细胞亚群,重复克隆1次,对含猪圆环病毒2型PK15细胞株进行纯化。
1.2.3 猪圆环病毒2型的增殖
利用胰酶消化含PCV2高感染比例的PK15-A8细胞系,加入细胞生长液,在37℃先培养24 h,弃生长液,加入细胞维持液,继续培养至96 h,收获,反复冻融,即得到猪圆环病毒2型。
1.2.4 含猪圆环病毒2型PK15-A8细胞株的传代
将高阳性细胞孔连续克隆2次得到的含猪圆环病毒2型PK15-A8细胞株按照常规传代细胞培养方法在中方瓶中连续传代,每隔5代进行毒价测定,传代至第40代。
1.2.5 IFA法测定PCV2 TCID50
将健康的PK15细胞(无PCV1污染)用胰酶消化,分装到96孔细胞板,90μL/孔,用含细胞生长液将含PCV2高感染比例的 PK15-A8细胞系第5、10、15、20、30、35、40代次病毒液作10倍递增稀释 10-1→10-8,每孔10μL病毒液接种90μL PK15细胞悬液,每个稀释度的病毒液接种96孔微量培养板一纵排8孔,同时设两纵排正常细胞对照,震荡后放入5%CO2饱和湿度培养箱中培养96 h。
将96孔微量培养板从37℃培养箱取出,甩掉板内液体,PBS洗涤1次,无水乙醇-20℃固定2 h,封闭液(含100 mL/L胎牛血清的PBS)洗涤1次,封闭液37℃作用30 min,加一抗37℃作用1 h,洗涤液清洗3次,加荧光标记抗体37℃作用1 h,洗涤液清洗3次,每孔加1滴Mounting-Fluid,在荧光显微镜下观察试验结果。按Reed-Muench法计算PCV2的TCID50[4]。
1.2.6 5 L生物反应器培养PCV2病毒
采用微载体浓度为5 g/L,取10、20、30、40代含PCV2高感染比例的PK15-A8细胞系的细胞接种到微载体,细胞密度4.5万个/mg,使用低糖 DMEM培养基培养,其余培养条件按照常规方法控制,培养96 h收获。
2 结果与分析
2.1 1株含PCV2高感染比例的PK15细胞系获得
通过对含PCV2高感染比例的PK15细胞进行2轮克隆筛选,第2轮克隆筛选IFA法测定的阳性率为100%,获得了1株含PCV2高感染比例的PK15-A8细胞克隆株(图1)。该克隆细胞株培养收获液的毒价达107.0TCID50/mL(表1)。
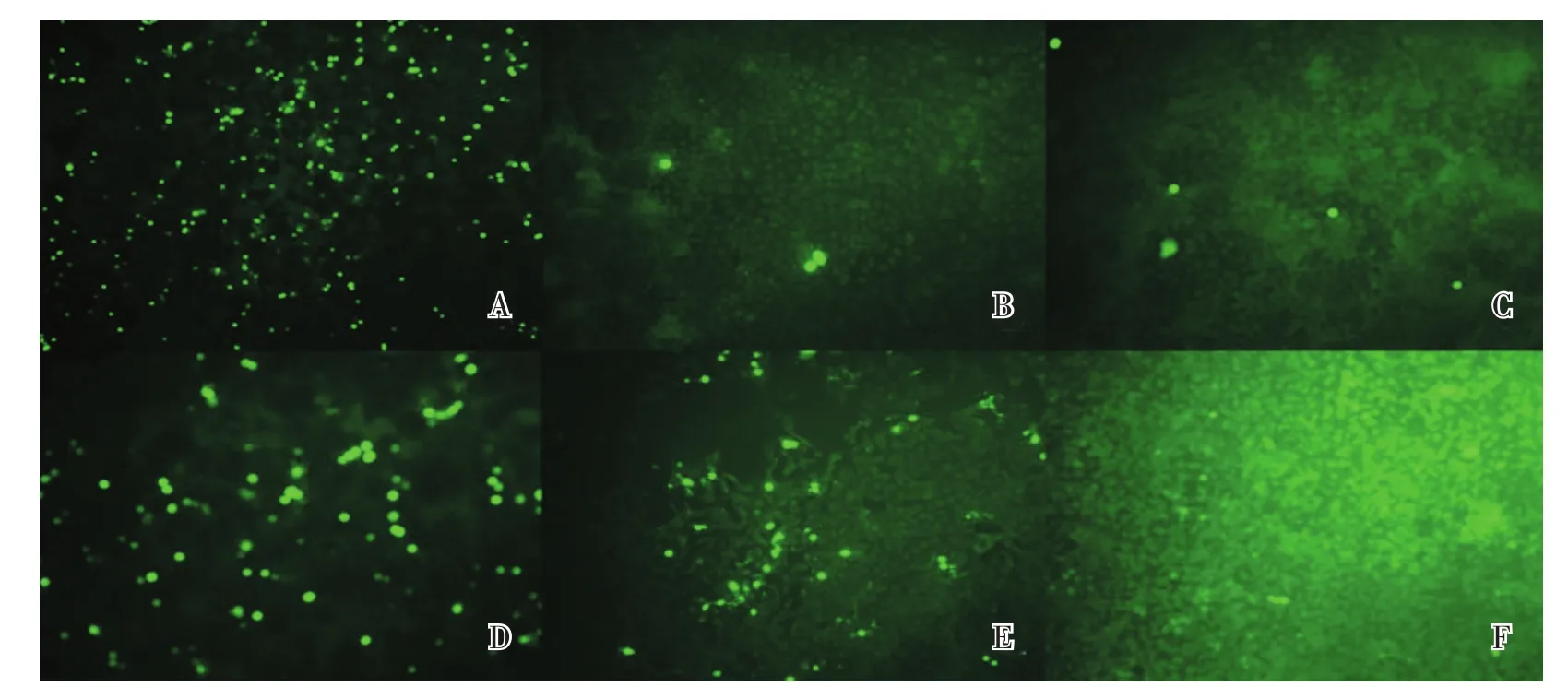
图1 含猪圆环病毒2型PK 15细胞克隆株的筛选结果Fig.1 Screening of PCV2-containing cloned strain of PK15 cells
2.2 猪圆环病毒2型的增殖结果
37℃培养,收获细胞培养物,冻融3次,即得到猪圆环病毒2型病毒液。
2.3 含猪圆环病毒2型PK15-A8细胞株的传代结果
通过连续传代PK15-A8细胞克隆株至第40代,观察到PK15-A8细胞系每个代次的细胞均呈现典型的梭状,并且形态未发生变化。对于PCV2的增殖特性试验表明,40代后方瓶收获细胞培养物的毒价维持在107.0TCID50/mL以上(表1)。

表1 PK15-A8细胞不同代次病毒增殖情况Table 1 PCV2 proliferation in different passages of PK 15-A8
2.4 微载体培养猪圆环病毒2型的结果
利用5 L生物反应器培养4代次病毒增殖特性比方瓶更好,毒价可达108.0TCID50/mL以上(表1)。
3 讨论
3.1 过去PCV2在PK15细胞上病毒增殖滴度较低,难以达到制备全病毒灭活疫苗的要求[5-6]。本课题组利用PCV2在PK15细胞内繁殖时不产生细胞病变这一特性,又避免PK15细胞对不同PCV2种毒敏感性存在差异[7-8]。本研究对含PCV2高感染比例的PK15细胞系进行细胞克隆,挑选出含PCV2高感染比例的PK15-A8细胞克隆株。该克隆细胞株细胞形态均一、生长性能好、消化分散,连续传代40代,病毒毒价可稳定在107.0TCID50/mL以上。
3.2 本试验研究了利用胰酶消化含PCV2高感染比例的PK15-A8细胞系并接种于细胞培养瓶内,加入细胞生长营养液,在37℃培养24 h,弃生长液,再加入细胞维持液,于37℃培养96 h,收获细胞培养物,冻融3次,即得到猪圆环病毒2型病毒液。省去传统生产工艺中的种毒复壮、病毒接种、吸附和采用D-氨基葡萄糖处理细胞等工艺,优点为工艺简单、操作方便、病毒滴度高、易于进行标准化控制,为PCV2灭活疫苗开发奠定了基础。
3.3 国内兽用生物制品企业以前生产大多属于采用手工作坊方式,生产成本高且生产率低,而生物反应器生产成本低产能高。因此通过生物反应器生产可以克服PCV2在培养过程中效价低的缺点,为病毒的后续研究奠定了基础[7]。国内有些单位已通过在生物反应器微载体培养时的初始接种密度和微载体接入量的优化,使该悬浮培养系统所培养的PK15-B1细胞能达到高细胞密度352—380万个/mL;利用NBS生物反应器自动补料程序收获病毒液,实现了连续收获5 d,病毒滴度均不低于107.4TCID50/mL,提高了病毒收获率[8]。本项目组利用生物反应器培养毒价可达108.0TCID50/mL以上,不仅优于本细胞系方瓶的静止培养,同时也优于其他细胞系培养;对于PCV2高感染比例的PK15-A8细胞系在生物反应器微载体培养,如何通过生物反应器自动补料程序收获病毒液,进行连续收获,有待进一步研究。
[1]ZHU Y,LAU A,LAU J,et al.Enhanced replication of porcine circovirus type 2(PCV2)in a homogeneous subpopulation of PK15 cell line[J].Virology,2007,369(2):423-430.
[2]彭伍平,王延辉,胡东波,等.猪圆环病毒2型PK15细胞系高敏感性细胞的克隆[J].中国兽药杂志,2010,44(4):37-39.
[3]罗维,赵墩,蒋大良,等.适合猪圆环病毒2生长的PK15均质细胞株的构建[J].湖南农业大学学报,2013,39(4):404-408.
[4]王林山,尹燕博,王林山,等.PCR和IFA测定猪圆环病毒2型半数细胞培养感染量的比较[J].上海农业学报,2013,29(1):34-38.
[5]GILPIN D F,MCCULLOUGH K,MEEHAN B M,et al.In vitro studies on the infection replication of procine cireovirus type 2 in cells of the procine immmne system[J].Veterinary Immunology and Immunopathology,2003,94(3/4):149-161.
[6]MEERT P,MISINZO G,MCNEILLY F,et al.Replication kinetics of different procine cireovirus 2 strain in PK-15 cells cardiomyocytes and maerophages[J].Arch Virol,2005,150(3):427-441.
[7]何锡忠,李春华,倪建平,等.用微载体系统培养PK15细胞生产猪圆环病毒2型[J].上海农业学报,2010,26(4):149-151.
[8]闪伊红,王进产,郭丽霞,等.猪圆环病毒2型培养工艺研究[J].中国畜牧兽医文摘,2016,32(3):56-57.
Study on a culturemethod of porcine circovirus type 2
HE Xi-zhong1,NIJian-ping2,LIChun-hua1,LIN Zhi1,PAN Jie1,PENG Li-ying1*
(1Animal Husbandry and Veterinary Research Institute,Shanghai Academy of Agricultural Sciences,Shanghai201106,China;2Shanghai Jiamu Biological Products Company Limited,Shanghai201106,China)
From PK15 cells containing porcine circovirus type 2(PCV2),a PK15-A8 cell strain with a high PCV2 infection rate was cloned by a limiting dilution method,and then its PCV2 proliferation characteristics and stability were preliminarily studied.The indirect immunofluorescence test showed that the cloned strain could be up to 107.5TCID50/mL in virus titer after static culture and continuous passage for40 times in a square bottle,and could be over 108TCID50/mL in virus titer after bioreactor cultivation.The PCV2 was harvested after 96-h conventional culture at37℃in a square bottle.The above results laid a foundation for further development of high-titer inactivated PCV2 totivirus vaccine.
PCV2;Cell clone;Virus culture
2016-11-02
上海市闵行区科委项目(2014MH254)
何锡忠(1966—),男,硕士,高级兽医师,研究方向:兽医传染病的诊断和疫苗研制
*通信作者,E-mail:pengliying2010@aliyun.com,Tel:021-62202534
S852.65
A
1000-3924(2017)06-049-04
程智强)

