猪圆环病毒2d亚型病毒样颗粒的制备
夏 叶,郭佳宏,廖学文,李春华,易建中,凌红丽,蒋贻海,缪德年*
(1上海市农业科学院上海种猪工程技术研究中心,上海 201106;2青岛蔚蓝生物股份有限公司,青岛 266001)
猪圆环病毒2d亚型病毒样颗粒的制备
夏 叶1,郭佳宏1,廖学文1,李春华1,易建中1,凌红丽2,蒋贻海2,缪德年1*
(1上海市农业科学院上海种猪工程技术研究中心,上海 201106;2青岛蔚蓝生物股份有限公司,青岛 266001)
为了制备猪圆环病毒2d亚型病毒样颗粒,根据GeneBank上公布的PCV2d亚型HB-MC1株的序列和大肠杆菌密码子使用频率表优化合成PCV2d亚型ORF2基因,克隆到原核表达载体pET30a(+),获得重组表达质粒pET30a-Cap2d,将该质粒转化入Rosetta(DE3)宿主菌,IPTG诱导表达。利用SDS-PAGE对目的基因的表达及产物的可溶性进行分析,利用Western blot和琼脂凝胶免疫扩散试验鉴定重组蛋白的免疫原性,并利用电镜技术鉴定重组Cap2d蛋白形成的病毒样颗粒。SDS-PAGE结果表明PCV2d的ORF2基因在大肠杆菌中得到了高效可溶性表达;电镜下观察超声破碎后的上清中存在大量直径约17 nm的病毒样颗粒;Western blot和琼脂凝胶免疫扩散试验结果表明该可溶性蛋白可与猪PCV2阳性血清特异性结合,具有较好的免疫原性。本研究为制备PCV2d亚单位疫苗和相关检测试剂盒奠定了基础。
猪圆环病毒2d亚型;ORF2基因;可溶性表达;病毒样颗粒
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是引起断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)、猪皮炎肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)、增生性坏死肺炎(Proliferative necrotic pneumonia,PNP)等猪圆环病毒相关疾病(Porcine circovirusassociated disease,PCVAD)的主要病原[1]。目前,PCV2在世界各国普遍存在,在中国猪群中的流行也十分严重,给我国养猪业造成严重经济损失,制约了养猪业的发展[2-3]。
PCV2可分为PCV2a、PCV2b、PCV2c、PCV2d和 PCV2e等多个亚型[4]。2004年前 PCV2的流行毒株以PCV2a亚型为主,但近年来PCV2的流行趋势逐渐由PCV2a亚型转变为PCV2b亚型,且不断有PCV2d和PCV2e两种新亚型的出现[4]。Guo等[5]对分离于2004—2008年的19个PCV2分离株进行序列分析发现,2株属于PCV2a亚型,14株属于PCV2b亚型,3株属于PCV2d亚型,且PCV2d亚型分离株不与中和单克隆抗体反应,揭示其抗原表位发生了变异。唐志玲等[6]对广东省的5个分离毒株进行序列分析,其中3个毒株属于PCV2b亚型,2个毒株为PCV2d亚型,报道称PCV2b为中国目前流行猪圆环病毒病病原的主导亚型,确认了PCV2d作为一种新亚型在中国的存在。徐妮[7]对山东省的7个分离毒株进行序列分析,其中有6株属于PCV2d亚型,1株属于PCV2b基因亚型,发现PCV2d亚型处于主导地位,PCV2b亚型次之。Xiao等[8-9]对美国2011—2016年的分离毒株进行序列分析发现,2011—2013年PCV2b亚型占主导地位,检测率均高于50%;2014—2016年PCV2d-2亚型的检出率急剧上升,高达70%左右,而PCV2b亚型则逐年降低,目前已不足10%;最新发现的PCV2e亚型[10]近年的检出率均维持在较低水平(<10%)。上述研究说明我国乃至全球PCV2出现了由PCV2b亚型向PCV2d亚型转向的流行态势,这为未来猪圆环病毒疫苗的研制指明了方向。
PCV2疫苗在一定程度上有效控制了PCV2的感染,显著降低了PCV2感染猪群的临床症状,提高了猪的生长性能。目前市场上主要有灭活疫苗和亚单位疫苗两种商品化的PCV2疫苗[11]。灭活疫苗主要有法国梅里亚公司的CIRCOVACⓇ、上海海利生物药业有限公司的LG株疫苗、四川省华派生物制药有限公司的ZJ/C株疫苗、武汉科前动物生物制品有限公司的WH株疫苗和洛阳普莱柯生物工程有限公司的SH株疫苗等。亚单位疫苗主要有美国勃林格公司利用杆状病毒生产的IngelvacⓇCIRCOFLXTM、荷兰英特威公司的CircumventⓇ和PorcillisⓇPCV、武汉中博生物股份有限公司[杆状病毒载体灭活疫苗(CP08株)]、青岛易邦生物工程有限公司的圆环基因工程亚单位疫苗“易圆净”。现有疫苗大多基于PCV2a或PCV2b亚型,尚未有基于PCV2d亚型的疫苗上市。鉴于我国乃至全球由PCV2b亚型向PCV2d亚型转向的流行态势,开展基于PCV2d亚型疫苗的研究具有重要意义[12]。
PCV2 ORF2编码的病毒衣壳蛋白(Capsid protein,Cap)由230—231个氨基酸残基组成,分子量约30 kDa,是PCV2主要的结构蛋白和免疫原性蛋白,其N端段富含碱性氨基酸的高度保守序列为核定位信号肽序列(Nuclear localization signal,NLS)[13-14]。利用昆虫细胞杆状病毒表达系统所表达的Cap蛋白能自发组装成病毒样颗粒(Virus-like particles,VLPs),可刺激机体产生强烈的免疫应答反应[15]。但作为兽用疫苗,利用昆虫细胞杆状病毒表达系统来生产PCV2d亚型Cap蛋白,产量低成本高[12,15]。本研究旨在利用低成本的大肠杆菌表达系统高效表达PCV2d亚型Cap蛋白来制备病毒样颗粒,为进一步开发商品化PCV2亚单位疫苗和检测试剂盒奠定基础,为有效防控PCV2d的感染和流行提供技术支持。
1 材料与方法
1.1 菌株和质粒
pET30a(+)表达质粒购自Merck公司;E.coli Rosetta(DE3)宿主菌购自天根生化科技(北京)有限公司。
1.2 主要试剂
Nde I、Hin d III限制性内切酶、PrimerSTARⓇGXL DNA Polymerase、DNA Marker、蛋白分子量标准、异苯基硫代半乳糖苷(IPTG)等购自Takara公司;胰蛋白胨(Tryptone)、酵母提取物(Yeast extract)购自Oxoid公司;质粒提取试剂盒、DNA胶回收试剂盒、预染蛋白Marker、增强型HRP-DAB底物显色试剂盒和卡那霉素购自北京天根生物科技有限公司;PVDF转印膜(FluoroTransⓇ)购自美国PALL公司;PCV2阳性血清检测试剂盒购自西班牙INGENASA公司、羊抗猪IgG购自AbcamⓇ公司。其他试剂均为国产分析纯产品。
1.3 原核表达载体的构建与鉴定
根据PCV2d亚型HB-MC1株基因组中ORF-2编码的Cap蛋白氨基酸序列(GenBank登录号:KM460 824.1),选用大肠杆菌偏爱密码子设计Cap蛋白全基因碱基序列(CAI:0.85),并在其5’端引入Nde I酶切位点,3’端引入终止密码子与Hin d III酶切位点,基因合成后经双酶切克隆至pET30a(+)表达载体,获得携带目的片段的阳性质粒命名为pET30a-Cap2d,转化入E.coli Rosetta(DE3)宿主菌,挑取阳性菌落进行测序鉴定,将序列未发生突变和移码的阳性重组菌株命名为pET30a-Cap2d/Rosetta。
1.4 重组菌的诱导表达及可溶性分析
挑取阳性重组单菌落,接种于含有20μg/mL卡那霉素的LB液体培养基中,37℃条件下200 r/min振荡培养过夜。将过夜培养物以1∶100的比例重新接种于含卡纳霉素的LB培养基中,37℃200 r/min培养至OD600为0.6—0.8,加入终浓度为0.0002 mol/L的IPTG,30℃诱导培养6 h,10 000 r/min离心5 min收集菌体,PBS洗涤菌体1次,再次收集菌体后按初始培养基体积的1/5加入PBS悬浮细菌,在冰水浴中进行超声波裂解。待菌体裂解完全后,4℃条件下12 000 r/min离心10 min,分别收集上清和沉淀,沉淀用与上清等体积的细菌裂解液混悬。分别取样进行12%SDS-PAGE分析,检测Cap蛋白的表达情况。
1.5 W estern blot分析
取诱导后重组菌破碎上清与上样缓冲液预混后进行 SDS-PAGE电泳,电泳结束后,将凝胶中的蛋白恒压100 V湿转1 h至PVDF膜上,PVDF膜用含5%脱脂奶粉的TBST封闭2 h,加入试剂盒中的PCV2阳性血清(1∶100稀释)于4℃孵育过夜;TBST洗膜5次后,加入HRP标记的羊抗猪IgG(1∶5 000稀释),37℃孵育1 h;TBST洗膜5次后,按增强型HRP-DAB试剂盒说明书显色。
1.6 重组蛋白的纯化
收集重组菌诱导表达上清液,加入饱和硫酸铵溶液,使其终浓度为10%,4℃放置30min后12 000 r/min离心15 min,收集上清,加入饱和硫酸铵溶液,使其终浓度为50%,4℃放置30 min后12 000 r/min离心15 min,弃上清,加入原体积1%的PBS重溶,利用非连续性蔗糖密度梯度离心来纯化目的蛋白。蔗糖密度梯度依次为10%、15%、20%、25%、30%、35%以及40%,超速(25 000—30 000 r/min)离心分离1 h后,按0.5 mL/管小心吸取分离液,分别取样进行12%SDS-PAGE分析,将纯度较高的小管汇总到一起,取样与标准BSA一起电泳,通过条带分析软件(Tanon Gis),计算Cap蛋白浓度。
1.7 琼脂凝胶免疫扩散试验
在琼扩板上用七孔梅花形打孔器打孔。将制备的可溶性Cap2d蛋白浓缩液作为检测抗原,用PBS倍比稀释。中心孔加入猪抗PCV2阳性血清,周围孔依次加入不同稀释度的可溶性Cap2d蛋白。37℃温箱中反应过夜,观察结果。
1.8 病毒样颗粒的电镜观察
电镜观察在上海生命科学研究院生物化学与细胞生物学研究所进行。取微量纯化的Cap2d蛋白滴于铜网上,待液体被充分吸收后用2%的醋酸双氧铀染色1 min,待完全干燥后置透射电镜下观察VLPs形成情况。
2 结果与分析
2.1 重组表达载体pET30a-Cap2d构建与鉴定
挑取单克隆,接种于LB液体培养基中扩大培养。提取质粒,用Nde I/Hin d III对质粒进行双酶切。酶切后,重组质粒出现两条片段,其中小片段约为720 bp,与预期片段大小相符;而未酶切对照组未出现小片段,表明目的基因成功插入表达载体pET30a中。测序结果表明,成功构建了重组表达载体pET30a-Cap2d(图 1)。
2.2 重组菌pET30a-Cap2d/Rosetta诱导表达及可溶性分析
收获诱导后菌体进行超声波破碎,分别对超声波破碎后上清和沉淀进行SDS-PAGE电泳,结果显示重组菌pET30a-Cap2d/Rosetta经IPTG诱导后,在上清和沉淀中均出现一分子量约27 kD的特异性条带,与预期结果相符,说明部分目的蛋白以可溶形式存在(图2)。
2.3 表达产物的W estern blot分析
诱导后重组菌破碎上清经SDS-PAGE电泳(图3-a),转PVDF膜后,进行Western blot鉴定,在27 kD目的条带大小位置出现一条明显的印迹(图3-b),表明本研究中诱导表达的Cap2d蛋白可被PCV2特异性多克隆抗体识别。
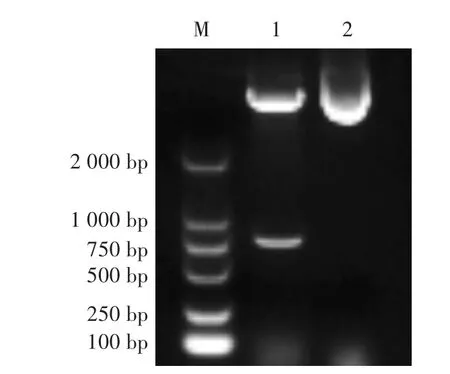
图1 重组质粒pET30a-Cap2d的酶切鉴定Fig.1 Identification of recombinant p lasm id pET30a-Cap2d by restriction enzyme digestion
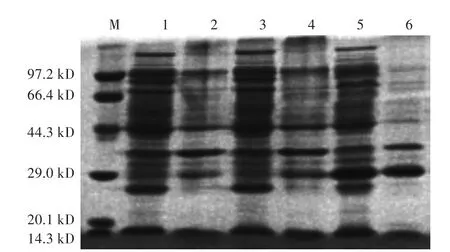
图2 重组蛋白的SDS-PAGE分析Fig.2 SDS-PAGE of recombinant protein
2.4 Cap2d蛋白的纯化
重组菌表达上清经硫酸铵沉淀、蔗糖密度梯度离心后,获得了纯度较高的Cap2d蛋白,经SDS-PAGE电泳(图4)分析,纯度可达90%以上,表达量达100 mg/L培养液。
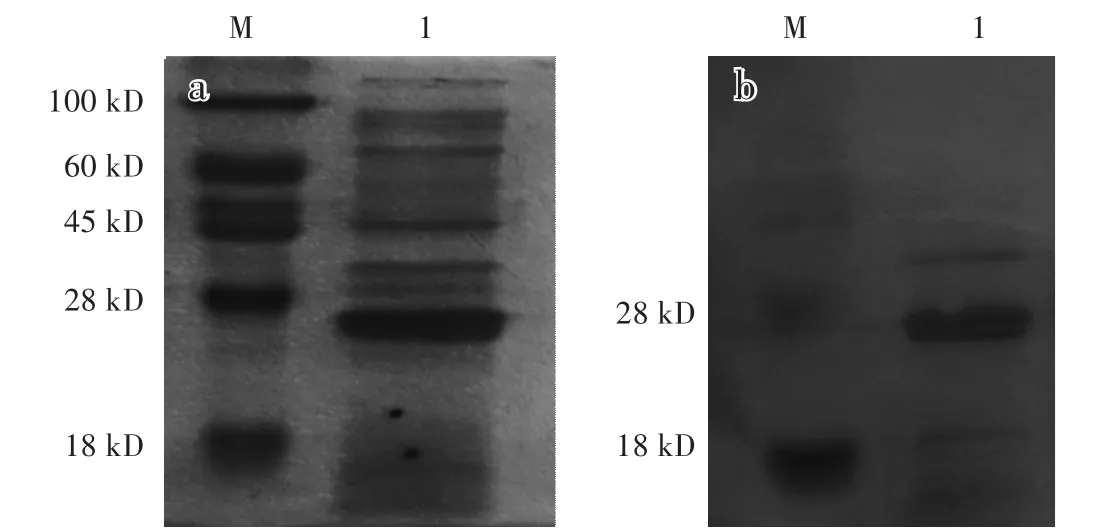
图3 重组蛋白的SDS-PAGE(a)和W estern blot(b)分析Fig.3 SDS-PAGE(a)and W estern blot(b)analysis of recombinant protein

M:蛋白质分子量标准;1:纯化前上清;2:纯化后Cap 2d蛋白
2.5 Cap2d蛋白的琼脂凝胶免疫扩散试验
琼脂凝胶免疫扩散试验结果显示Cap2d蛋白能与PCV2阳性猪血清发生反应,出现沉淀线的最高稀释度为1∶16(图5),即本试验所纯化Cap2d蛋白的琼扩效价为1∶16。
2.6 病毒样颗粒的电镜观察
取微量纯化的Cap2d蛋白进行电镜观察,结果显示重组Cap2d蛋白能自发组装成直径约17 nm的PCV2 VLPs,与PCV2病毒粒子形态相似(图6)。

图5 琼脂凝胶免疫扩散试验Fig.5 Result of agar gel immunodiffusion

图6 Cap2d蛋白形成VLPs的电镜观察(67 000×)Fig.6 Electron m icroscopic observation of Cap2d protein-formed VLPs(67 000×)
3 讨论
近年来,PCV2已成为影响猪养殖业的重要病原之一,疫苗免疫是预防PCV2感染发病的主要手段。由于PCV2在细胞上增殖滴度低,由其制成的灭活疫苗需多次加强免疫才能达到预防效果。Nawagitgul等[14]和Fan等[15]分别将PCV2 ISU31株和Yu-A株的ORF2基因通过杆状病毒表达系统在昆虫细胞Sf9中表达获得30 kD的PCV2 Cap蛋白,电子显微镜观察均发现纯化的Cap蛋白可自装配形成17 nm大小的病毒样颗粒,且可与PCV2感染血清反应。Fan等[15]将含有重组杆状病毒的细胞裂解产物与佐剂混合后免疫21日龄仔猪,激发了高水平的抗体。Martelli等[16]将利用杆状病毒表达系统表达的PCV2 Cap蛋白制成亚单位疫苗,一个剂量即可诱导机体产生体液免疫和细胞免疫,并能有效保护猪体不发生PCVAD。利用重组杆状病毒表达获得的Cap蛋白能够自我组装形成衣壳样粒子(Capsid-like particles)或称病毒样颗粒(Virus-like particles,VLPs)结构,因此成为当前商品化疫苗抗原的重要来源。目前美国勃林格公司的IngelvacⓇCIRCOFLXTM、荷兰英特威公司的CircumventⓇ和PorcillisⓇ以及武汉中博生物股份有限公司的杆状病毒载体灭活疫苗(CP08株)均系采用杆状病毒表达系统制备亚单位疫苗。黄娟等[12]也采用该系统成功表达了PCV2d亚型的Cap蛋白,但SDS-PAGE和间接免疫荧光的结果均表明Cap蛋白在Sf9昆虫细胞中的表达量较低,这也是目前PCV2亚单位疫苗价格较高的原因。
为降低成本,研究者开始利用大肠杆菌表达系统表达Cap蛋白来进行PCV2亚单位疫苗的研制,该疫苗的成本可比目前的进口疫苗降低约70%,比国产疫苗降低约50%。Trundova等[17]将全长或去除NSL序列的PCV2 ORF2基因插入载体pDest17,分别转化入BL21(DE3)和BL21-CodonPlus(DE3)-RIPL感受态细胞。结果显示,全长ORF2仅在BL21-CodonPlus(DE3)-RIPL中获得表达,表达量为3 mg/L培养液;而去除NLS的ORF2在两种感受态细胞中均获得表达,获得的重组Cap蛋白均可与PCV2猪阳性血清发生反应。祁艳华等[18]利用大肠杆菌表达系统表达得到了包涵体形式的全长Cap蛋白。孙伟等[19]表达了去除NLS的Cap蛋白,获得可溶形式的表达,但不能形成VLPs。Marcekova等[20]通过截短ORF2基因、优化密码子以及选择具有较高含量稀有tRNA的BL21-CodonPlus(DE3)-RIPL细胞作为宿主菌等多种方法,最终获得了可溶表达的重组Cap蛋白,但表达量较低且未能形成VLPs。可见,应用大肠杆菌表达系统表达Cap蛋白仍存在诸多问题。近期,赵晓云等[21]根据大肠杆菌密码子使用频率表优化合成PCV2 NJ株ORF2基因,插入原核表达载体pQZ1,通过BL21表达宿主菌实现了PCV2b亚型ORF2基因在大肠杆菌中的可溶表达,重组Cap蛋白体外组装形成VLPs,在应用大肠杆菌表达系统制备病毒样颗粒方面取得了突破。本研究通过优化密码子、宿主菌、表达条件等多种策略的组合应用,首次实现了PCV2d ORF2基因在大肠杆菌中的高效可溶表达,表达量达100 mg/L培养液,且重组Cap蛋白能自发组装成VLPs。Western blot与琼脂凝胶免疫扩散试验均表明,本研究得到的PCV2d Cap蛋白具有良好的免疫原性。后续将进一步开展PCV2d亚单位疫苗、检测试剂盒的研制工作,为有效防控PCV2d的流行提供技术支撑。
[1]GILLESPIE J,OPRIESSNIG T,MENG X J,et al.Porcine circovirus type 2 and porcine circovirus-associated disease[J].JVet Intern Med,2009,23(6):1151-1163.
[2]SEGALÉS J,ALLAN G M,DOMINGO M.Porcine circovirus diseases[J].Anim Health Res Rev,2005,6(2):119.
[3]ZHAIS L,CHEN SN,XU Z H,et al.Porcine circovirus type 2 in China:an update on and insights to its prevalence and control[J].Virol J,2014,11:88.
[4]WANG F,GUOX,GEX,etal.Genetic variation analysisofChinese strainsof porcine circovirus type2[J].VirusRes,2009,145(1):151-156.
[5]GUO L J,LU Y H,WEIYW,et al.Porcine circovirus type 2(PCV2):genetic variation and newly emerging genotypes in China[J].Virol J,2010,7:273.
[6]唐志玲,肖建雄,陈瑞爱,等.5株猪圆环病毒2型全基因克隆和序列分析[J].中国畜牧兽医,2013,40(5):14-18.
[7]徐妮.山东省猪圆环病毒病的血清学调查及PCV2分离株的遗传变异分析[D].泰安:山东农业大学,2014.
[8]XIAO C T,HALBUR P G,OPRIESSNIG T.Global molecular genetic analysis of porcine circovirus type 2(PCV2)sequences confirms the presence of fourmain PCV2 genotypes and reveals a rapid increase of PCV2d[J].JGen Virol,2015,96:1830-1841.
[9]XIAO C T,HARMON K M,HALBUR PG,et al.PCV2d-2 is the predominant type of PCV2 DNA in pig samples collected in the U.S.during 2014—2016[J].Vet Microbiol,2016,197:72-77.
[10]FRANZO G,CORTEY M,SEGALÉS J,et al.Phylodynamic analysis of porcine circovirus type 2 reveals globalwaves of emerging genotypes and the circulation of recombinant forms[J].Mol Phylogenet Evol,2016,100:269-280.
[11]邓秋红,郑杰,刘延亭,等.国内商品化猪圆环病毒疫苗的现状及展望[J].中国兽药杂志,2014,48(2):67-69.
[12]黄娟,袁飞,韩先杰,等.猪圆环病毒2d亚型衣壳蛋白在昆虫细胞中的表达[J].农业生物技术学报,2016,24(9):1346-1353.
[13]LIU Q,TIKOO SK,BABIUK L A.Nuclear localization of the ORF2 protein encoded by porcine circovirus subtype 2[J].Virology,2001,285(1):91-99.
[14]NAWAGITGUL P,MOROZOV I,BOLIN SR,et al.Open reading frame 2 of porcine circovirus subtype 2 encodes amajor capsid protein[J].Journal of General Virology,2000,81(9):2281-2287.
[15]FAN H,JU C,TONG T,etal.Immunogenicity of empty capsids of porcine circovius type2 produced in insect cells[J].Vet Res Commun,2007,31(4):487-96.
[16]MARTELLIP,FERRARI L,MORGANTIM,et al.One dose of a porcine circovirus 2 subunit vaccine induces humoral and cell-mediated immunity and protects against porcine circovirus-associated disease under field conditions[J].Vet Microbiol,2011,149(3):339-351.
[17]TRUNDOVA M,CELER V.Expression of porcine circovirus2ORF2 gene requires codon optimized E.coli cells[J].Virus Genes,2007,34(2):199-204.
[18]祁艳华,王爱萍,李学伍,等.猪圆环病毒2型ORF2基因片段的克隆与原核表达[J].河南农业科学,2010(3):112-115.
[19]孙伟,范红结,徐正军,等.猪圆环病毒2型Cap蛋白的可溶性表达、纯化及鉴定[J].畜牧与兽医,2013(3):66-69.
[20]MARCEKOVA Z,PSIKAL I,KOSINOVA E,etal.Heterologous expression of full-length capsid protein of porcine circovirus2 in Escherichia coli and its potential use for detection of antibodies[J].Journal of Virological Methods,2009,162(1):133-141.
[21]赵晓云,乔绪稳,陈瑾,等.利用E.coli表达猪圆环病毒2型Cap蛋白生产病毒样颗粒疫苗[J].中国农业科学,2015,48(5):976-986.
Preparation of porcine circovirus subtype 2d virus-like particles
XIA Ye1,GUO Jia-hong1,LIAO Xue-wen1,LIChun-hua1,YIJiang-zhong1,LING Hong-li2,JIANG Yi-hai2,MIAO De-nian1*
(1Shanghai Engineering Research Center of Breeding Pig,Shanghai Academy of Agricultural Sciences,Shanghai201106,China;2Qingdao Vland Biotech Limited Company,Qingdao266001,China)
In order to prepare the virus-like particles of porcine circovirus subtype 2d(PCV2d),the ORF2 gene of PCV2d was optimally synthesized according to both Cap protein sequence of PCV2d HB-MC1 strain published by the GeneBank and codon usage of E.coli,and cloned into the prokaryotic expression vector pET30a(+)to get the recombinant expression plasmid pET30a-Cap2d,and then the plasmid was transformed into the host E.coli Rosetta(DE3)so as for the target gene to be expressed by IPTG induction.The target gene expression and the product’s solubility were analyzed by SDS-PAGE,the recombinant protein’s immunogenicity was identified by Western blot and agar gel immunodiffusion test,and the recombinant Cap2d protein-formed virus-like particles(VLPs)were confirmed by electronmicroscopy.The SDS-PAGE indicated that the ORF2 gene of PCV2d was efficiently and solubly expressed in E.coli Rosetta(DE3).The electron microscopic observation showed that there were large numbers of the 17-nm VLPs in supernatant after ultrasonication.The Western blot and agar gel immunodiffusion test showed that the soluble protein could specifically bind the PCV2 positive serum and have good immunogenicity.The above results lay a foundation for developmentof PCV2d subunit vaccine and related testing kits.
Porcine circovirus subtype 2d;ORF2 gene;Soluble expression;Virus-like particles
2016-11-16
上海市市级农口系统青年人才成长计划[沪农青字(2017)第1-17号];上海工程技术研究中心建设专项(16 dz2250700);上海市科委科研计划项目(17140900302)
夏叶(1987—),女,博士,助理研究员,主要从事动物疫病防控技术研究。E-mail:xiayego@163.com,Tel:021-62202519
*通信作者,E-mail:18918162235@163.com
S859.79
A
1000-3924(2017)06-043-06
程智强)

