花生过敏原初步分离纯化及紫外光谱分析
段筱筠,张爱琳,2,苗 颖,2,陈丹香,李志文,2*
(1天津农学院食品科学与生物工程学院;2天津市农副产品深加工技术工程中心,天津 300384)
花生过敏原初步分离纯化及紫外光谱分析
段筱筠1,张爱琳1,2,苗 颖1,2,陈丹香1,李志文1,2*
(1天津农学院食品科学与生物工程学院;2天津市农副产品深加工技术工程中心,天津 300384)
以新鲜花生仁为原料,采用丙酮和乙醚交替脱脂,PBS浸提、硫酸铵分级沉淀,再经过透析袋处理小分子蛋白和盐离子,获得的蛋白通过葡聚糖凝胶Sephadex G-100凝胶柱分离纯化,得到花生中的主要过敏原蛋白。结果表明:该花生过敏蛋白的得率为13.5%;SDS-PAGE电泳测得花生过敏蛋白的分子量大约为15 kD和60 kD;紫外分光光度检测显示在210 nm处有最大吸收峰,且峰型单一,结合光学特征分析表明花生过敏原蛋白结构中含有双键或三键结构。
花生;过敏原;分离;纯化,紫外扫描
花生具有滋养补益、延年益寿的功效,其作为一味中药,在治疗营养不良、脾胃失调、咳嗽痰喘、乳汁缺少等症状上有明显的作用。花生的种子蛋白含量占其种子干重的23%—33%[1],但这些蛋白中含有很多致敏蛋白,会引起由IgE介导的过敏反应,并导致机体生理功能紊乱或组织损伤。目前,从花生中已经分离出11种花生过敏原,按照国际过敏原统一命名标准分别为 Ara h1、Ara h2、Ara h3、Ara h4、Ara h5、Ara h6、Ara h7、Ara h8、Ara h9、Ara h10和Ara h11[2]。Ara hl占花生蛋白总量的12%—16%,它是分子量为63.5 kD的糖蛋白[3],等电点为4.55[4]。食品过敏原检测与评价是食品安全的一个重要方面[5],目前还没有针对花生过敏的特效疗法,坚果过敏患者严格避免食入含坚果的食物是最佳选择,因此坚果检测就显得尤为重要。理论上,坚果中任何一种蛋白都有可能是过敏原,目前普遍认为主要过敏原是糖蛋白。作为一种常见的过敏原食物,花生引起的过敏占食物过敏的1%—20%[6]。由此可见,花生所引起的过敏严重影响了部分人群的生活质量。此外,中国协和医科大学变态反应科对就诊人群的调查表明,北京地区约有4%的食物过敏患者对花生过敏[7]。花生致敏蛋白依旧是当今以及未来食品、医学、变态反应学研究的重要内容。本试验对花生中的蛋白质进行分离纯化,测定其蛋白质含量,以期为临床花生过敏性疾病的特异性诊断进一步开展分子生物学研究奠定基础,也为低致敏原或无过敏原花生的研制及花生过敏症的防治提供理论依据。
1 材料与方法
1.1 试验材料
试验所用花生购于天津市西青区红旗农贸农产品批发市场。
试剂及仪器设备为:考马斯亮蓝G-250,上海蓝季科技发展有限公司;牛血清白蛋白、85%磷酸(分析纯),天津市北方天医化学试剂厂;Sephadex G-100、β-巯基乙醇(分析纯),天津市双船化学试剂厂;聚乙二醇20000(分析纯),天津市江天化工技术有限公司;CBS-B程控多功能全自动部分收集器,上海沪西分析仪器厂有限公司;BT-100N数显恒流泵,上海沪西分析仪器厂有限公司;LGR20-W高速冷冻离心机,北京京立离心机有限公司;S21-2磁力搅拌器,上海司乐仪器有限公司。
1.2 试验方法
1.2.1 花生粉末的制备
称取适量的花生,彻底除去红衣外皮后,放入高速组织捣碎机中研磨成粉末(粉末应达到40目筛要求),称取170 g粉末,转移到大烧杯中。
1.2.2 花生脱脂
将上述花生粉末与丙酮按1∶3(W/V)混合,用磁力搅拌器在4℃条件下脱脂2 h,然后静置1 h,去除上清液;所得沉淀与丙酮按1∶2.5(W/V)混合,用磁力搅拌器在4℃条件下脱脂1 h,然后静置1 h,去除上清液;所得沉淀与无水乙醚按1∶1.5(W/V)混合,用磁力搅拌器在4℃条件下脱脂1 h,然后静置1 h,去除上清液;所得沉淀与丙酮按1∶0.5(W/V)混合,用磁力搅拌器在4℃条件下脱脂0.5 h,然后静置0.5 h,去除上清液;所得沉淀在通风橱中静置过夜,使有机溶剂充分挥发干净。
1.2.3 花生浸提
(1)将上述脱脂花生粉和预冷的含有0.05%EDTA·2Na和0.01 mol/Lβ-巯基乙醇的0.01 mol/L PBS(pH 7.4)的混合溶液按照1∶3(W/V)混合,在4℃条件下用磁力搅拌器缓慢搅拌过夜。(2)浸提液在4℃、13 000 g条件下离心20 min,分别合并上清液和沉淀。(3)将上述沉淀用PBS溶解后,继续用PBS抽提4 h。(4)将浸提液在4℃、13 000 g条件下离心20 min,合并于(2)中的上清液。
1.2.4 硫酸铵分级沉淀
(1)向花生去脂提取液中加入67 g硫酸铵粉末,使硫酸铵的质量分数达到25%,边搅拌边缓慢加入,使硫酸铵彻底溶解,在0℃下放置4 h;然后在11 000 g、4℃条件下离心30 min,得沉淀1,收集全部上清液,即25%原液。在所得上清液中加入73 g硫酸铵粉末,使得硫酸铵的质量分数达到50%,边搅拌边缓慢加入,使硫酸铵彻底溶解,在0℃下放置4 h;接着在11 000 g、4℃条件下离心30 min,得沉淀2,收集全部上清液,即50%原液。在所得上清液中加入79.5 g硫酸铵粉末,使得硫酸铵的质量分数达到75%,边搅拌边缓慢加入,使硫酸铵彻底溶解,在0℃下放置4 h;最后在11 000 g、4℃条件下离心30 min,得沉淀3,收集全部上清液,即75%原液。(2)将上述得到的3种沉淀分别装入事先处理过的8 000—14 000 kD分子量透析孔的透析袋中,用透析夹封口,放入蒸馏水中进行透析,期间多次更换透析液,直到用1%氯化钡溶液在透析液中检测,不产生絮状沉淀为止。
1.2.5 聚乙二醇浓缩
在透析得到的目标蛋白液表面于4℃下覆盖一层薄薄的聚乙二醇(PEG,Mr20 000),待透析袋表面的聚乙二醇因吸水变湿后轻轻抹去聚乙二醇,按照上述过程对3个梯度的沉淀分别进行浓缩,浓缩至25%硫酸铵分级沉淀最终收集11.5 mL,50%硫酸铵分级沉淀最终收集10.5 mL,75%硫酸铵分级沉淀最终收集10 mL。
1.2.6 凝胶柱纯化
用凝胶柱Sephadex G-100进行分离纯化。操作参数为:上样前用PBS溶液先洗脱平衡2个柱体积,再上样,上样体积为1 mL,上样流速为1 mL/min,共洗脱2个柱体积,利用自动分布收集器自动收集。每种沉淀收集20个离心管,每管5 mL。
1.2.7 考马斯亮蓝法测定蛋白含量[8]
1.2.7.1 牛血清标准品蛋白含量的测定
取6支干净的试管,按表1的要求分别加入所需试剂,摇匀,暗处静置5 min后,立即在595 nm条件下用可见分光光计测其吸光度,绘制标准曲线,用蒸馏水调零。

表1 牛血清标准品蛋白含量测定所需试剂Table 1 Reagent needed for determ ination of protein content in standard bovine serum
2.1.7.2 样品蛋白含量的测定
凝胶柱层析之前,用蒸馏水调零,在干净管中分别加入1 mL稀释10倍的样品和5 mL考马斯亮蓝溶液,摇匀,暗处静置5 min后,立即在595 nm条件下用可见分光光度计测其吸光度。
凝胶柱层析之后,用PBS调零,在干净管中分别加入1 mL样品和5 mL考马斯亮蓝溶液,摇匀,暗处静置5 min后,立即在595 nm条件下用可见分光光度计测其吸光度。
1.2.8 紫外分光光度计检测花生过敏蛋白
选取经考马斯亮蓝测得蛋白含量较高的样品,用PBS稀释10倍之后,以PBS调零,于紫外分光光度计上测其波峰,确定花生过敏蛋白质种类。
1.2.9 SDS-PAGE凝胶电泳检测花生中蛋白质分子量的分布[9]
①准备标品及样品;②制备分离胶和浓缩胶;③上样;④电泳;⑤染色;⑥脱色;⑦凝胶成像。
2 结果与分析
2.1 蛋白质的标准曲线
以牛血清中蛋白质含量为横坐标、OD595值为纵坐标绘制牛血清中蛋白质的标准曲线。由图1可见,牛血清蛋白质含量的标准曲线方程为y=0.0064x+0.0411,R2=0.9852,线性相关。根据此标准曲线,可以计算出待测蛋白的含量。
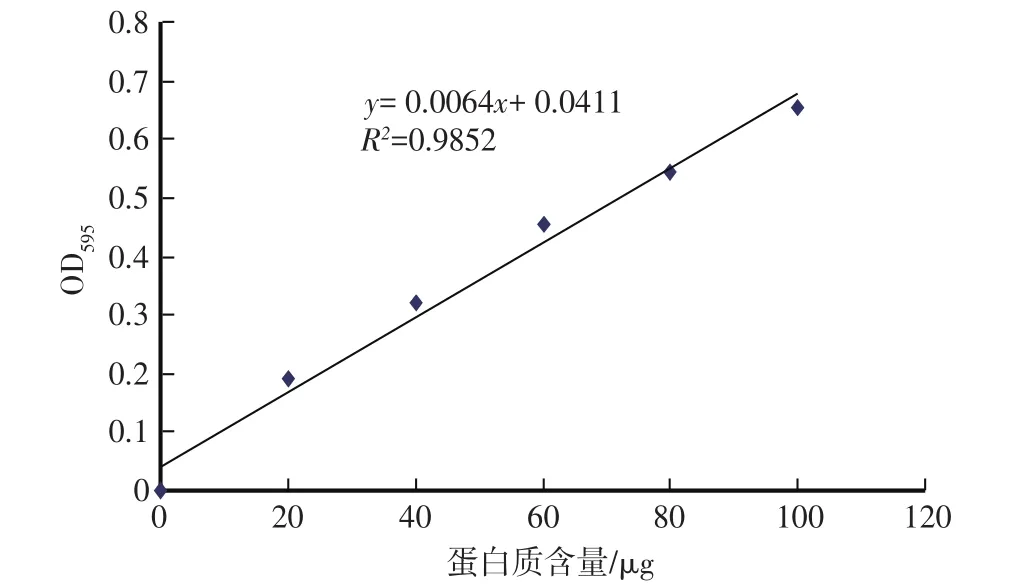
图1 蛋白质标准曲线图Fig.1 Standard curve of protein
2.2 硫酸铵盐析后的蛋白质含量
通过硫酸铵盐析可使溶液中蛋白质含量减少,随着硫酸铵浓度的增加,蛋白质含量显著下降,即不同浓度的硫酸铵可以分离不同分子量的蛋白质,具有明显的分离效果。结合牛血清蛋白的标准曲线可以计算出25%硫酸铵分级沉淀中的蛋白质含量为16.491 mg,50%硫酸铵分级沉淀中的蛋白质含量为15.057 mg,75%硫酸铵分级沉淀中的蛋白质含量为14.26 mg。根据盐溶盐析规则,25%硫酸铵饱和溶解的花生蛋白在经过盐溶盐析处理过程后,计算出花生中蛋白质的最终得率为13.5%。
2.3 凝胶柱纯化之后的蛋白质含量
由图2a可以看出:2号管蛋白质含量比较多;由图2b可以看出:4号管蛋白质含量比较多;由图2c可以看出:3、4号管蛋白质含量比较多;可以进一步测定其波峰,确定蛋白质种类。同时可以看出,所分离出来的蛋白质含量峰值出现在2—5号管;由凝胶分离的特性可知,所分离的蛋白质分子量较大。

图2 不同浓度硫酸铵分级沉淀蛋白含量Fig.2 Fractionated precipitation protein content of ammonium sulfate with different concentrations
2.4 紫外分光光度计测定结果
2.4.1 凝胶柱纯化之前
由图3可知,25%、50%原液的峰谱图峰值较多,即所含有的蛋白质种类较复杂;75%原液的峰谱图峰值较少,即所含有的蛋白质种类较简单。其中25%原液在399 nm处有最大吸收峰2.7215;50%原液在431 nm处有最大吸收峰2.2445;75%原液在358 nm处有最大吸收峰1.4447;表明利用不同饱和浓度的硫酸铵可以获得花生蛋白质的不同组分。
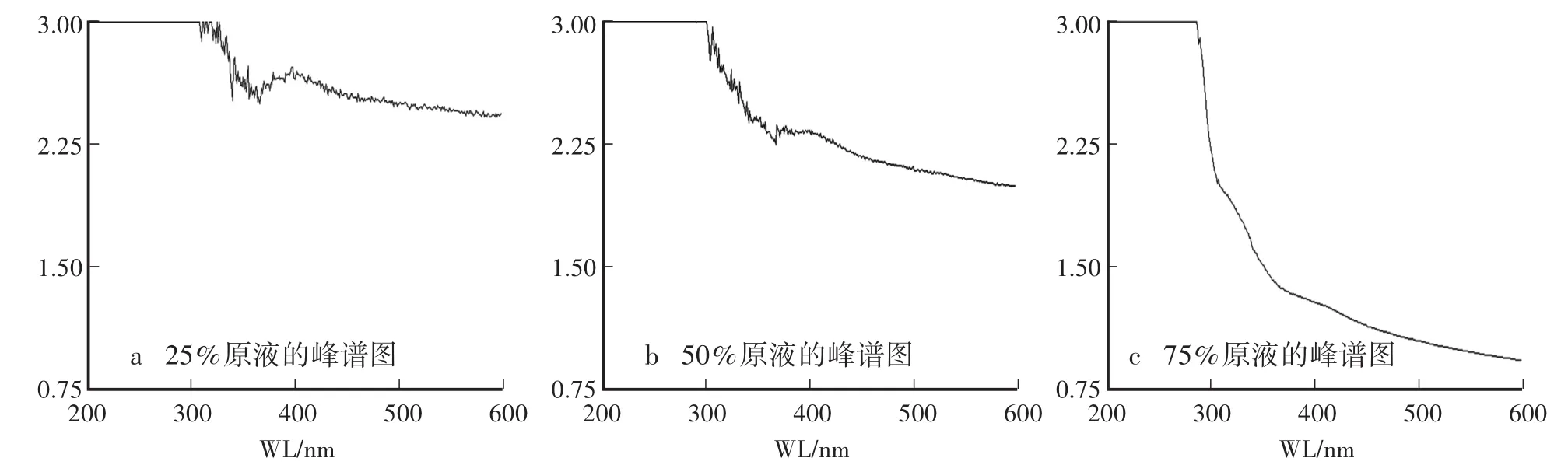
图3 凝胶层析前蛋白峰谱Fig.3 Protein peak spectra before gel chromatography
2.4.2 凝胶分离纯化之后
由图4可知,花生过敏蛋白在210 nm附近有最大吸收峰。可以判定,所测物质的结构中含有双键或三键,符合蛋白质的结构。蛋白质波峰单一且较明显,提示经凝胶柱层析后,花生过敏蛋白质得以纯化。

图4 蛋白纯化峰谱Fig.4 Peak spectra of protein purification
2.4.3 花生过敏原SDS-PAGE鉴定分析
由图5可知,经SDS-PAGE鉴定,4号管的蛋白主要有2条带,其中一条分子质量为43—66 kD,与Ara h1蛋白分子量相符;另一条为14—20 kD,与Ara h2蛋白分子量相符。另外,也有少量的杂蛋白条带。
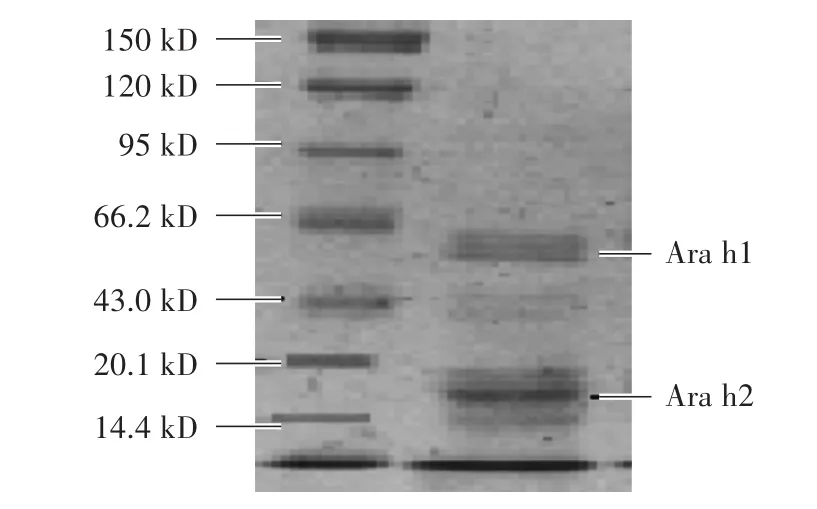
图5 75%硫酸铵分级纯化后4号管的SDS-PAGE电泳图Fig.5 SDS-PAGE electrophoresismap of No.4 tube after classification and purification of 75%ammonium sulfate
3 结论
本试验以市售花生仁为材料,经去脂、浸提、硫酸铵分级沉淀及透析等方法获得不同分子量的蛋白质,结果表明蛋白质得率为13.5%;通过凝胶柱的分离纯化获得花生的主要蛋白质,并对其进行紫外光谱检测,结合电泳方法确定花生中的主要过敏原蛋白质是Ara h1和Ara h2。在210 nm处有最大吸收峰,且峰型单一,光学特征表明花生过敏原蛋白结构中含有双键或三键结构。
[1]廖斌,卢春斌,王蕾,等.花生种子发育和萌发过程中贮藏蛋白的合成和降解[J].植物生理与分子生物学学报,2004,30(1):115-118.
[2]FINKELMAN F D.Peanut allergy and anaphylaxis[J].Current Opinion in Immunology,2010,22:783-788.
[3]PARK CW,KIM G,LEE C.A comparison study on allergen components between Korean(Arachis fasgigiata Shinpung)and American peanut(Arachis hypogaea Runner)[J].Korean Med Sci,2000,15(4):387-392.
[4]BURKSAW.Identification of amajor peanut allergen,Ara hI,in patientswith atopic dermatitis and positive peanut challenges[J].Allergy Clin Immunol,1991,88(2):172-177.
[5]黄钦田,马建吟,陈丙莺.油菜花粉变应原的分离纯化及变应原性实验研究[J].免疫学杂志,1995,11(1):20-22.
[6]EMMETT SE,ANGUSF J,FRY JS,etal.Perceived prevalence of peanutallergy in Great Britain and its association with other atopic conditions and with peanut allergy in other household members[J].Allergy,1999,54(4):380-385.
[7]李宏.花生变应原研究[D].北京:中国协和医科大学,2000.
[8]李娟,张耀庭,曾伟,等.应用考马斯亮蓝法测定总蛋白质含量[J].中国生物制品学,2000,13(2):118-120.
[9]卢婷.毛蚶酶解液及营养评价[D].郑州:郑州大学,2013.
Prelim inary separation and purification and ultraviolet spectrum analysis of peanut allergens
DUAN Xiao-yun1,ZHANG Ai-lin1,2,MIAO Ying1,2,CHEN Dan-xiang1,LIZhi-wen1,2*
(1College of Food Science and Biotechnology,Tianjin Agricultural University;2Tianjin Engineering and Technology Center of Agricultural Products Processing,Tianjin300384,China)
Taking fresh peanuts as raw material,through alternately degreasing with acetone and ether,PBS extraction,fractionated precipitation with ammonium sulfate,treating small molecule protein and salt ions by dialysis bag,separation and purification by Sephadex G-100 gel column,the main allergens in peanuts were obtained.The results showed that the yield of peanut allergens was 13.5%;the molecular weight of peanut allergensmeasured by SDS-PAGE electrophoresiswas about15 kD and 60 kD.UV spectrophotometry showed that there was amaximum absorption peak at 210 nm,and the peak type was single.Combined with optical feature analysis,there were double or triple bond structure in peanut allergen protein.
Peanut;Allergen;Separation;Purification;UV scan
2016-04-14
天津市优秀博士后国际化培养计划(2015018);2015年大学生国家创新项目(201510061088)
段筱筠(1996—),女,本科,主要从事食品安全检测技术研究。E-mail:1569667215@qq.com
*通信作者:李志文(1981—),女,博士,副教授,研究方向:食品科学
R392.8
A
1000-3924(2017)06-091-05
闫其涛)

