食品源鱼皮明胶抗冻多肽的酶解工艺
洪燕婷,汪少芸,黄茂坤,薛雅茹,林志杰
食品源鱼皮明胶抗冻多肽的酶解工艺
洪燕婷1,汪少芸2,黄茂坤1,薛雅茹1,林志杰1
以食品源鱼皮明胶为原料,采用水浴酶解法制备天然抗冻多肽,以水解制备的多肽对过氧化氢酶的低温保护活性为指标,获得最适蛋白酶并优化酶解工艺条件.结果表明,酶解食品源鱼皮明胶制备天然抗冻多肽效果最优的为酸性蛋白酶,正交实验获得可控制备最优条件为酶解温度35℃,酶解时间0.5h,酶解pH3.5,底物比1∶40,此条件制备的抗冻多肽对过氧化氢酶的低温保护活性最佳.
抗冻多肽;鱼皮明胶;酶解工艺
抗冻蛋白是一类在结冰或亚结冰条件下,可以抑制冰晶生长,能保护生物有机体免受冰冻伤害,并以非依数性形式降低水溶液的冰点,但对熔点影响甚微,从而导致水溶液的熔点和冰点之间出现差值并具有提高生物抗冻能力的蛋白质类化合物的总称[1].科学家最早从极地鱼类中发现抗冻蛋白,而后在真菌、细菌、昆虫、蜘蛛和植物等中也发现多种抗冻蛋白,发展至今也可以通过低温选育、低温或脱落酸诱导、基因工程等手段获得[2,3].但大部分来源于极地严寒地区的生物物种数量十分有限,而通过基因工程获得抗冻蛋白质的技术仍然处于发展阶段,且其安全性有待验证,这些因素很大程度上限制了抗冻蛋白质在食品工业的应用.目前已有学者以食品源的食用明胶为原料进行酶解获得抑制冰晶生长的食品源抗冻多肽,克服从天然生物体中纯化抗冻蛋白数量的局限性以及国际FDA组织对转基因抗冻蛋白在食品应用中的安全性顾虑[4-5].
如何克服天然抗冻蛋白数量的局限性和转基因抗冻蛋白的安全性顾虑是目前抗冻蛋白研究遇到的棘手问题,也是抗冻蛋白在实际应用中必须解决的难题.而抗冻多肽具有抑制冰晶生长和重结晶的特点、与抗冻蛋白一样的抗冻效果及相似的抗冻机理[6],完全可以作为抗冻蛋白的升级版,其来源更加广泛且易得,生产成本相对低廉,投入工业化生产及广泛应用的可能性非常大.
本文选用食品源鱼皮明胶作为原料,采用酶解方式制备抗冻多肽,寻找抗冻效果最优蛋白酶,并探究酶解工艺的最佳条件.
1 材料和仪器
1.1 材料
食品级鱼皮明胶,青海明胶股份有限公司;中性蛋白酶、木瓜蛋白酶、酸性蛋白酶、碱性蛋白酶、复合蛋白酶,食品级,江苏锐阳生物科技有限公司;过氧化氢酶,生化级,SIGMA-ALDOICH,其他试剂均为优级纯或分析纯.
1.2 主要仪器
FD-1C-80真空冷冻干燥机,北京博医康实验仪器有限公司;HHS电热恒温水浴锅,上海博讯实业有限公司医疗设备厂;AL104-IC型电子天平,梅特勒-托利多仪器(上海)有限公司;TG16-WS型台式高速离心机,湖南湘仪实验仪器制造有限公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;FE20酸度计,丹佛仪器(北京)有限公司;JCW-F080冰箱,广绅商用电器有限公司;ISO8655移液枪,大龙兴创实验仪器(北京)有限公司;HJ—4D磁力恒温水浴锅,金坛市良友仪器有限公司.
2 试验方法
2.1 抗冻活性检验方法
研究表明,抗冻蛋白对于酶具有低温保护作用,通过测定酶在冻融前后的酶活力可检测抗冻蛋白的抗冻活性[7].参考李晓坤等[8]的方法并作适当修改,用pH 7.0,0.05 M KH2PO4-NaOH缓冲液适当稀释过氧化氢酶液,将等量的过氧化氢酶稀释液和8×10-3g/mL待测多肽溶液混匀,分别测定过氧化氢酶初始酶活力.后放入-20℃冰箱冷冻24h,取出25℃解冻,再放入-20℃冷冻3h,反复冻融3次后测过氧化氢酶酶活力.用过氧化氢酶残余活力,即冻融后过氧化氢酶活力和冻融前酶活力比值表示抗冻活性,酶残余活力越大,所测样品抗冻活性越强.
具体测定方法如下:往石英比色皿内准确加入蒸馏水1.9mL、加入待测酶液0.1mL和过氧化氢稀释液1mL,盖上比色皿盖子,马上摇匀,测定240nm初始吸光值,每隔1min记录吸光值,计时5min.实验结果计算:以1min内A240减少0.1酶量为1个酶活单位(μ).

用过氧化氢酶残余活力来表示抗冻活性大小.

2.2 酶解工艺的研究方法
2.2.1 五种不同蛋白酶对多肽抗冻活性的影响
研究选取五种蛋白酶:酸性蛋白酶、中性蛋白酶、碱性蛋白酶、复合蛋白酶、木瓜蛋白酶,据资料[9]知:酸性蛋白酶的最适pH为3,温度为40℃;中性蛋白酶的最适pH为7,温度为50℃;碱性蛋白酶的最适pH为8,温度为40℃;复合蛋白酶的最适pH为7,温度为40℃;木瓜蛋白酶的最适pH为7,温度为50℃.各称取5g明胶,加20mL蒸馏水,磁力恒温水浴搅拌锅预热溶解,达到预设温度后,酶和底物比例1∶30加入蛋白酶,以酶最适pH和温度酶解,过程中用1mol/L盐酸溶液或者1mol/L的氢氧化钠溶液调节pH以维持酶最优pH,酶解时间1h,后用沸水浴10min灭酶,收集酶解液,11600r/min离心10min,取上清液,-20℃预冷冻1d后,真空冷冻干燥2d,获得抗冻多肽的固体粉末,装入密封袋备用,检测抗冻活性,操作如2.1所述.
另设计不同酶解时间进一步验证结果,酶解时间分别为:0.5h、1h、2h、3h、4h,酶解操作和抗冻活性检测同上述.
2.2.2 酶解工艺条件
每个样品称取5g鱼皮明胶放入烧杯,加20mL蒸馏水,在磁力恒温水浴锅中预热溶解,达到预设温度后,加入筛选出的最适蛋白酶,反应需在搅拌条件下进行保证底物与酶充分接触,在酶解过程中用1mol/L HCl溶液进行pH调节,使酶解pH保持在预设数值.探讨酶解温度、酶解时间、酶解pH、酶和底物比例对抗冻多肽活性的影响,具体酶解条件设置如下:
(1)酶解温度单因素试验.固定酶解pH为3,时间为1h,底物比为1∶30,酶解温度分别为30℃、35℃、40℃、45℃、50℃.
(2)酶解时间单因素试验.固定酶解pH为3,温度为40℃,底物比为1∶30,酶解时间分别为0.5h、1h、2h、3h、4h.
(3)酶解pH单因素试验.固定酶解时间为1h,温度为40℃,底物比为1∶30,酶解pH分别为2.5、3、3.5、4、4.5.
(4)酶和底物比例单因素试验.固定酶解时间为1h,温度为40℃,pH为3,酶和底物比例分别设置为1∶10、1∶30、1∶50、1∶70、1∶90.
(5)酶解工艺条件的优化.在单因素实验基础上,选择各因素最优条件为基准,采用正交进行优化,其余酶解操作同2.2.1,抗冻活性检测同2.1.
3 结果与讨论
3.1 酶解蛋白酶的筛选
本文选用五种蛋白酶:酸性蛋白酶、复合蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶酶解食品源鱼皮明胶制备天然抗冻多肽,将制备的抗冻多肽添加进入过氧化氢酶中进行低温保护实验,-20℃冰箱冷冻24h后再反复冻融3次测定过氧化氢酶残余活力,过氧化氢酶残余活力越大表示样品的抗冻活性越强,抗冻效果如图1.
在控制各类蛋白酶的酶解温度、酶解pH、酶解时间、酶和底物比例等酶解条件下,酸性蛋白酶制备的天然抗冻多肽抗冻效果最佳,过氧化氢酶酶残余活力为80.7%,碱性蛋白酶次之,复合蛋白酶效果最差.原因在于不同蛋白酶酶解位点不同,酶解产物不同,抗冻效果也就不一样,即便是同一种蛋白酶在不同的酶解时间下的作用效果也不同.

图1 五种蛋白酶制备抗冻多肽的活性比较
将五种在不同酶解时间0.5h、1h、2h、3h、4h制备的天然抗冻多肽的抗冻活性如图2所示.由图2看出,酸性蛋白酶酶解产物的活性普遍比其他四种酶的保护活性高,其中酶解效果最好的是酸性蛋白酶在酶解时间1h时,过氧化氢酶酶残余活力达到80.7%.原因可能是蛋白酶的酶切位点差异所引起的,鱼皮明胶蛋白经过酸性蛋白酶酶切后获得了更多具有抗冻活性的多肽片段.另外抗冻活性表现次之的碱性蛋白酶在酶解0.5h和1h过氧化氢酶残余酶活力基本在同一个水平上,酶解时间1h后抗冻效果随酶解时间增长而减弱,原因可能在于碱性蛋白酶将形成的抗冻多肽切割成更小片段而不具有活性.中性蛋白酶的最佳酶解时间为1h,超过1h抗冻效果开始减弱.木瓜蛋白酶制备的天然抗冻多肽抗冻效果与酶解时间之间关系相对较弱,可能是因为木瓜蛋白酶酶切位点暴露的基团整体不太利于发挥抗冻活性.
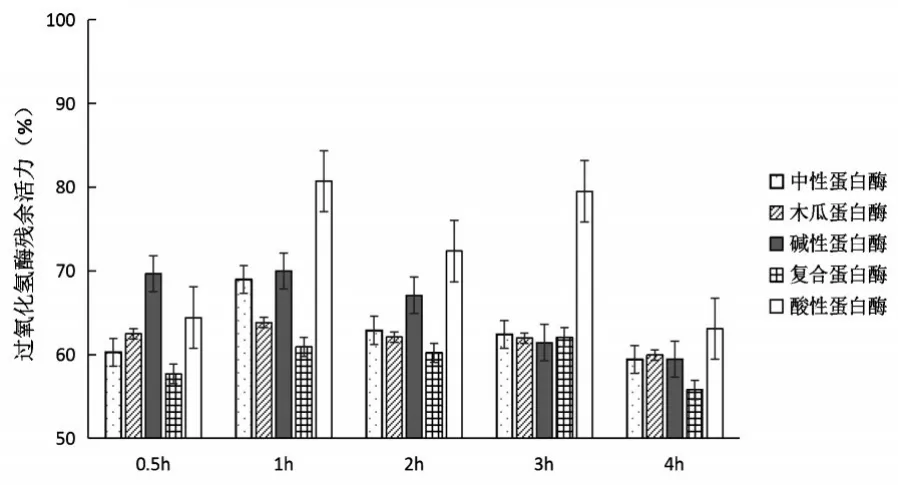
图2 五种蛋白酶不同酶解时间制备的抗冻多肽的抗冻活性
3.2 酶解条件的影响
3.2.1 酶解温度的影响
酶解温度对制备的天然抗冻多肽的抗冻效果影响如图3所示.抗冻活性在酶解温度30~40℃随酶解温度上升而增强,但当酶解温度超过40℃之后,抗冻活性反而呈下降的趋势,在40℃达到最高值,此时过氧化氢酶残余活力为80.7%.分析原因可能在于,酶解温度40℃时,酶解产生的具有抗冻活性的片段最多,而当酶解温度较低时会抑制酶的活性使酶解反应没办法充分进行,超过此范围随着温度的升高,酶的活性降低甚至死亡.这也说明抗冻效果的强弱关键在于酶解获得的具有抗冻活性的多肽片段的多少,而与使用酶的活性大小并不存在必然的正相关关系.
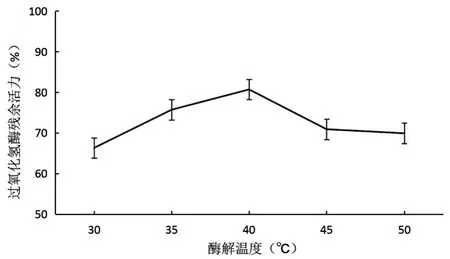
图3 酶解温度对鱼皮明胶酶解物的抗冻活性的影响
3.2.2 酶解时间的影响
酶解温度对制备的天然抗冻多肽的抗冻效果影响如图4.在测定范围内,抗冻活性随着酶解时间的增长先升高后下降再升高,在酶解时间1h,过氧化氢酶残余活力最高为80.7%.抗冻多肽的抗冻活性强弱取决于有效抗冻活性片段的多少,酶解时间1h时最高,此后随酶解时间延长,具有抗冻活性的片段可能又被酶解成没有活性的片段,因此制备的抗冻多肽抗冻效果减弱.
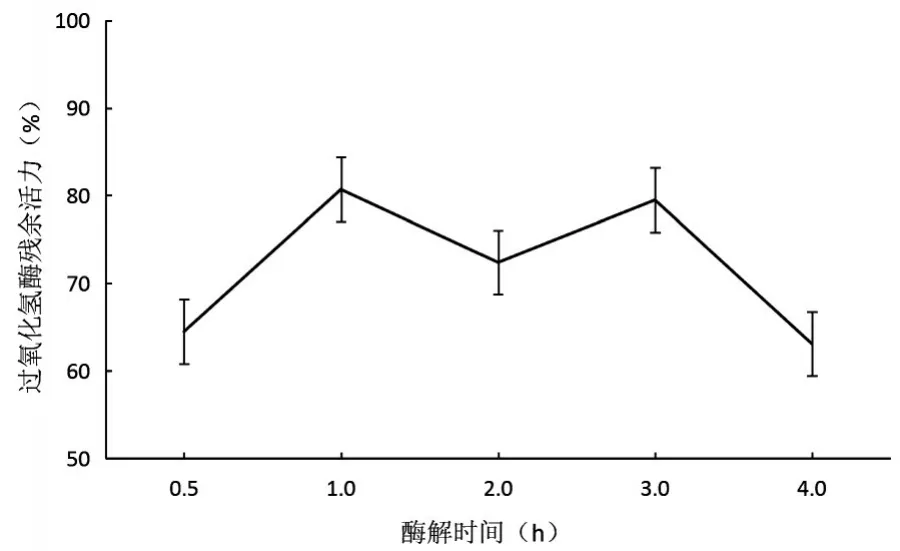
图4 酶解时间对鱼皮明胶酶解物的抗冻活性的影响
3.2.3 酶解pH的影响
酶解pH对制备天然抗冻多肽的抗冻效果影响如图5.随着酶解pH值的增大,抗冻活性先增大后减小,在酶解pH为3.0时,制备的天然抗冻多肽抗冻效果达到最佳,过氧化氢酶残余酶活力为80.7%,原因在于在过酸或过碱的环境中可能抑制酶的活性,甚至可能致使酶死亡和活性丧失.此外与鱼皮明胶等电点有关,据厂家信息提供所用鱼皮明胶等电点在pH为4.5~6.5间,处于非等电点的鱼皮明胶具有更好的溶解度,可与蛋白酶进行更充分的接触,可供酶切割位点的选择更多,进而可能获得更多的抗冻多肽.

图5 酶解pH值对鱼皮明胶酶解物的抗冻活性的影响
3.2.4 酶和底物比例的影响
酶和底物比例对制备天然抗冻多肽的抗冻效果影响如图6.在实验范围内,制备的天然抗冻多肽的抗冻效果随着酶的添加量减少而减弱,在酶解底物比为1∶10效果最好,为82.9%.酶和底物比例在1∶30时,过氧化氢酶残余活力为80.7%,与1∶10的抗冻效果相差不多,但相比加酶量少很多,考虑到经济成本的问题,最终选取酶解底物比为1∶30进行后续的酶解条件优化.

图6 酶解底物比对鱼皮明胶制备抗冻多肽活性的影响
3.2.5 正交试验结果
在单因素实验基础上,采用四因素三水平正交试验优化酶解工艺条件,并采用测定过氧化氢酶残余活力来表示抗冻效果作为条件筛选指标.具体的因素水平表如表1所示.

表1 正交实验因素水平表
正交优化结果如表2所示.结果显示,酶解时间对制备的天然抗冻多肽的抗冻效果影响最大,酶解pH次之,再者是酶和底物比例,最后是酶解pH.酸性蛋白酶制备鱼皮明胶抗冻多肽的最优酶解工艺条件为A1B1C3D3组合,即酶解温度35℃,酶解时间0.5h,酶解pH为3.5,底物比1∶40.在实际生产中,考虑到酶成本较高,可以适当调整酶和底物比例,降低酶的使用量,减少成本,也可以根据实际情况,适当调整其他工艺条件以获得最高经济效益.

表2 正交实验及实验结果
4 结论
以食品源鱼皮明胶制备天然抗冻多肽,采用过氧化氢酶残余活力测定抗冻活性,从复合蛋白酶、酸性蛋白酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶中筛选出酸性蛋白酶效果最佳.以酸性蛋白酶酶解食品源鱼皮明胶制备天然抗冻多肽,单因素试验中,酶解时间最佳为1h,酶解温度最佳为40℃,酶和底物比例最佳为1∶30,酶解pH值最佳为3;正交优化结果最优酶解工艺条件:酶解温度35℃,酶解时间0.5h,酶解pH为3.5,底物比1∶40.项目制备的抗冻多肽来源于食品源的鱼皮明胶,天然安全且具有良好的抗冻效果,同时提升了鱼皮下脚料的利用价值,具有显著的商品开发价值.
TS213.2
A
1008-7974(2018)01-0060-05
10.13877/j.cnki.cn22-1284.2018.02.016
2017-10-17
福建省中青年教师教育科研项目(JAT160839).
1.洪燕婷,女,福建南安人,黎明职业大学材料与化学工程学院教师;黄茂坤,薛雅茹,林志杰,黎明职业大学材料与化学工程学院(福建 泉州 362000).2.汪少芸,福州大学生物科学与工程学院.
[1]汪少芸,赵珺,吴金鸿,等.抗冻蛋白的研究进展及其在食品工业中的应用[J].北京工商大学学报,2010,38(15):7888-7890.
[2]X Ding,H Zhang,H Chen,et al.Extraction,puridication and identification of antifreeze proteins from cold acclimated malting barly (Hordeum vulgare L.)[J].Food Chemistry,2015,175:74-81.
[3]LL Olijve,K Meister,AL Devries,et al.Blocking rapid ice crystal growth through nonbasal plane adsorption of antifreeze proteins[J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(14):3740.
[4]Shaoyun Wang,Srinivasan Damodaran.Optimisation of hydrolysis conditions and fractionation of peptide cryoprotectants from gelatin hydrolysate[J].Food Chemistry,2009,11:620-630.
[5]X Chen,JH Wu,L Li,et al.The cryoprotective effects of antifreeze peptides from pigskin collagen on texture properties and water molibity of frozen dough subjected to freeze-thaw cycles[J].European Food Research&Tcchnology,2016:1-8.
[6]洪晶,汪少芸,吴金鸿,等.食品源抗冻多肽的制备及冰晶一直作用研究[J].中国食品学报,2013,13(1):11-18.
[7]Yujie Cai,Shang Liu,Xiangru Liao,et al.Purificationand partial characterization of antifreeze proteins from leavesof Ligustrum lucidum Ait[J].Food and bioproducts processing,2010,151:1-5.
[8]李晓坤,洪燕婷,王文龙,等.猪皮明胶抗冻多肽的制备及其低温保护活性研究[J].福州大学学报,2013,41(6):1131-1136.
[9]赵珺,汪少芸,李晓坤.天然抗冻多肽的制备、分离及细菌低温保护活性分离[J].福州大学学报,2013,41(1):121-126.
[10]汪少芸,赵丽娜,周焱富,等.食品性明胶多肽的制备、分离及其抗冻活性[J].食品科学,2013,34(9):135-139.
王海波)

