MSI、HGF与大肠癌患者预后关系的初步研究
付英,周皓岚,朱秀娟
(四川省巴中市中医医院 病理科,四川 巴中 636000)
MSI、HGF与大肠癌患者预后关系的初步研究
付英,周皓岚,朱秀娟
(四川省巴中市中医医院 病理科,四川 巴中 636000)
目的探讨微卫星不稳定性(MSI)和肝细胞生长因子(HGF)对大肠癌患者预后的影响。方法选取2011年4月-2014年7月四川省巴中市中医医院收治的大肠癌患者80例,记录MSI患者和HGF阳性患者的生存率,对患者的临床资料进行单因素和COX回归分析。结果MSI患者14例,1、3和5年生存率分别为92.86%、85.71%和71.43%;非MSI患者14例,1、3和5年生存率分别为92.42%、74.24%和56.06%。HGF阳性患者14例,1、3和5年生存率分别为89.47%、73.68%和54.39%;HGF阴性患者14例,1、3和5年生存率分别为100.00%、82.61%和73.91%。不同大体类型、TNM分期、分化程度、是否淋巴结转移、辅助化疗、MSI、HGF阳性和阴性患者的5年生存率比较,差异有统计学意义(P<0.05)。TNM分期Ⅲ、Ⅳ,以及淋巴结转移、HGF阳性是影响大肠癌患者生存状况的独立危险因素,辅助化疗和MSI是患者生存的保护因素(P<0.05)。结论MSI、HGF与大肠癌患者预后密切相关,其中MSI患者比非MSI患者预后佳,而HGF阳性患者预后较阴性患者差。
微卫星不稳定性;肝细胞生长因子;大肠癌;预后
大肠癌是一种常见的恶性肿瘤,包括直肠癌和结肠癌,该病的发生与慢性炎症、遗传和环境因素等密切相关[1-2]。目前,临床上尚无特异性指标用于大肠癌患者远期预后的预测,不利于诊疗的进行。因此,寻找一种能够准确评估患者预后的指标成为疾病治疗的重中之重。随着研究的不断深入,临床上对大肠癌的发病机制研究已深入到分子水平,其中公认的分子机制为基因的不稳定性。MSI是指由错配修复基因缺陷引起的DNA复制错配,从而产生微卫星不稳定性(microsatellite instability,MSI)表型。赵喜连等[3]认为,MSI与结直肠癌的临床病理特征存关系密切,参与结直肠癌的发生、发展。肝细胞生长因子(hepatocyte growth factor,HGF)是一种重要的抗纤维化因子,具有修复受损组织器官、刺激肾小管形态发生的作用,已被证实广泛参与肿瘤的发展、转移[4-5]。本研究对2011年4月-2014年7月四川省巴中市中医医院收治的80例大肠癌患者进行长达5年的随访,旨在明确MSI和HGF对患者生存状况的影响。现报道如下。
1 资料与方法
1.1 一般资料
选取2011年4月-2014年7月本院收治的大肠癌患者80例。其中,男性45例,女性35例;年龄28~75岁,平均(53.6±6.8)岁。直肠癌24例,结肠癌56例,其中高分化27例,中分化43例,低分化10例。
1.2 方法
采集入组患者的组织标本,用4%甲醛固定后常规包埋。采用免疫组织化学法测定MSI和HGF水平,肿瘤组织的细胞核呈棕黄色视为MSI,细胞膜或细胞质呈棕黄色为HGF阳性。收集入组患者的临床资料,包括年龄、性别、肿瘤部位、大体类型、TNM分期、分化程度、淋巴结转移、辅助化疗等。
1.3 统计学方法
数据分析采用SPSS 19.0统计学软件,生存分析用Kaplan-Meier法计算,Log-rank检验,计数资料以率(%)表示,用χ2检验,差异有统计学意义的相关因素进行COX回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 MSI与非MSI患者的生存状况比较
MSI患者14例,1、3和5年生存率分别为92.86%、85.71%和71.43%;非MSI患者14例,1、3和5年生存率分别为92.42%、74.24%和56.06%,差异有统计学意义(χ2=7.724,P=0.008)。见图1、2。
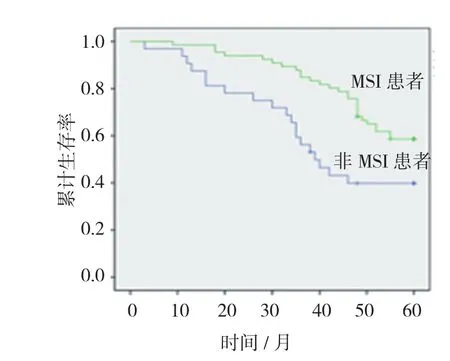
图1 MSI与非MSI患者的生存状况分析

图2 错配修复基因在大肠癌组织中的表达 (×400)
2.2 HGF阳性与阴性患者的生存状况比较
HGF阳性患者14例,1、3和5年生存率分别为89.47%、73.68%和54.39%;HGF阴性患者14例,1、3和5年生存率分别为100.00%、82.61%和73.91%,差异有统计学意义(χ2=5.628,P=0.019)。见图3、4。
2.3 影响大肠癌患者生存状况的单因素分析
不同大体类型、TNM分期、分化程度、是否淋巴结转移、辅助化疗、MSI、HGF阳性和阴性患者的5年生存率比较,差异有统计学意义(P<0.05)。见表1。
2.4 影响大肠癌患者生存状况的的COX回归分析
以是否死亡为因变量,其他指标为自变量,其中浸润癌、TNM分期Ⅲ、Ⅳ,以及低分化、淋巴结转移、辅助化疗、MSI、HGF阳性赋值为1。TNM分期Ⅲ、Ⅳ,以及淋巴结转移、HGF阳性是影响大肠癌患者生存状况的独立危险因素,辅助化疗和MSI是患者生存的保护因素(P<0.05)。见表 2。

表1 影响大肠癌患者生存状况的单因素分析
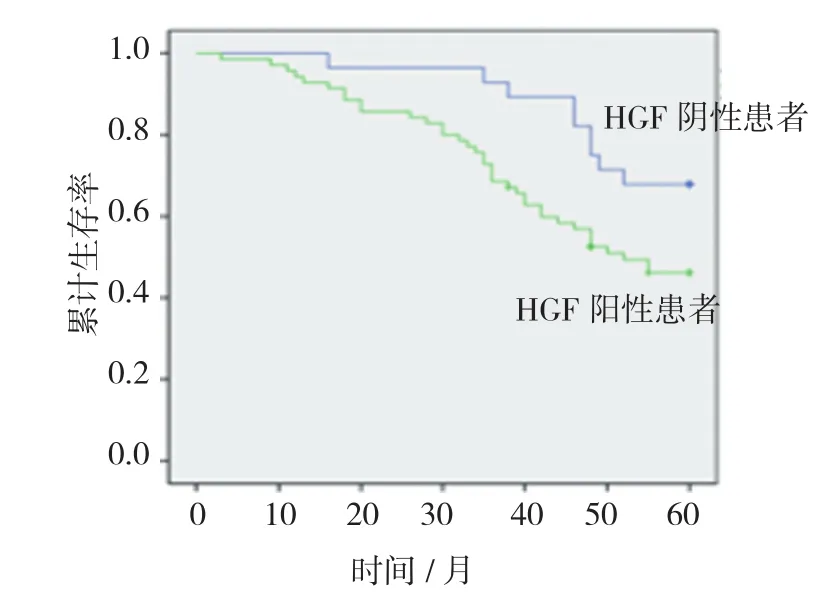
图3 HGF阳性与阴性患者的生存状况分析

图4 HGF在大肠癌组织中的表达 (×400)

表2 影响大肠癌患者生存状况的的COX回归分析
3 讨论
大肠癌是一种消化道肿瘤,具有发病率和致死率高的特点,早期大肠癌并无明显的临床症状,患者主要表现为消化不良、大便潜血等,随着病情的不断发展,患者大便习惯改变,出现腹痛、腹部包块、便血、肠梗阻等症状,部分患者伴有贫血、消瘦等临床表现[6]。大肠癌的发生、发展是由多基因参与的阶段性过程,目前国际上公认的大肠癌发生的分子机制主要包括2种,第一种是由APC、P53及KRAS参与的染色体不稳定性和抑癌基因突变,另一种是DNA错配修复功能障碍引起的MSI。HGF是一种多肽生长因子,具有促进细胞生长、迁移的作用,同时对各类肿瘤的转移均具有一定的诱导作用[7]。目前,MSI与大肠癌患者生存状况的关系仍是一个具有争议的问题,ZIADI等[8]认为MSI表型患者相对于微卫星稳定患者具有更好的预后,但仍有部分学者认为MSI意味着大肠癌患者生存状况不佳。本研究结果显示,MSI和非MSI患者的1年生存率并无差异,但MSI患者的3年、5年生存率高于非MSI患者。笔者认为,MSI癌细胞的攻击性大大降低,但在激发机体免疫反馈方面仍具有明显作用,因此MSI患者的远期生存率更高。
HGF可以由人体正常细胞生成,在生理状态下,HGF可以与受体结合,发挥促进细胞组织再生和胚胎发育的过程,但是在肿瘤组织和癌旁组织中,HGF往往呈现高表达状态。有研究证实,HGF能够通过降低癌细胞间的黏附作用促进癌细胞运动,刺激肿瘤血管形成,从而对癌细胞的转移起到正面刺激作用。本研究结果显示,HGF阳性患者的5年生存率仅为54.39%,低于HGF阴性患者(73.91%),提示HGF过度表达不利于患者预后。这是因为,人体正常细胞和肿瘤细胞都能够表达HGF受体,但是正常细胞的HGF受体表达增加后段时间内可恢复至正常水平,而肿瘤细胞则持续表达HGF受体,从而提高癌细胞能动性,促进肿瘤扩散,这可能是HGF阳性患者生存状况不佳的主要原因[9-10]。除促进癌细胞增生外,HGF还能够通过诱发新血管床来刺激血管生成,并通过自分泌刺激环增加肿瘤的恶性程度,从而影响患者预后。吴宇辰等[11]认为MSI状态对结直肠癌患者的化疗敏感性和预后具有重要意义,是影响患者无病进展时间的独立危险因素。杨光等[12]的研究结果显示,MSI患者的远期生存率低于微卫星稳定患者,是影响结直肠癌患者预后的独立危险因素。彭俊玲等[13]在研究中提到,MSI结直肠癌的转移风险较低,患者预后优于非MSI患者。申高飞等[14]则认为,MSI状态患者与微卫星稳定患者相比,表现出更好的预后。上述研究结果表明,MSI患者的临床获益率是否有所提高尚无定论。本研究的单因素和COX回归分析结果显示,HGF阳性是影响大肠癌患者生存状况的独立危险因素,而MSI是患者生存的保护因素。MSI对大肠癌患者预后的影响在不同的研究报道中存在差异,可能由样本容量和样本采集方法不同引起,同时,现有的有关MSI与大肠癌患者生存状况关系的研究未对辅助化疗进行分层比较和回归校正,可能对结果造成一定影响。本研究在纳入辅助化疗比较的情况下,发现MSI大肠癌患者的生存状况仍优于非MSI患者。此外,与以往的研究相比,本研究在单因素分析中纳入更多的临床指标,多因素分析结果更为全面、可靠。
综上所述,MSI和HGF是影响大肠癌患者生存状况的主要因素,其中MSI患者比非MSI患者预后佳,而HGF阳性患者预后较阴性患者差。值得提醒的是,本研究并未对MSI影响患者预后的确切机制进行深入探讨,猜测与患者的病理组织学表现有关,期待更严谨的实验研究,为明确MSI与HGF对大肠癌患者生存状况的影响提供科学的参考依据。
[1]单宝珍, 李胜保, 王强, 等. 大肠癌及其癌前组织中EGFR蛋白的表达及意义[J]. 中国现代医学杂志, 2014, 24(11): 63-66.
[2]YAN Z, YIN H, WANG R. et al. Overexpression of integrin-linked kinase (ILK) promotes migration and invasion of colorectal cancer cells by inducing epithelial-mesenchymal transition via NF-κB signaling[J]. Acta Histochemica: Zeitschrift fur Histologische Topochemie, 2014, 116(3): 527-533.
[3]赵喜连, 郗彦凤, 白文启, 等. 错配修复蛋白和p53蛋白表达与结直肠癌的临床病理关系及其相关性[J]. 临床与实验病理学杂志, 2016, 32(4): 370-374.
[4]孙燕来, 李增军, 徐忠法, 等. 肝细胞生长因子及其受体c-Met表达与结直肠癌同时性肝转移的相关性研究[J]. 中华胃肠外科杂志, 2014, 17(6): 598-601.
[5]阮柏, 王德盛, 刘杰, 等. HGF/Met通路对肝癌细胞株MHCC97-H干细胞样表型的影响[J]. 中华消化外科杂志,2014, 13(5): 352-357.
[6]DAMANIA D, SUBRAMANIAN H, BACKMAN V, et al. Network signatures of nuclear and cytoplasmic density alterations in a model of pre and postmetastatic colorectal cancer[J]. Journal of biomedical optics, 2014, 19(1): 1-11.
[7]YONESAKA K, SATOH T, UEDA S, et al. Circulating hepatocyte growth factor is correlated with resistance to cetuximab in metastatic colorectal cancer[J]. Anticancer Research: International Journal of Cancer Research and Treatment, 2015, 35(3): 1683-1689.
[8]ZIADI S, KSIAA F, GACEM R B, et al. Clinicopathologic characteristics of colorectal cancer with microsatellite instability[J].Pathology Research and Practice, 2014, 210(2): 98-104.
[9]聂琳, 徐玉清. 非小细胞肺癌中HGF/c-Met信号通路与EGFRTKI获得性耐药的关系[J]. 国际肿瘤学杂志, 2016, 43(9): 703-705.
[10]孙燕来, 李增军. 肝细胞生长因子及其受体c-Met表达与胃癌肝转移的相关性[J]. 实用医学杂志, 2015, 31(16): 2634-2637.
[11]吴宇辰, 张长胜, 梁斐, 等. 微卫星不稳定状态对Ⅳ期结直肠癌患者化疗反应性和预后的影响[J]. 中国癌症杂志, 2015,25(7): 522-528.
[12]杨光, 郑绘霞, 武丽娜, 等. 结直肠癌中微卫星不稳定性与肝细胞生长因子表达的关系及预后因素[J]. 中华肿瘤杂志,2016, 38(4): 283-288.
[13]彭俊玲, 汤涛, 叶祖禄, 等. 散发性结直肠癌微卫星不稳定状态与错配修复蛋白表达缺失及临床病理特征的相关性[J]. 中国肿瘤生物治疗杂志, 2015, 22(4): 479-483.
[14]申高飞, 李进晶, 汪鑫, 等. 肿瘤的分子分型在当代结直肠癌中的应用[J]. 现代生物医学进展, 2015, 15(10): 1994-1997.
In fl uences of microsatellite instability and hepatocyte growth factor on prognosis of patients with colorectal cancer
Ying Fu, Hao-lan Zhou, Xiu-juan Zhu
(Department of Pathology, Bazhong Hospital of Traditional Chinese Medicine,Bazhong, Sichuan 636000, China)
ObjectiveTo investigate the effect of microsatellite instability (MSI) and hepatocyte growth factor(HGF) on the prognosis of patients with colorectal cancer.MethodsEighty patients with colorectal cancer in our hospital from April 2011 to July 2014 were selected. The survival rates of the patients with MSI and the HGF-positive patients were recorded. The clinical data of the patients were analyzed with univariate and COX regression analyses.ResultsIn the 14 cases of MSI patients, 1-, 3- and 5-year survival rates were 92.86%, 85.71% and 71.43%respectively; in the 66 cases of the non-MSI patients, 1-, 3-, 5-year survival rates were 92.42%, 74.24% and 56.06%respectively. In the 57 cases of HGF-positive patients, 1-, 3- and 5-year survival rates were 89.47%, 73.68% and 54.39% respectively; while in the 23 cases of HGF-negative patients, 1-, 3- and 5-year survival rates were 100.00%,82.61% and 73.91% respectively. There were signi fi cant differences in the 5-year survival rates of the patients with different pathological types, TNM stages, differentiation degree, lymph node metastasis, adjuvant chemotherapy,MSI and HGF expressions (P< 0.05). TNM stage III and IV, lymph node metastasis and HGF positivity were the independent risk factors in fl uencing the survival status of the colorectal cancer patients. Adjuvant chemotherapy and MSI were the protective factors for the survival of the patients (P< 0.05).ConclusionsMSI and HGF are the main factors in fl uencing the prognosis of the patients with colorectal cancer. MSI patients have a better prognosis than non-MSI patients, whereas HGF-positive patients have a worse prognosis than HGF-negative patients.
microsatellite instability; hepatocyte growth factor; colorectal cancer; prognosis
10.3969/j.issn.1005-8982.2018.01.023
1005-8982(2018)01-0115-05
2017-03-15
R735.34
A
(张西倩 编辑)

