苯二酚内酯及其衍生物杀线虫活性研究
张荣儒, 张礼文, 张 鹏, 章跃陵, 刘 柱, 徐玉泉*
1.中国农业科学院生物技术研究所, 北京 100081; 2.汕头大学理学院, 广东 汕头 515063;3.海南大学热带农林学院, 海口 570228
苯二酚内酯及其衍生物杀线虫活性研究
张荣儒1,2,3, 张礼文1, 张 鹏1, 章跃陵2, 刘 柱3*, 徐玉泉1*
1.中国农业科学院生物技术研究所, 北京 100081; 2.汕头大学理学院, 广东 汕头 515063;3.海南大学热带农林学院, 海口 570228
采用浸渍法研究了酿酒酵母异源表达的苯二酚内酯monocillin II、10,11-dehydrocurvularin、pre-asperfuranone、trans-resorcylide、desmethyl-lasiodiplodin和lasiodiplodin的杀秀丽线虫活性。首次发现苯二酚内酯10,11-dehydrocurvularin和desmethyl-lasiodiplodin具有杀线虫活性。分别以0.1 mg/mL、0.2 mg/mL 和0.5 mg/mL的10,11-dehydrocurvularin和desmethyl-lasiodiplodin处理秀丽线虫的二龄幼虫(L2)24 h后,秀丽线虫的校正死亡率分别为7.95%、15.30%、46.41%和3.41%、8.90%、27.47%。Desmethyl-lasiodiplodin的甲基化产物lasiodiplodin的杀线虫活性降低,浓度为0.5 mg/mL时,线虫的校正死亡率为16.12%。研究结果为植物线虫病害的防治提供了新的思路。
苯二酚内酯;秀丽线虫;10,11-dehydrocurvularin;desmethyl-lasiodiplodin;杀线虫活性
植物线虫病是小麦、水稻和马铃薯等粮食作物及番茄、黄瓜和松树等经济作物的主要病害之一,全球每年因作物病原线虫造成的直接经济损失高达1 570亿美元[1]。植物线虫为专性寄生生物,在侵染植物组织后,既吸取植株营养,又分泌一些酶或毒素,使植物的组织发生病变,影响植株水分和营养的吸收与运转,甚至导致植株死亡[2]。
利用化学杀线虫剂防治线虫病害是最主要的农业措施,但大部分商业化的杀线虫剂对人畜有较高毒性,且对环境有害,如灭线磷、克百威和涕灭威等,现已经被取消或限制使用。近年来国内线虫病害呈快速上升趋势,而生产中使用的杀线虫剂品种单一,长期使用必然导致抗药性,因此需要开发新的杀线虫剂。利用微生物合成的次级代谢产物开发新的杀线虫剂,目前已成为国内外的研究热点[3]。
真菌能够合成丰富的次级代谢产物,其中由聚酮合酶(PKS)催化合成的聚酮类化合物以结构和活性多样著称[4],其中阿维菌素就有显著的杀线虫活性,目前已在生产中大量使用。苯二酚内酯(benzenediol lactones,BDLs)是聚酮化合物中重要的一类,根据其骨架结构可以分为二羟基苯甲酸内酯(resorcylic acid lactones,RALs)和二羟基苯乙酸内酯(dihydroxyphenylacetic acid lactones,DALs)[4],其结构多样且具有多种生物活性[5]。例如根赤壳菌素(radicicol)能够抑制Hsp90分子伴侣蛋白的合成,具有抗肿瘤的活性[6];玉米赤霉烯酮(zearalenone)导致秀丽线虫的体长变短、后代生殖能力降低,从而表现出杀线虫活性[7]。因此,本研究通过在酵母中异源表达10,11-dehydrocurvularin和desmethyl-lasiodiplodin等6种苯二酚内酯聚酮类化合物,采用浸渍法筛选这些化合物的杀秀丽线虫(Caenorhabditiselegans)活性,并对他们的杀线虫活性进行比较,为开发新的杀线虫剂提供参考。
1 材料与方法
1.1 材料
本实验中合成苯二酚内酯及其衍生物的质粒和酿酒酵母菌株BJ5464-NpgA均由本课题组保存。苯二酚内酯及其衍生物的详细信息如表1所示。供试线虫为秀丽线虫,伊维菌素购自齐鲁动物保健有限公司。
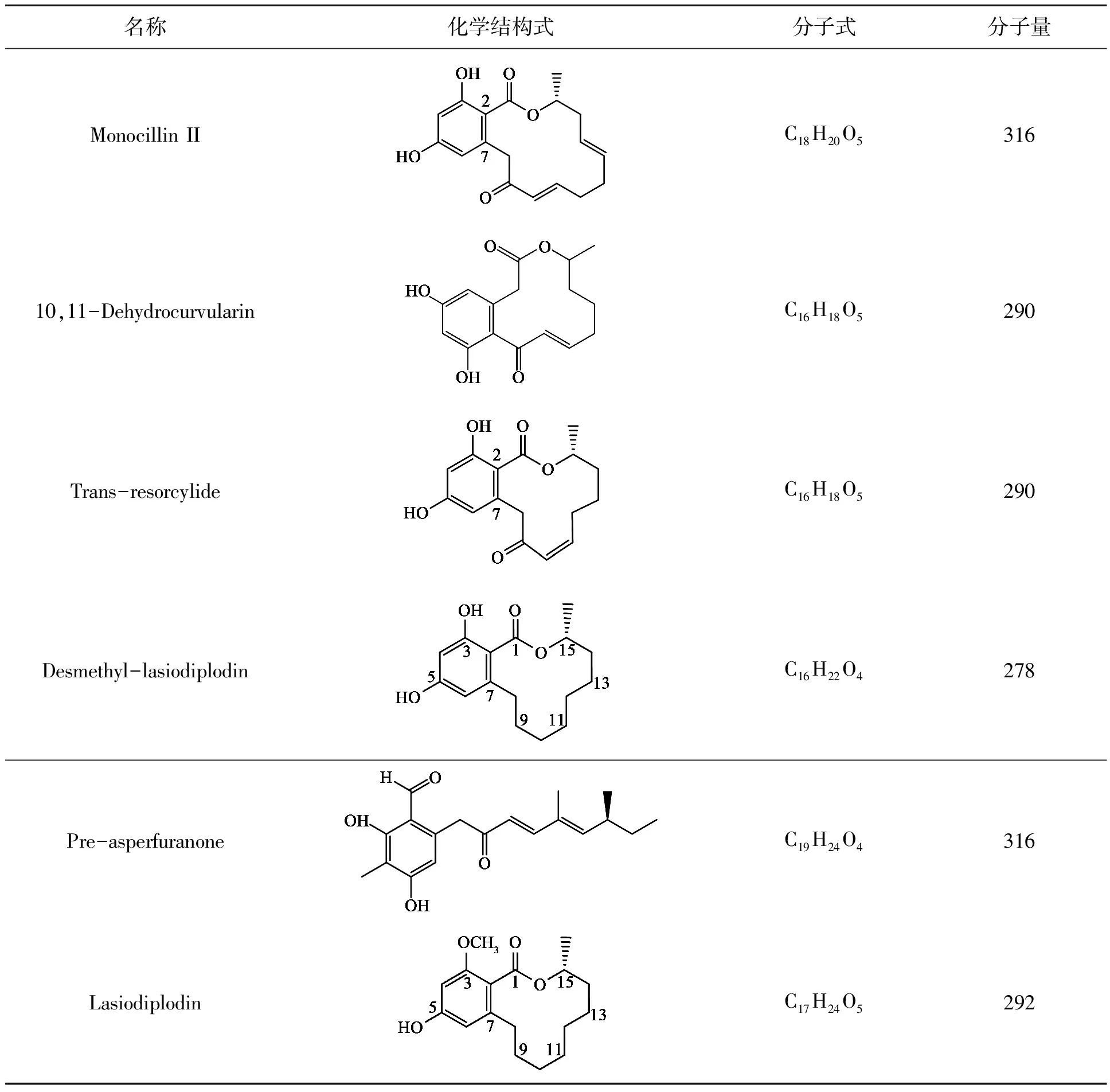
表1 苯二酚内酯及其衍生物的结构Table 1 Construction of benzenediol lactones and derivatives.
1.2 方法
1.2.1供试苯二酚内酯及其衍生物的异源表达[8]用Frozen EZ Yeast Transformation Ⅱ(TZ001)试剂盒将含有合成苯二酚内酯基因的质粒转入到酿酒酵母中,在Trp和Ura二缺(或-Leu-Trp-Ura三缺)SC培养基上筛选双(3个)质粒酵母转化菌落。挑取二缺(三缺)SC培养基平板转化菌落,接种到25 mL相应的SC液体培养基中,28℃,220 r/min摇床培养;培养约24 h至OD600=0.6,加入等体积1%葡萄糖的酵母丰富培养基,继续发酵;培养72 h后,用乙酸乙酯萃取;反向高效液相色谱(HPLC)检测,确定后大规模发酵。
1.2.2供试苯二酚内酯及其衍生物的分离纯化[9]将粗提物用适量甲醇溶解后,与100~200目硅胶拌匀;称取300~400目硅胶(粗提物:300~400目硅胶质量比=1∶13~1∶15)加入一定体积的石油醚,用玻璃棒搅拌成匀浆后,湿法装柱。上样后流动相洗脱,收集流分后,洗脱液依次为石油醚、石油醚与乙酸乙酯混合物(石油醚与乙酸乙酯的比例根据所提取的化合物不同而变化)、甲醇。
将收集到的流分用薄层色谱硅胶板(TLC)检测后,相同比移值(Rf)的组分合并后用旋转蒸发仪蒸干,用HPLC检测,以确定目标化合物。再将其进一步分离,最后用HPLC在210 nm下检测化合物的纯度,称重后4℃保存。
1.2.3制备秀丽隐杆线虫二龄幼虫悬浮液 利用网筛法制备秀丽隐杆线虫二龄幼虫悬浮液。已经灭菌的金属网筛摆放于烧杯中,从上到下的网筛依次为200目(75 μm)、400目(38 μm)、625目(20 μm),向烧杯中加入M9缓冲液,直至溶液界面到达625目网筛的中部;用M9缓冲液冲洗NGM培养基平板上的线虫后,将含有线虫的M9缓冲液加入到最上层筛网上,于超净台静置;约12 h后,用5 mL的移液枪沿着烧杯内壁与筛子外侧的缝隙,缓慢把缓冲液全部吸走,依次取出200目、400目、625目网筛,最后收集的线虫即为二龄幼虫。然后将秀丽线虫悬浮液稀释或者离心富集,制成浓度约600条/mL的秀丽隐杆线虫二龄幼虫悬浮液,以供毒力生物测定。
1.2.4确定合适的溶剂及助溶剂 采用浸渍法[10]测定甲醇、二甲基亚枫(DMSO)和Tween 80对秀丽线虫2龄幼虫的影响。活性测试选择在24孔板中进行,测试体系(线虫数量为60条,总体积为500 μL)如表2所示,于培养箱中20℃黑暗孵育。
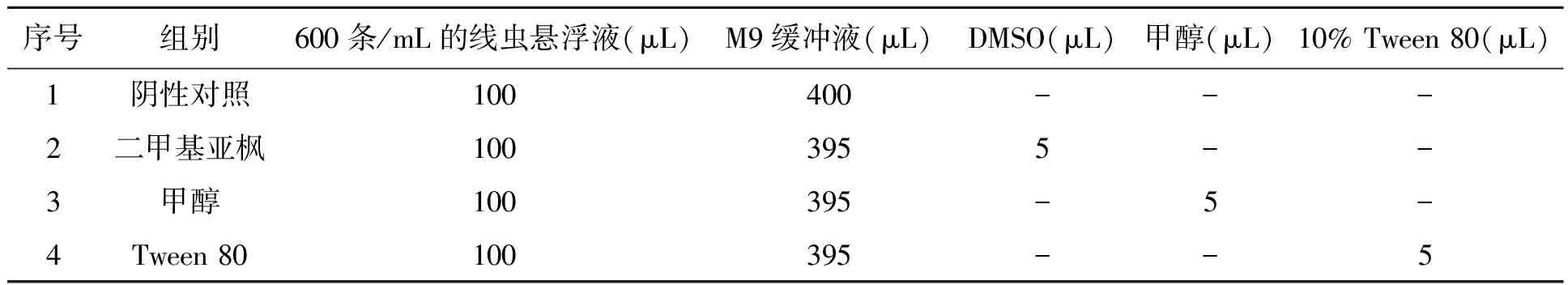
表2 有机溶剂及助溶剂测试体系Table 2 Test system of organic solvents and cosolvent.
待孵育24 h后,在解剖镜下观察线虫,统计线虫的死亡率,对于线虫死亡的检验方法为:用针刺线虫,僵直不动者为死亡,弯曲或明显钩状为活体。处理组和对照组,每组设3个平行。采用同样的方法测试有机溶剂和Tween 80混合对线虫的影响。
1.2.5苯二酚内酯及其衍生物对秀丽线虫2龄幼虫的影响 将苯二酚内酯及其衍生物分别用DMSO溶解,制成100 mg/mL的母液,置4℃保存备用;再将上述化合物稀释成50 mg/mL、20 mg/mL、10 mg/mL置4℃保存备用;活性测试选择在24孔板中进行,测试体系(线虫数量为60条,总体积为500 μL)如表3所示。于20℃黑暗孵育24 h;最终体系中DMSO的终浓度为1%,Tween 80的终浓度为0.1%;统计线虫的死亡率,处理组和对照组重复3次。
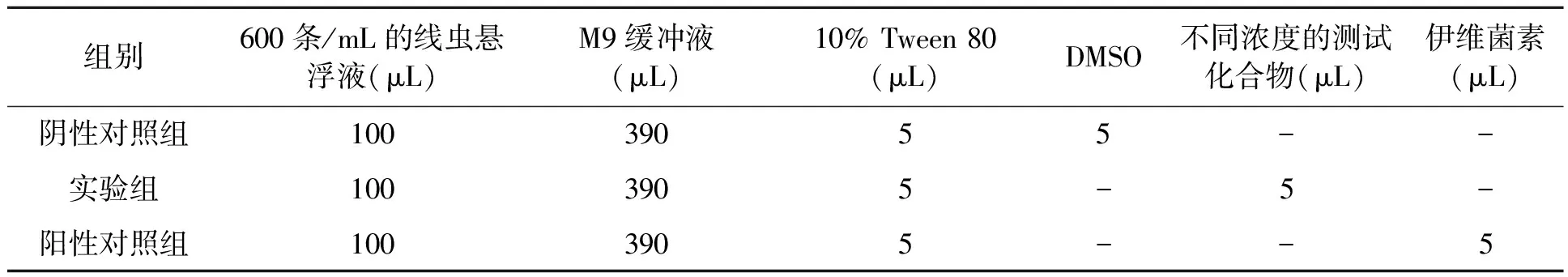
表3 苯二酚内酯及其衍生物的测试体系Table 3 Test system of BDLs and their derivatives.
1.3 统计学分析
为了消除线虫自然死亡对实验的影响,因此采用校正死亡率[11]计算杀线虫活性。
2 结果与分析
2.1 有机溶剂及助溶剂对线虫的影响
采用浸渍法测定1%的甲醇、1% DMSO、0.1% Tween 80及有机溶剂和Tween 80混合对线虫的影响,数据处理采用独立样品的t检验(95%的置信区间)。
如图1所示,当体系中DMSO、甲醇的终浓度为1%时,处理组线虫的死亡率和对照组M9的线虫死亡率没有显著性差异(P>0.05);当体系中的助溶剂Tween 80终浓度为0.1%时,处理组线虫的死亡率和对照组M9的线虫死亡率没有显著性差异(P>0.05);当体系中DMSO 1%-Tween 80 0.1%或者甲醇 1%-Tween 80 0.1%时,处理线虫的死亡率和对照组M9的线虫死亡率没有显著性差异(P>0.05),表明当体系中存在DMSO 1%-Tween 80 0.1%对线虫没有伤害。
2.2 苯二酚内酯及其衍生物的杀线虫活性
采用浸渍法测定不同浓度苯二酚内酯及其衍生物的杀线虫活性,结果如图2所示,供筛选的6种苯二酚内酯及其衍生物,处理24 h后,10,11-dehydrocurvularin表现出了较强的杀线虫活性,在0.5 mg/mL、0.2 mg/mL和0.1 mg/mL,其校正死亡率分别为46.41%±8.54%、15.30%±5.60%和7.95%±2.71%;desmethyl-lasiodiplodin的杀线虫活性较弱,浓度在0.5 mg/mL、0.2 mg/mL和0.1 mg/mL时,其校正死亡率分别为27.47%±2.19%、8.94%±0.64%和3.41%±0.62%。
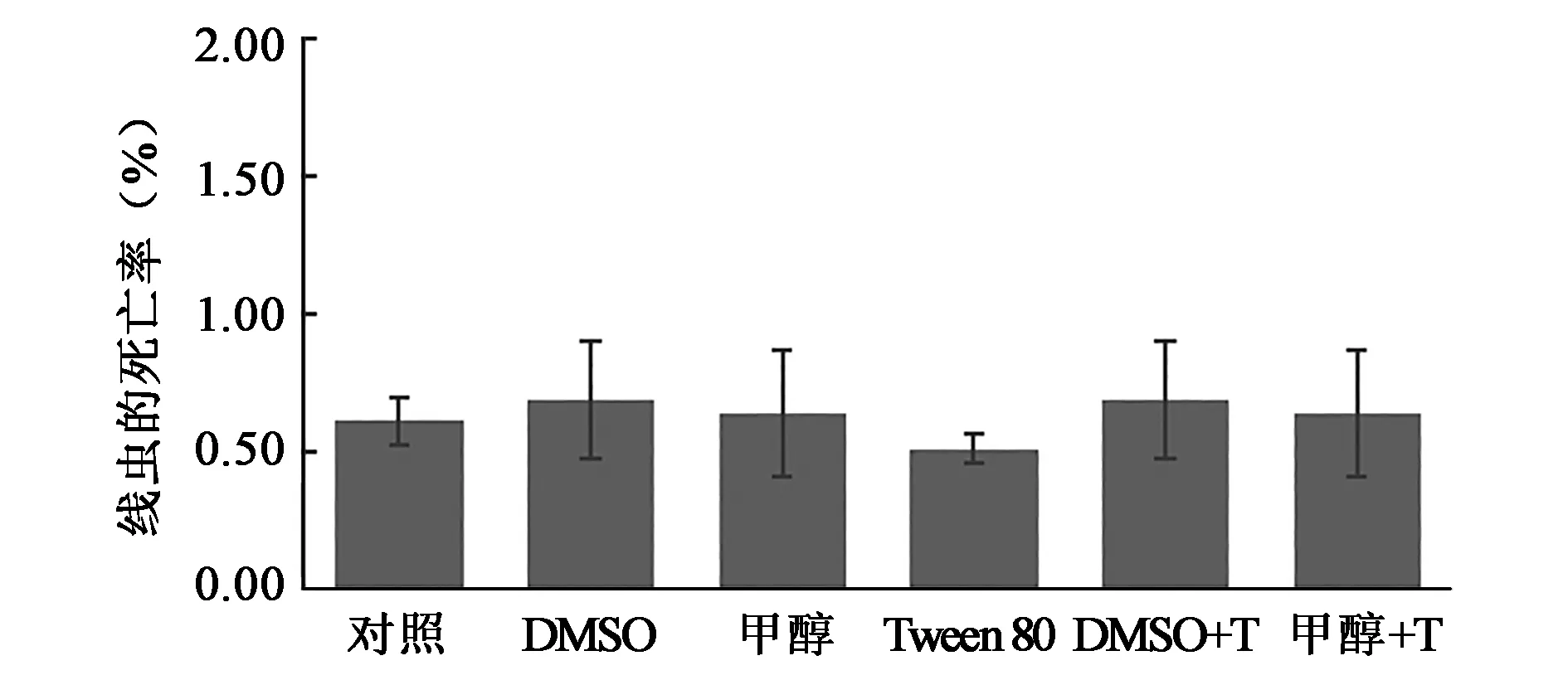
图1 有机溶剂及助溶剂对线虫的影响Fig.1 Effects of organic solvents and solvents on Caenorhabditis elegans.注:对照:M9缓冲液;DMSO:体系中DMSO的终浓度为1%;甲醇:体系中甲醇的终浓度为1%;Tween 80:体系中Tween 80终浓度为0.1%;DMSO+T:体系中DMSO的终浓度为1%,Tween 80的终浓度为0.1%;甲醇+T:体系中甲醇的终浓度为1%, Tween 80的终浓度为0.1%。
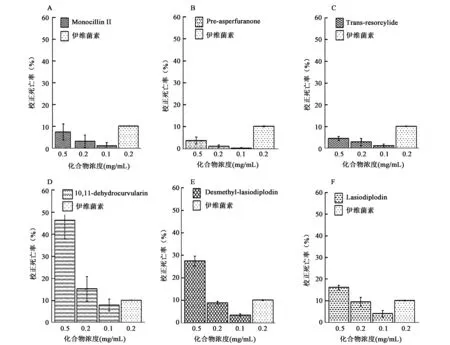
图2 苯二酚内酯及其衍生物的杀线虫活性Fig.2 The nematocidal activities of benzenediol lactones and derivatives.
Monocillin II、trans-resorcylide和pre-asperfuranon在0.5 mg/mL下,其校正死亡率均不超过10%。阳性对照伊维菌素浓度为0.2 mg/mL和0.1 mg/mL时,其校正死亡率分别为10.12%±0.17%和5.67%±1.26%。因为本实验中所用的伊维菌素浓度大于0.2 mg/mL,会产生严重的遮盖,无法统计线虫的死亡率。
对10,11-dehydrocurvularin、desmethyl-lasiodiplodin、lasiodiplodin和阳性对照伊维菌素在0.2 mg/mL时的校正死亡率进行单因素方差分析,如图2所示,在0.2 mg/mL时,10,11-dehydrocurvularin、desmethyl-lasiodiplodin、lasiodiplodin和伊维菌素的校正死亡率无显著性差异。
对desmethyl-lasiodiplodin和lasiodiplodin在0.5 mg/mL时,线虫的校正死亡率进行单因素方差分析,desmethyl-lasiodiplodin与lasiodiplodin校正死亡率存在显著性差异(P<0.05)。对desmethyl-lasiodiplodin、lasiodiplodin浓度在0.2 mg/mL时的校正死亡率进行单因素方差分析,desmethyl-lasiodiplodin与lasiodiplodin校正死亡率无显著性差异(P>0.05)。
在体视显微镜下(目镜10×,物镜40×)观察死亡的线虫,如图3(彩图见图版三)所示,死亡的线虫僵直不动,活的线虫成弯曲状。从图中可以看出活的线虫口、咽和肠道保持完好。而死亡的线虫其体内已经看不清这些器官,器官组织已经成分散状。
3 讨论
本文通过异源表达和浸渍法的方法,研究了苯二酚内酯及其衍生物的杀线虫活性。首次发现10,11-dehydrocurvularin和desmethyl-lasiodiplodin的杀线虫活性。
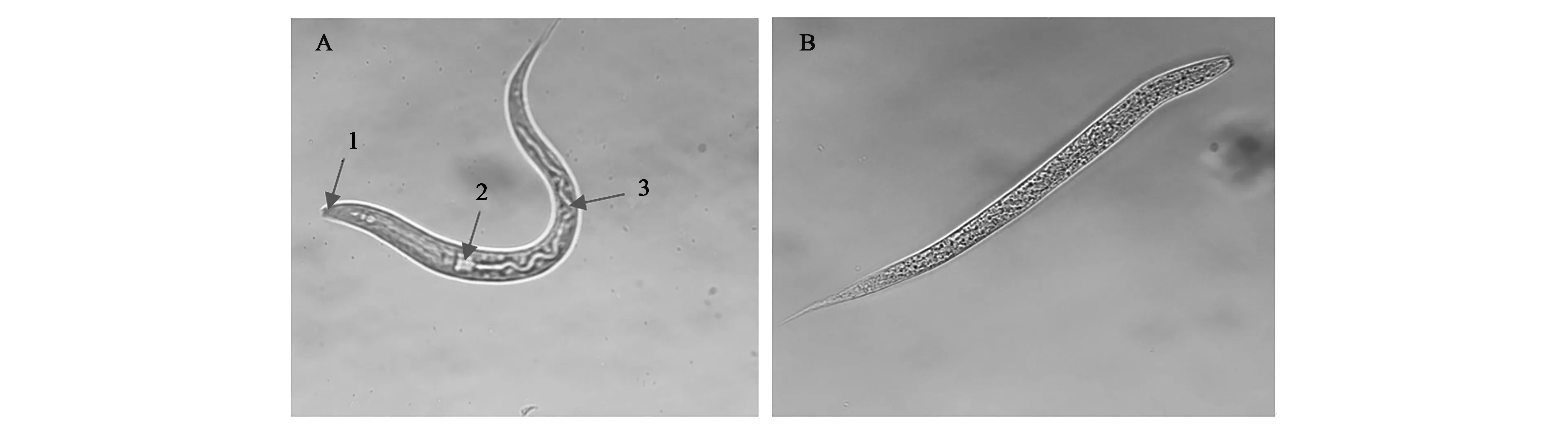
图3 秀丽线虫L2在处理前(A)和BDLs处理24 h后(B)对比Fig.3 Comparation of Caenorhabditis elegans L2 before (A) and after immersing in BDLs for 24 h (B).注:1:线虫的口;2:线虫的咽;3:线虫的肠(彩图见图版三)
Kusan等[12]从青霉的菌丝体和发酵液中分离得到4种苯二酚内酯化合物,当11-hydrocurvularin、β,γ-dehydrocurvularin、11-β-hydroxy-12-oxo-curvularin、12-oxo-curvularin的浓度为300 mg/L时,根腐线虫(Pratylenchusspp.)死亡率分别是35%、80%、23%和33%。
Dong等[13]从真菌CaryosporacallicarpaYMF1.01026中分离得到3个BDLs类似结构化合物,当caryospomycins A~C的浓度为200 mg/L时,松材线虫(B.xylophilus)的死亡率分别是57.1%、47.8%和38.5%。10,11-Dehydrocurvularin和desmethyl-lasiodiplodin在200 mg/L时,秀丽线虫的校正死亡率分别为15.30%和8.90%。但是在本实验中,当化合物浓度为200 mg/L时,10,11-dehydrocurvularin、desmethyl-lasiodiplodin、lasiodiplodin和阳性对照伊维菌素的校正死亡率无显著性差异。苯二酚内酯及其衍生物杀线虫活性的差异可能不仅与受测线虫有关,也与其结构有关。
为了验证BDLs的结构与其杀线虫活性有无特定的关系,将具有杀线虫活性BDLs及其衍生物聚类分析。结果表明成环的前体pre-asperfuranone(RAL)没有杀线虫活性;14元环的DALs暂时没有文献报道是否有杀线虫活性;12元环RALs(desmethyl-lasiodiplodin)、12元环DALs(11-hydrocurvularin、β,γ-dehydrocurvularin、11-β-hydroxy-12-oxo-curvularin、12-oxo-curvularin和10,11-dehydrocurvularin)和14元环RALs(caryospomycins A~C)均存在杀线虫活性化合物。这表明BDLs杀线虫的活性与其骨架结构(RALs、DALs)没有特定的规律。
根据文献报道伊维菌素杀线虫机制主要是作用于氯离子通道,导致线虫的死亡[14]。在秀丽隐杆线虫中的转化生长因子β(transorming growth facter β,TGF-β)信号通路在秀丽线虫的先天性免疫系统发挥重要作用。Rudolph等[15]研究发现TGF-β的受体不会被10,11-dehydrocurvularin抑制,但是10,11-dehydrocurvularin通过阻断Smad转录因子与DNA上CAGA序列的结合,导致TGF-β信号通路的中断。进一步的研究发现10,11-dehydrocurvularin能够引起TGF-β调控的下游基因表达降低,如pai-1、pdgf、smad7和mmp-2等,甚至在HepG2细胞内引起了tgf-β的下调。因此10,11-dehydrocurvularin杀线虫活性可能与TGF β-Smad信号通路有关。
既往研究证实Desmethyl-lasiodiplodin的-OH是其生物活性如抗肿瘤、抗菌的重要基团,其苯环上的-OH修饰为-OCH3后引起了其抗肿瘤、抗菌能力的下降[16,17]。Buayairaksa等[16]研究发现与desmethyl-lasiodiplodin相比,lasiodiplodin对KB、BC1和NCI-H187的IC50分别上升了1.6倍、2.7倍和1.9倍。Yang等[17]研究发现desmethyl-lasiodiplodin对金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、肠炎沙门氏菌(Salmonellaenteritidis)和尖孢镰刀菌古巴专化型(Fusariumoxysporumf. sp.cubense)的IC50分别为6.25 μg/mL、12.5 μg/mL、12.5 μg/mL、100 μg/mL和50 μg/mL;但是lasiodiplodin对这些病菌的IC50分别上升了4倍、4倍、8倍和2倍。在本研究中,在0.5 mg/mL时,与desmethyl-lasiodiplodin相比,lasiodiplodin处理下的线虫校正死亡率下降了1.7倍,这表明desmethyl-lasiodiplodin苯环上的-OH也是其杀线虫活性的重要基团。
和大多数农药原药一样,苯二酚内酯及其衍生物不易溶于水。在后续的实验中,一方面将利用组合生物学对其结构进行修饰,如将其苯环上的-OH进行糖基化,甲基化等修饰增强其水溶性,另一方面将通过研究不同溶剂和乳化剂的配比制成合适的农药剂型,以便其更好的应用于生产。
[1] Abad P, Gouzy J, Aury J,etal.. Genome sequence of the metazoan plant-parasitic nematodeMeloidogyneincognita[J]. Nat. Biotechnol., 2008, 26(8): 909-915.
[2] 董 娜, 张路平, 康云晖. 植物线虫寄生策略及致病机理[J]. 河北师范大学学报(自然科学版), 2003, 27(3): 298-301.
[3] 陶 玲, 旭格拉, 哈布丁, 等. 红树林植物内生放线菌 I07A-01824 发酵液中杀线虫活性成分的分离, 纯化与鉴定[J]. 中国医药生物技术, 2012, 7(1): 5-8.
[4] Winssinger N, Barluenga S. Chemistry and biology of resorcylic acid lactones[J]. Chem. Commun., 2007(1): 22-36.
[5] Shen W, Mao H, Huang Q,etal.. Benzenediol lactones: a class of fungal metabolites with diverse structural features and biological activities[J]. Eur. J. Med. Chem., 2015, 97: 747-777.
[6] Winssinger N, Fontaine J G, Barluenga S. Hsp90 inhibition with resorcylic acid lactones (RALs) [J]. Curr. Topics Med. Chem., 2009, 9(15): 1419-1435.
[7] 杨振东,王加生,唐莉莉,等. 玉米赤霉烯酮暴露对秀丽线虫生殖系统的损伤作用[J]. 生态毒理学报, 2016(06): 171-176.
[8] Xu Y, Espinosa-Artiles P, Schubert V,etal.. Characterization of the biosynthetic genes for 10, 11-dehydrocurvularin, a heat shock response-modulating anticancer fungal polyketide fromAspergillusterreus[J]. Appl. Envir. Microbiol., 2013, 79(6): 2038-2047.
[9] Xu Y, Zhou T, Espinosa-Artiles P,etal.. Insights into the biosynthesis of 12-membered resorcylic acid lactones from heterologous production inSaccharomycescerevisiae[J]. ACS Chem. Biol., 2014, 9(5): 1119-1127.
[10] Caboni P, Aissani N, Cabras T,etal.. Potent nematicidal activity of phthalaldehyde, salicylaldehyde, and cinnamic aldehyde againstMeloidogyneincognita[J]. J. Agric. Food Chem., 2013, 61(8): 1794-1803.
[11] Caboni P, Ntalli N G, Aissani N,etal.. Nematicidal activity of (E, E)-2,4-decadienal and (E)-2-decenal fromAilanthusaltissimaagainstMeloidogynejavanica[J]. J. Agric. Food Chem., 2012, 60(4): 1146-1151.
[12] Kusano M, Nakagami K, Fujioka S,etal.. βγ-dehydrocurvularin and related compounds as nematicides ofPratylenchuspenetransfrom the fungusAspergillussp.[J]. Biosci. Biotechnol. Biochem., 2003, 67(6): 1413-1416.
[13] Dong J, Zhu Y, Song H,etal.. Nematicidal resorcylides from the aquatic fungusCaryosporacallicarpaYMF1. 01026[J]. J. Chem. Ecol., 2007, 33(5): 1115-1126.
[14] Hibbs R E, Gouaux E. Principles of activation and permeation in an anion-selective Cys-loop receptor[J]. Nature, 2011, 474(7349): 54-60.
[15] Rudolph K, Serwe A, Erkel G. Inhibition of TGF-β signaling by the fungal lactones (S)-curvularin, dehydrocurvularin, oxacyclododecindione and galiellalactone[J]. Cytokine, 2013, 61(1): 285-296.
[16] Buayairaksa M, Kanokmedhakul S, Kanokmedhakul K,etal.. Cytotoxic lasiodiplodin derivatives from the fungusSyncephalastrumracemosum[J]. Arch. Pharm. Res., 2011, 34(12): 2037-2041.
[17] Yang R, Li C, Lin Y,etal.. Lactones from a brown alga endophytic fungus (No. ZZF36) from the South China Sea and their antimicrobial activities[J]. Bioorg. Med. Chem. Lett., 2006, 16(16): 4205-4208.
StudiesontheNematocidalActivitiesofBenzenediolLactonesandTheirDerivatives
ZHANG Rongru1,2,3, ZHANG Liwen1, ZHANG Peng1, ZHANG Yueling2, LIU Zhu3*, XU Yuquan1*
1.BiotechnologyResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China; 2.CollegeofScience,ShantouUniversity,GuangdongShantou515063,China; 3.InstituteofTropicalAgricultureandForestry,HainanUniversity,Haikou570228,China
Benzenediol lactones(BDLs) and their derivatives, including monocillin II, 10,11-dehydrocurvularin, pre-asperfuranone, trans-resorcylide, desmethyl-lasiodiplodin and lasiodiplodin, were obtained by heterologous biosynthesis in yeast. Their nematocidal activities were researched in this study. For the first time, 10,11-dehydrocurvularin and desmethyl-lasiodiplodin were found with nematocidal activity. After treatingCaenorhabditiseleganswith 0.1 mg/mL, 0.2 mg/mL and 0.5 mg/mL of 10,11-dehydrocurvularin and desmethyl-lasiodiplodin for 24 h, respectively, the corrected mortality rate ofC.eleganswas 7.95%, 15.30%, 46.41% and 3.41%, 8.90%, 27.47%. Nematocidal activity of lasiodiplodin was decreased, and the corrected mortality rate with 0.5 mg/mL was 16.12%. This study provided a new idea for the prevention and cure of plant nematode disease.
benzenediol lactones;Caenorhabditiselegans; 10,11-dehydrocurvularin; desmethyl-lasiodiplodin; nematicidal activity
2017-04-13;接受日期2017-06-14
国家自然科学基金项目(31560021);农业部948计划项目(2016-X43);国家国际科技合作专项(2015DFR31060);海南省重点研发计划(ZDYF2017020)资助。
张荣儒,硕士研究生,主要从事微生物防治植物病害研究。E-mail:zzru2010@126.com。*通信作者:刘 柱,教授,主要从事微生物农药研究。E-mail:zhuliu@hainu.edu.cn;徐玉泉,研究员,主要从事微生物次生代谢产物的研究。E-mail:xuyuquan@caas.cn
10.19586/j.2095-2341.2017.0026

