杨梅花色苷提取及其抗氧化性研究
李 涛,赵 云,吴晓琳
1.揭阳职业技术学院生物工程系 (揭阳 522000)2.揭阳职业技术学院实训与信息中心 (揭阳 522000)
杨梅花色苷提取及其抗氧化性研究
李 涛1,赵 云2,吴晓琳1
1.揭阳职业技术学院生物工程系 (揭阳 522000)2.揭阳职业技术学院实训与信息中心 (揭阳 522000)
以杨梅为原料,利用超声波辅助提取其花色苷。在单因素试验的基础上,采用正交试验优化,结果表明,超声波提取杨梅花色苷的主要因素为料液比,其次为乙醇浓度、提取时间和提取温度。杨梅花色苷提取的最佳条件如下:乙醇浓度为25%,料液比为1∶14,提取时间为25 min,提取温度40 ℃。在此条件下,杨梅花色苷的平均含量为0.687 5 mg/g。通过体外抗氧化实验,表明该花色苷具有显著的DPPH自由基清除能力。
杨梅;花色苷;提取;抗氧化性
花色苷(Anthocyanin)是一类广泛存在于植物的花、果实和叶中的水溶性天然色素,是花和果实呈现靓丽颜色(红、橙、蓝)的主要物质基础[1]。花色苷不但可以作为天然色素,而且在抗氧化[2]、抗炎症、抗突变、抗肿瘤[3]、改善视力、预防和治疗心血管疾病等方面具有良好的作用[4]。花色苷在杨梅(Myrica rubra Sied et Zucc.)中的含量非常丰富,达45.31 mg/100 g(以鲜果计)。杨梅是双子叶植物纲杨梅科杨梅属乔木,广泛分布于我国南方各地。其成熟果实呈紫红色,颜色鲜艳诱人,果味酸甜,汁液丰富,并含有大量的花色素,是天然食用色素非常好的来源[5]。
本研究以广东省潮汕地区杨梅为原料,在单因素试验的基础上,通过正交试验对杨梅花色苷的提取工艺进行优化,通过DPPH自由基清除试验考查了其体外抗氧化能力,以期为杨梅深加工和活性成分开发提供理论依据。
1 材料与方法
1.1 主要仪器
KH3200V型超声波清洗器(昆山禾创超声仪器有限公司);JA2003型电子天平(上海舜宇恒平科学仪器有限公司);SHB-ⅢA型循环水式多用真空泵(郑州长城科工贸有限公司);S22型可见分光光度计(上海棱光技术有限公司)。
1.2 材料与试剂
杨梅:购于广东省潮州市金灶;盐酸缓冲液(pH 1.0),将0.2 mol/L KCl和0.2 mol/L HCl按体积比25:67混合;醋酸缓冲液(pH 4.5),将1 mol/L NaAc、1 mol/L HCI与H2O以100∶60∶90的比例配制;DPPH购自Sigma公司;甲醇、乙醇、盐酸,均为分析纯。
1.3 试验方法
1.3.1工艺路线
杨梅→清洗晾干→捣碎→称重→超声波辅助提取→抽滤→定容→测定
操作工艺如下:
(1) 清洗晾干:取完整、无破损、无病变的杨梅,用清水冲洗,晾干至表面无水分。
(2) 超声波辅助提取:称取经搅拌均匀的杨梅汁5.000 g于250 mL锥形瓶中,置于超声波清洗器中超声(功率为300 W)提取。
(3) 抽滤:经提取后的杨梅提取液进行抽滤,并用少量水冲洗两次,合并滤液。
要使学生掌握抽象数学对象、发现和提出数学问题的方法,要将此作为教学的关键任务,以实现从“知其然”到“知其所以然”再到“何由以知其所以然”的跨越.
(4)定容:将滤液转移至100 mL容量瓶中,定容。
1.3.2单因素试验
取杨梅汁5 g,按不同料液比,加入用0.1% HCl酸化的不同体积分数的乙醇或甲醇,在不同温度条件下,超声(功率为300 W)提取不同时间,抽滤得到浸提液。比较溶剂及其浓度、料液比、提取温度、提取时间等因素对花色苷提取率的影响。
1.3.3杨梅花色苷提取的工艺优化
在单因素试验的基础上,选择乙醇浓度、料液比和提取时间作为考察因素,进行L9(34)正交实验,优化杨梅花色苷提取的工艺。
1.3.4花色苷含量测定
参照宋德群等[6]的pH示差法测定提取花色苷的含量进行测定,略有改动。将提取的溶液定容至100 mL,从中取2 mL提取液分别用pH值1.0和pH值4.5缓冲液定容至25 mL,测其含量,计算公式为:

(1)
式中:ρ为花色苷含量,mg/g;A0、A1分别为pH 1.0、pH 4.5时花色苷在520 nm波长处的吸光度;V为提取液总体积,mL:n为稀释倍数;M为矢车菊色素-3-葡萄糖苷的相对分子质量,取值449;ε为矢车菊色素-3-葡萄糖苷的消光系数,取值29 600;m为样品质量,g。
1.3.5杨梅花色苷DPPH·自由基清除能力测定
参考徐金瑞等[7]抑制DPPH·能力的方法。用无水乙醇配制2×10-4mol/L的DPPH·溶液,在10 mL具塞试管中加入2 mL DPPH·溶液(2×10-4mol/L)和2 mL一定浓度的样品液,总体积4 mL。混合均匀,黑暗下室温避光反应30 min后,以无水乙醇调零点,于光径1 cm比色皿中测定DPPH·混合溶液在517 nm处的吸光度。
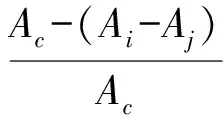
(2)
式中,Ai为2 mL DPPH·溶液+2 mL样品液的吸光度;Aj为2 mL样品液+2 mL无水乙醇的吸光度;Ac为2 mL DPPH·溶液+2 mL无水乙醇的吸光度。
2 结果与讨论
2.1 单因素试验
2.1.1提取溶剂浓度对花色苷含量的影响
取杨梅汁5 g,按料液比1:8,加入用0.1% HCl酸化的体积分数分别为10%、25%、40%、55%、70%的乙醇(甲醇)超声(功率为300 w)提取10 min,提取温度为40 ℃,抽滤得到乙醇(甲醇)浸提液,定容至100 mL,测定花色苷含量,结果见图1。

图1 提取溶剂对花色苷含量的影响
由图1可以看出,不同提取溶剂对杨梅花色苷含量影响不大,基于安全性和成本考虑,选择乙醇作为提取溶剂;杨梅花色苷含量随着乙醇浓度的增大呈先增大后减小的趋势,当乙醇浓度为25%时,花色苷含量达到最大,所以选择乙醇浓度为25%。
2.1.2料液比对花色苷含量的影响
取杨梅汁5 g,加入按料液比分别为1∶4、1∶6、1∶8、1∶10、1∶12、1∶14,用0.1% HCl酸化的体积分数为25%的乙醇超声提取10 min,提取温度为40 ℃,抽滤得到乙醇浸提液,定容至100 mL,测定花色苷含量,结果见图2。

图2 料液比对花色苷含量的影响
由图2可知,含量随料液比的增加基本呈先升高后下降的趋势,但当料液比达到1∶12时,含量达到最大值,选择料液比为1∶12。
2.1.3提取时间对花色苷含量的影响
取杨梅汁5 g,加入料液比为1∶12,用0.1% HCl酸化的体积分数为25%的乙醇超声分别提取5 min、10 min、15 min、20 min、25 min、30 min,提取温度为40 ℃,抽滤得到乙醇浸提液,定容至100 mL,测定花色苷含量,结果见图3。

图3 提取时间对花色苷含量的影响
由图3可知,含量随提取时间的增加呈先升高后下降的趋势,当提取时间达到15 min时,含量达到最大值,选择提取时间为15 min。
2.1.4提取温度对花色苷含量的影响
取杨梅汁5 g,加入料液比为1∶12,用0.1% HCl酸化的体积分数为25%的乙醇分别在30 ℃、40 ℃、50 ℃、60 ℃、70 ℃下超声提取15 min,抽滤得到乙醇浸提液,定容至100 mL,测定花色苷的含量,结果见图4。

图4 提取温度对花色苷含量的影响
由图4可知,含量随提取温度的增加基本呈逐渐增大的趋势,但当提取温度达到40 ℃时,随着温度的升高含量变化较小,基于成本考虑,选择提取温度为40 ℃。
2.2 杨梅花色苷提取的工艺优化
在单因素试验的基础上,因提取温度对杨梅花色苷含量无明显影响,选择乙醇浓度、料液比和提取时间作为考察因素,进行L9(34)正交实验,实验因素和水平见表1,结果与分析见表 2。

表1 因素水平表

表2 正交试验结果
由表2可知,影响杨梅花色苷含量的因素主次顺序为:料液比(B)>乙醇浓度(A)>提取时间(C),杨梅花色苷提取的最佳工艺条件为:A2B3C3,即乙醇浓度为25%,料液比为1∶14,提取时间为25 min。按此最优组合平行试验3次,杨梅花色苷的平均含量为0.687 5 mg/g。
2.3 杨梅花色苷DPPH·自由基清除作用
以杨梅花色苷提取的最佳工艺条件制得的提取液,按2.4方法测定其对DPPH·自由基的清除作用,得出其对DPPH·自由基清除率为98.98%~99.32%。
3 结论
通过单因素试验和正交试验,结果表明,影响杨梅花色苷含量的因素主次顺序为:料液比>乙醇浓度>提取时间>温度,超声波辅助提取杨梅花色苷的最佳条件如下:乙醇浓度25%,料液比1∶14,提取时间25 min,提取温度40 ℃。按此最优组合平行试验3次,杨梅花色苷的平均含量为0.687 5 mg/g。通过体外抗氧化实验得出其对DPPH·自由基清除率为98.98%~99.32%,表明该花色苷具有显著的DPPH自由基清除能力。
[1] 赖剑峰,杨荣玲,林耀盛,等.杨梅花色苷分离纯化制备矢车菊素-3-葡萄糖苷的研究[J]. 热带作物学报,2013,34(7):1354-1358.
[2] 胡林子,马永全,于 新.紫甘薯色素抗菌与抗氧化作用研究进展[J].食品工业科技,2011 (2):389-392.
[3] 唐传核,彭志英.天然花色苷类色素的理化功能及应用前景[J].冷饮与速冻食品,2000 (1):26-28.
[4] 代小梅,李 沆,姜 丽.超声波辅助法对紫甘薯花色苷提取效果的研究[J].中国调味品,2016, 41(9):141-144.
[5] 刘传菊,戚向阳,任献忠,等.杨梅花色苷的提取分离研究[J].中国食品学报,2009,9 (1):59-65.
[6] 宋德群,盂宪军,王晨阳,等.蓝莓花色苷的pH示差法测定[J].沈阳农业大学学报,2013 44(2):231-233.
[7] 徐金瑞,张名位,刘兴华,等.黑大豆种皮花色苷的提取及其抗氧化作用研究[J].农业工程学报,2005,21(8):161-164.
ExtractionandantioxidantactivityofanthocyaninfromMyricarubra
Li Tao1, Zhao Yun2, Wu Xiaolin1
1.Department of Biological Engineering, Jieyang Vocational and Technical College (Jieyang 522000) 2.Training and Information Center, Jieyang Vocational and Technical College (Jieyang 522000)
Ultrasonic-assisted extraction was used to extract anthocyanin from Myrica rubra. On the basis of single factor experiments, the orthogonal test was used. The results show that the orders of parameters affecting extraction efficiency are the ratio of material and liquidal, cohol content, extraction time and extraction temperature. The optimal conditions of extraction are obtained as follows: alcohol content 25%, the ratio of material and liquid 1∶14, extraction time 25 min and extraction temperature 40 ℃. In this case, the content of extraction is 0.687 5 mg/g. The anthocyanin of Myrica rubra shows strong ability of scavenging DPPH free radicals through antioxidant tests in vitro.
Myrica rubra; anthocyanin; extraction; antioxidant activity
2017-07-10
2017年度广东大学生科技创新培育(攀登计划)项目(pdjh2017b0782)。
李 涛,男,1981年出生,硕士,讲师,研究方向为食品分析检测与质量安全。
TS201
A
1672-5026(2017)06-070-03

