一种含二苯甲酮结构光引发剂的合成及光引发活性研究
郝亚娟,王 磊,聂 俊(通讯作者),杨金梁(通讯作者)
(1北京化工大学常州先进材料研究院 江苏 常州 213000)
(2北京化工大学材料科学与工程学院 北京 100029)
(3常州格林感光新材料有限公司 江苏 常州 213000)
一种含二苯甲酮结构光引发剂的合成及光引发活性研究
郝亚娟1,2,王 磊1,2,聂 俊2(通讯作者),杨金梁1,3(通讯作者)
(1北京化工大学常州先进材料研究院 江苏 常州 213000)
(2北京化工大学材料科学与工程学院 北京 100029)
(3常州格林感光新材料有限公司 江苏 常州 213000)
本文以4-羟基二苯甲酮和溴丙烯为原材料合成了一种含二苯甲酮结构的光引发剂(POBP)。通过核磁共振谱图确定了其结构;利用紫外吸收谱图研究了其紫外吸收和光降解性能;最后通过了RT-FTIR分析了光引发剂浓度、光照强度和反应单体对光聚合反应的影响。结果表明,POBP最大吸收波长相对二苯甲酮(BP)红移了33.6nm,且其吸光能力大大增强,引发HDDA效率较传统二苯甲酮的提高也意味着POBP是一种很好的光引发剂。
光聚合;光引发剂;二苯甲酮
1 引言
光聚合具有反应条件温和、反应速度快、对基材损伤小、没有三废排放、不污染环境等优点[1-3],光固化在油墨、涂料、光刻胶、微电子、生物材料和牙齿修复材料等方面均有着广泛的应用[4-7]。一般而言,光固化体系包含齐聚物、单体、光引发剂和助剂,其中光引发剂虽所占含量较少但对整个体系起着至关重要的作用,因为引发剂能够在一定波长的紫外光照射下,吸收光能产生活性种、自由基或离子,从而引发单体聚合[8]。
二苯甲酮(BP)是一种容易合成、价格低廉、激发态的三线态寿命较长、且在助引发剂胺存在的条件下引发效率良好的type-II光引发剂[10],对丙烯酸酯类单体有着优良的引发能力,是目前应用最广泛的引发剂之一。此外BP在常用单体树脂中溶解性较好,与活性胺体系配合使用具有一定的抗氧阻聚效果[11]。由于BP属于夺氢双分子作用型的光引发剂,因此其光引发活性不如Irgacure1173和Irgacure184等,此外BP熔点较低,具有升华性,在升温时容易因挥发造成损失;而且BP分子量小,易从聚合物网络中迁移析出,这些都制约了其在食品和药物包装等与人体皮肤接触方面的产品应用[12-17]。因此BP的改性和衍生物的研究一直是传统光引发剂的热点之一[18-23]。
本文以4-羟基二苯甲酮和溴丙烯为原材料合成了一种在更大范围有紫外吸收的二苯甲酮衍生物POBP,且最大吸收波长较BP有所红移。利用FTIR、NMR对聚合过程和结构进行了表征,讨论了引发剂浓度、光强和单体对聚合过程的影响。结果表明,POBP是一种光引发活性较高的光引发剂,可以作为BP的替代产品使用,具有较好的应用前景。
2 实验部分
2.1 试剂
4-羟基二苯甲酮(HBP):化学纯,百灵威科技有限公司;乙腈:色谱纯,碳酸钾,3-溴丙烯:化学纯,国药集团化学试剂有限公司;乙醇钠:化学纯,上海阿拉丁生化科技股份有限公司;4-(溴甲基)二苯甲酮:实验室自制;4-二甲胺基苯甲酸乙酯(EDAB):化学纯,常州华钛公司;乙氧基乙氧基丙烯酸酯(EOEOEA),1,6-己二醇二丙烯酸酯(HDDA),1,6-己二醇二甲基丙烯酸酯(HDDMA),季戊四醇三丙烯酸酯(PETA),三羟甲基丙烷三丙烯酸酯(TMPTA):工业级,美国沙多玛公司;二氯甲烷(DCM)、丙酮、四氯化碳(CCl4)、无水乙醇:化学纯,北京化学试剂公司。
2.2 实验过程
POBP的合成过程如图1所示。
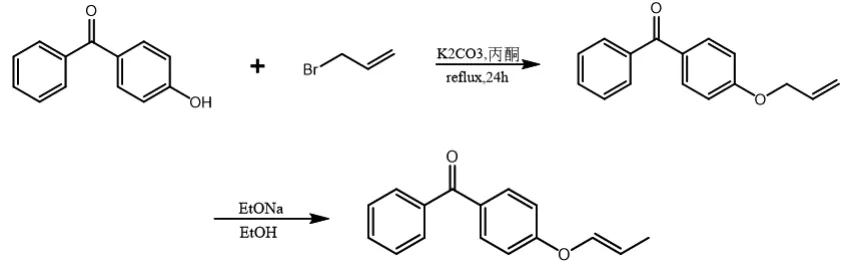
图1 POBP的合成示意图Fig.1 The synthesis route of POBP
将4-羟基二苯甲酮9.91g(50mmol)、碳酸钾3.46g(25mmol)、丙酮100ml一起加入到装有磁力搅拌和温度计的250ml三颈瓶中,通氮气,加热搅拌。将3-溴丙烯6.15g(51mmol)、丙酮60g(1mol)于恒压漏斗中混合均匀,再将混合液缓慢加入到三颈瓶中,升温至60℃回流24h,过滤,将溶剂旋蒸除去后,重结晶得到白色粉末晶体,4.76g。
将上述得到的白色粉末4.76g(约0.02mol)、无水乙醇100ml(干燥除水)加入到装有回流冷凝管和磁力搅拌的250ml三颈瓶中,通氮气,搅拌约1h,除体系中氧气。加入乙醇钠0.068g(1mmol),油浴加热,缓慢升温至80℃回流,通过薄层色谱法监测反应终点。待反应结束后,将溶剂旋蒸除去,粗产品用凝胶色谱柱分离进一步提纯,最终产物收率约53%。
2.3 仪器与表征方法
2.3.1 核磁共振氢谱表征 使用美国布鲁克公司生产的Bruker-AV400型超导核磁共振仪,测试了POBP的氢谱和碳谱,确定了其分子结构。测试所用内标物为四甲基硅烷(TMS),溶剂为氘代氯仿(DCCl3),频率为400兆赫。
2.3.2 紫外光谱及紫外光降解 使用日本Hitachi公司生产的U-3900型紫外分光光度计,以乙腈为溶剂,测试了引发剂产物在200~400nm范围内的紫外吸收光谱,确定其特征吸收峰,并通过Lambert-Beer Law计算出POBP在最大吸收波长处的摩尔消光系数。
POBP的光降解反应是通过紫外吸收光谱来监测的,首先将浓度为3×10-5mol•L-1的POBP的乙腈溶液,注入光程为1cm的比色皿中,通约30min氮气以除去溶液中的溶解氧,然后密封,测量溶液在光强为25mw/cm2的紫外光照射后的吸光度,光照时间依次为0s、10s、30s、60s、240s、600s、1500s,最终可得到经不同光照时间后POBP的紫外光降解曲线。
2.3.3 光聚合动力学研究 在UV光照射下,HDDA单体会发生光聚合,丙烯酸酯双键的特征吸收峰强度的减少能在红外光谱中反映出来。因此,可通过计算丙烯酸酯双键的特征吸收峰1640c m-1到1670c m-1附近峰面积的变化表征聚合转化率。单体中双键的转化率和聚合速率能够通过式(1)和(2)[24]计算得到。

式中:
A0——光照前的特征吸收峰面积
At——光照t时间的特征吸收峰面积

式中:
Rp——双键的光聚合反应速率
[M]0——单体初始浓度
3 结果与讨论
3.1 核磁表征
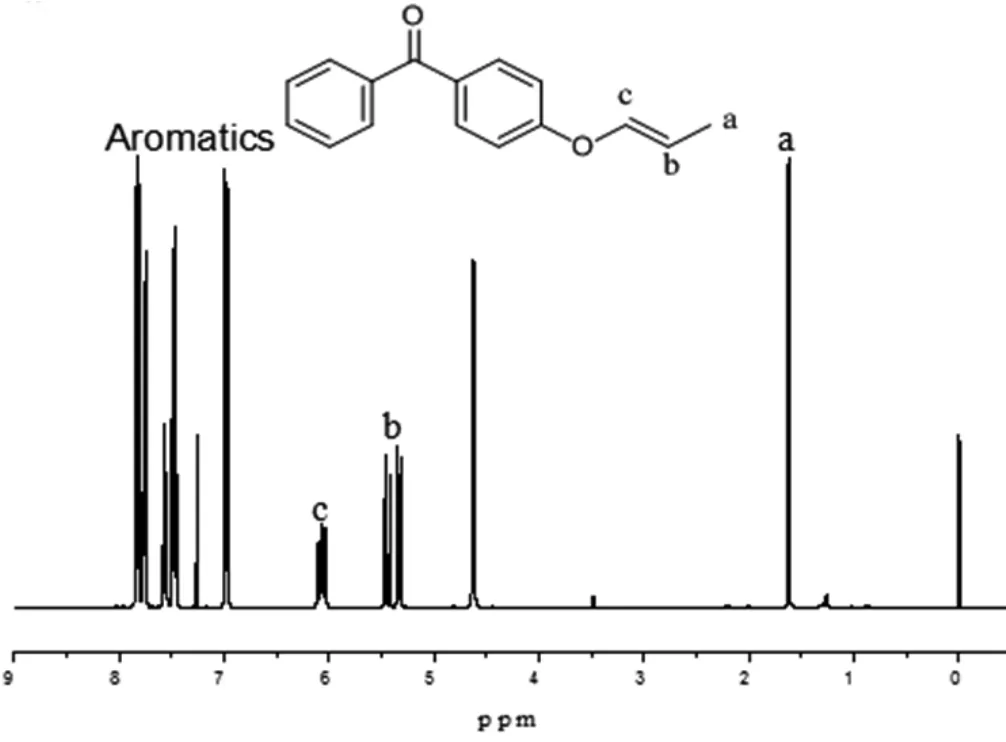
图2 POBP的核磁氢谱图Fig.1 1H-NMR of POBP
图2 是引发剂POBP的1H-NMR图,图中δ=1.624ppm的峰为-CH3上三个H的特征峰;5.463ppm和6.060ppm为-O-CH=CH-上H的特征峰;7.811ppm、7.747ppm、7.565ppm、7.471ppm和6.966ppm是与苯环直接相连的9个H的化学位移。通过1H NMR谱图的积分面积的计算和H原子数目比对后,证明最终得到的产物确实是我们所想要的POBP。
3.2 紫外吸收谱图
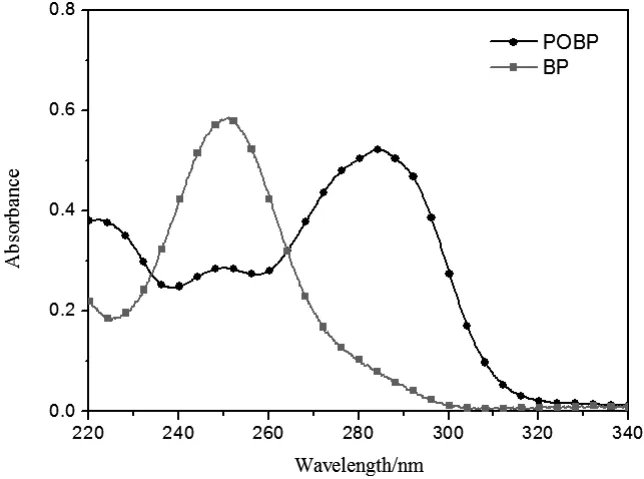
图3 POBP和BP的紫外吸收光谱([POBP]=[BP]=3×10-5mol•L-1)Fig.3 UV absorption spectrums of POBP and BP([POBP]=[BP]=3×10-5mol•L-1)

表1 POBP和BP的最大吸收波长及最大摩尔消光系数Table.1 The wavelength of maximum absorption and maximum molar extinction coefficient of POBP and BP
图3是等摩尔浓度的POBP和BP在乙腈溶液中的紫外吸收曲线。其最大吸收波长(λmax)及最大摩尔消光系数(εmax)列于表1。可以看出,POBP的最大吸收波长较二苯甲酮有明显红移,但最大吸收波长的摩尔消光系数较二苯甲酮略低,从积分面积可以看出POBP在220~320nm波段的光吸收效率比二苯甲酮大的多,这可能是由于苯氧基供电子效应的结果。最大吸收峰红移和高的光吸收效率,使得POBP有高的光引发活性,在紫外光聚合领域具有更大的应用前景。
3.3 紫外光降解

图4 POBP的紫外光降解(I=25mw/cm2,c=4.4×10-5mol•L-1,乙腈为溶剂)Fig.4 UV degradation of POBP(I=25mw/cm2,c=4.4×10-5mol•L-1,Acetonitrile as solvent,nitrogen condition)
图4 是POBP的紫外光降解曲线,发现POBP紫外吸收曲线变化明显,在POBP溶液最大吸收波长284.6nm处,随着光照时间的增加λmax处的吸光度逐渐降低。这是因为光照时间越长,光引发剂分解程度越大,从而在溶剂中的剩余浓度越低,而物质吸光度与该物质在溶液中的浓度成正比,所以吸光度自然也会随着光照时间的增加而降低。
3.4 POBP和BP引发单体光聚合活性对比
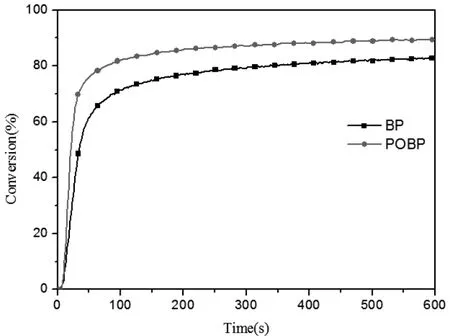
图5 由POBP/EDAB和BP/EDAB引发HDDA聚合的转化率和时间曲线([POBP]=[BP]=1wt%,[EDAB]=0.5wt%,I=25mw/cm2)Fig.5 Conversion versus time of polymerization of HDDA Initiated by POBP/EDAB and BP/EDAB ([POBP]=[BP]=1wt%,[EDAB]=0.5wt%,I=25mw/cm2)
图5 是HDDA在POBP/EDAB引发体系和BP/EDAB引发体系下的聚合反应的转化率-时间曲线。由图可知,在EDAB存在条件下,POBP引发HDDA的最终转化率和聚合反应速率均高于BP。这主要由于POBP的吸光效率高于BP,同一条件照射下能吸收更多光能产生更多的自由基,从而能更快的引发反应,且单体最终的转化率也更高。
3.5 POBP的光聚合动力学
3.5.1 POBP浓度对光聚合的影响
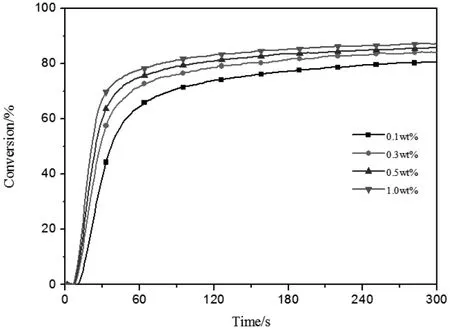
图6 POBP浓度对HDDA光聚合反应的影响([EDAB]=0.5wt%,I=25mw/cm2)Fig.6 Effect of[POBP]on the polymerization of HDDA([EDAB]=0.5wt%,I=25mw/cm2)
图6 是助引发剂浓度和光强一定的条件下,POBP质量分数分别为0.1wt%、0.3wt%、0.5wt%、1wt%时引发HDDA光聚合的双键转化率和光照时间的曲线。由图可知,单体光聚合的诱导时间随引发剂浓度的增大而缩短,聚合速率和最终转化率均随引发剂浓度增大而增大。这是因为相同条件下,引发剂浓度越高能够产生的活性种越多,使得聚合体系抗氧阻聚性能越强,从而诱导期越短。而且,
活性种越多能够更快的引发聚合反应,使反应速率更快。
3.5.2 不同光强对POBP聚合动力学的影响
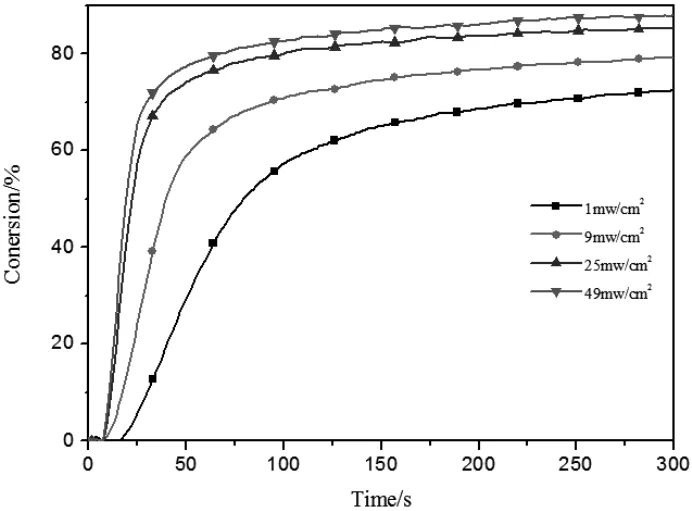
图7 光强对POBP引发HDDA聚合的影响([POBP]=1wt%,[EDAB]=0.5wt%)Fig.7 Effect of light intensity on polymerization of HDDA([POBP]=1wt%,[EDAB]=0.5wt%)
图7 是当POBP浓度为1wt%,EDAB浓度为0.5%时,引发HDDA聚合,
不同光强下转化率和光照时间的关系曲线。光照强度为1mw/cm2时,诱导时间明显较长,约为20s,达到最大转化率的所用时间较长,最终转化率为70%。因为光强较弱,产生的活性自由基数量少,导致光诱导期较长,引发速率较慢,从而延长了到达最大转化率所用时间。与光强为1mw/cm2相比,I=25mw/cm2时,POBP引发HDDA诱导期明显缩短,约为7s,聚合速率和最终转化率都有较大提高,达到最大转化率所用时间约80s,最终转化率达到80%,由此可知光照强度对光聚合反应的进程具有十分重要的影响。当光强较弱时,光引发剂不能吸收足够的能量将其全部转化为活性种引发单体聚合,导致聚合速率和最终转化率较低;当光强变强时,引发剂能够吸收到更多的能量,产生更多的活性种,使得体系诱导期缩短,反应速率和最终转化率明显提高。
3.5.3 POBP对不同单体光聚合动力学的影响
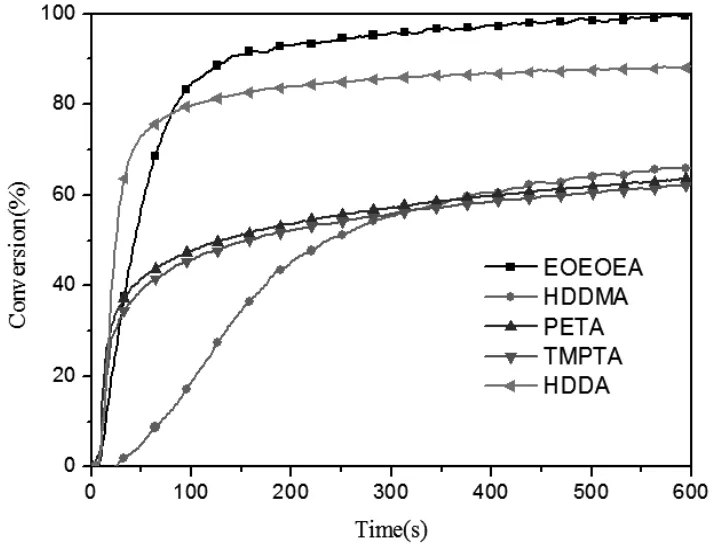
图8 POBP引发不同单体聚合的转化率和时间曲线([POBP]=[EDAB]=0.5wt%,I=25mw/cm2)Fig.8 Conversion versus time of polymerization of different Monomers Initiated by POBP/EDAB ([POBP]=[EDAB]=0.5wt%,I=25mw/cm2)
图8 为相同光强和助引发剂浓度条件下,POBP分别引发几种不同官能度单体聚合的转化率和时间曲线。分别是乙氧基乙氧基丙烯酸酯(EOEOEA)、1,6-己二醇二丙烯酸酯(HDDA)、1,6-己二醇二甲基丙烯酸酯(HDDMA)、季戊四醇三丙烯酸酯(PETA)、三羟甲基丙烷三丙烯酸酯(TMPTA)。从图中可以看出,HDDMA与HDDA虽为同官能度单体,其甲基基团的空间位阻使得其聚合活性不如HDDA,诱导期还较长,但由于其官能度低,粘度小,最终的转化率却高于三官能度的TMPTA和PETA;对于单官能度单体的EOEOEA而言,虽然其同等浓度下双键数量少,最初聚合速率较低,但其最终转化率反而高与多官能度单体;同样说明了高官能度单体虽然聚合速率较快,但体系凝胶化会导致大量活性基团无法参与反应从而降低最终转化率,使单体聚合不完全。
4 结语
本文合成了含有单二苯甲酮光活性基团的光引发剂POBP,通过紫外光谱研究其紫外吸收特性,发现其最大吸收波长较BP有明显红移,且其吸光能力大大增强。POBP较BP能更好的引发HDDA单体聚合,同样说明了POBP有更好的光引发活性。利用实时红外(FT-IR)证明了光引发剂浓度和光强对光聚合反应动力学均有重要的影响。这些性质均表明,POBP在UV光聚合中有着很大的应用前景。
[1]聂俊.光聚合技术与应用[M].北京:化学工业出版社,2008:55.
[2] Davidson S.Exploring the science,technology and application of UV and EB curing.London:SITA Technology Limited,1999.
[3] T.J.Bunning,L.V.Natarajan,V.P.Tondiglia,R.L.Sutherland,Annu.Rev.Mater.Sci.30(2000)83-115.
[4] Kloosterboer J G.Network Formation by Chain Crosslinking Photopolymerization and Its Applications in Electronics[M].Springer Berlin Heidelberg,1988.27-35.
[5] Urabe H,Wakasa K,Yamaki M,Applicaion of multifunctional base monomer to dental composite resins[J].Journal of Materials Science Materials in Medicine,1990,1(3):163-170.
[6] CP Pathak,AS Sawhney,JA Hubbell,Rapid photopolymerization of immunoprotective gels in contact with cells and tissue[M].Journal of American Chemical Society,2002,114(21):8311-8312.
[7] Xu F,Yang J L,Gong Y S,et al.A Fluorinated Photoinitiator for Surface Oxygen Inhibition Resistance[J].Macromolecul es,2012,45:1158-1164.
[8]刘茵,张鹏云,原炳发,刘怀清.紫外光固化涂料的研究进展及发展趋势[J].精细与专用化学品,2011,(09):42-46.
[9]陈用烈,曾兆华,杨建文.辐射固化材料及其应用[M].北京:化学工业出版社,2003.115.
[10]戴明之.二苯甲酮衍生物光引发剂的合成及聚合性能研究[D].北京:北京化工大学硕士论文,2008
[11]梁秋鸿.自由基型有机硅大分子紫外光引发剂的设计、合成及其性能研究[D].湖北:武汉大学博士论文,2014.
[12] Yagci Y,Jockusch S,Turro N J.Photoinitiated polymeri zation:advances,challenges,and opportunities[J].Macromole cules,2010,43(15):6245-6260.
[13] Zhang H Q,Xiao P,Dai M Z,et al.Photopolymerizaiton of 4-aryloylbenzo phenone[J].Imaging Science and Photoche mistry,2008,1(26):32-38.
[14]刘珊珊,柯玮,范子彦.食品接触材料中光引发剂残留及其迁移规律研究进展[J].中国食品卫生杂志,2014,26(5):507-514.
[15] A.Merlin,D.J.Lougnot,J.P.Fouassier.The Benzophenone-Amine Photoinitiator in Vinyl Polymerization[J].Polym.Bull.1980,3,1-6.
[16] C.Carlini,F.Ciardelli,D.Donati,F.Gurzoni.Polymers containing side-chain benzophenone chromophores:a new class of highly efficient polymerization photo initiators[J].Polymer,1983,24,599-606.
[17] G.Temel,B.Enginol,M.Aydin,D.Karaca Balta,N.Arsu.Photopolymerization and photophysical properties of amine linked benzophenone photoinitiator for free radical polymerization[J].Photochemistry and Photobiology A:Chemistry,219(2011)26-31.
[18] N.Zhang,M.Li,J.Nie,F.Sun,J.Mater.Chem.2012,22,9166.
[19] H.Wang,J.Wei,X.Jiang,J.Yin.Highly efficient sulfur-containing polymeric photoinitiators bearing side-chain benzophenone and coinitiator amine for photopolymerization[J].Photochemistry and Photobiology A:Chemistry 186(2007)106-114.
[20] X.Jiang,X.Luo,J.Yin.Polymeric photoinitiators containing in-chain benzophenone and coinitiators amine:Effect of the structure of coinitiator amine on photopolymerization[J].Photochemistry and Photobiology A:Chemistry,174(2005)165-170.
[21] SIGRID JAUK,ROBERT LISKA.Photoinitiators with Functional Groups 9:New Derivatives of Covalently Linked Benzophenone-amine Based Photoinitiators[J].Macromolecular Science,(2008)45,804-810
[22] J.Yang,S.Shi,F.Xu,J.Nie.Synthesis and photopolymerization kinetics of benzophenone sesamol one-component photoinitiator[J].Photochemical& Photobiological Sciences,2013,12,323-329.
[23] Y.Tang,Y.Zhang,J.Yang,J.Nie.Synthesis and Characteristics of Photopolymerized Benzophenone[J].POLYMER SCIENCE,PART A:POLYMER CHEMISTRY 2017,55,313-320.
[24] C.Decker,K.Moussa.Real-Time Kinetic Study of Laser-Induced Polymerization[J].Macromolecul es,22(1989)4455-4462.
Synthesis and photopolymerization properties research of a photoinitiator containing benzophenone
Hao Yajuan1,2,Wang Lei1,2,Nie Jun3*,Yang Jinliang1*.
1.Changzhou Institute of Advanced Materials Research,Beijing University of Chemical Technology,Changzhou 213000,Jiangsu,P.R.China;2.School of Materials Science and Engineering,Beijing University of Chemical Technology,Beijing 100029,P.R.China;3.School of Science,Beijing University of Chemical Technology,Beijing 100029,P.R.China.
This paper used 4-hydroxyphenyl benzophenone and allyl bromide as materials synthesized a photoinitiator containing benzophenone.Its structure was determined by NMR spectroscopy.The absorption and degradation performance of POBP were studied by UV-vis absorption spectra.Real-time infrared spectroscopy(RT-IR)investigated the influence of the concentration of POBP,light intensity and monomer on Polymerization kinetics.The results show that the maximum absorption wavelength of POBP has a notable red shift compared with BP.And its light absorption ability is greatly enhanced,which leads to the double bond conversion of HDDA has an improvement,which also means that POBP is a good photoinitiator.
Photoinitiation;Photoinitiator;Benzophenone
TQ314.241 【文献标识码】A 【文章编号】1009-5624(2018)02-0111-05

