氟吡菌酰胺研究开发综述
徐 英,徐娜娜,庄占兴,主艳飞,左文静,宋化稳
(山东省农药科学研究院 山东省化学农药重点实验室,济南 250033)
氟吡菌酰胺研究开发综述
徐 英,徐娜娜,庄占兴,主艳飞,左文静,宋化稳
(山东省农药科学研究院 山东省化学农药重点实验室,济南 250033)
氟吡菌酰胺是一种新型苯甲酰胺类杀菌剂,通过阻碍呼吸链中琥珀酸脱氢酶的电子转移而抑制线粒体呼吸。该剂可抑制孢子萌发、芽管生长、菌丝体生长及芽孢形成,其在植物木质部中传导及转移,主要用于防治由真菌病原菌引起的灰霉病、白粉病、晚疫病、霜霉病、稻瘟病等。综述了氟吡菌酰胺的发现、理化性质、合成路线、分析方法、杀虫机理、抗药性、应用现状、环境和残留等方面,并对氟吡菌酰胺的开发前景进行了展望。
氟吡菌酰胺;研究开发;展望;综述
1 氟吡菌酰胺的开发背景
氟吡菌酰胺(fluopyram)属于吡啶基乙基苯甲酰胺类新型广谱杀菌剂,由拜耳作物科学公司开发。2003年8月,该公司在我国申请化合物发明专利(专利号:038194716),有效期20年[1]。2012年11月96%氟吡菌酰胺原药和41.7%氟吡菌酰胺悬浮剂在我国获得登记。该剂可用于70多种作物如葡萄、梨果、核果、蔬菜以及大田作物等的多种病害的防治,如灰霉病、白粉病、菌核病、褐腐病[2]。
2 氟吡菌酰胺的理化性质
中文名称:氟吡菌酰胺,英文名称(ISO):fluopyram,CAS No:658066-35-4,化学名称:N-{2-[3-氯-5-(三氟甲基)-2-吡啶基]乙基-a,a,a-邻三氟甲基苯甲酰胺}。化学结构式如下:分子式:C16H11ClF6N2O,分子量:396.71。
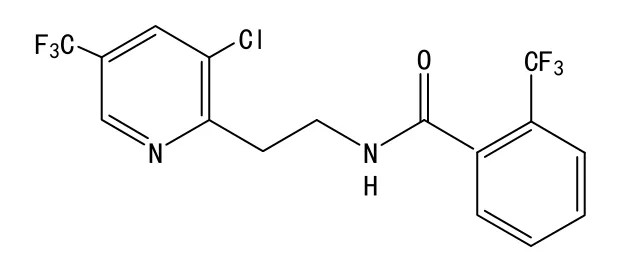
外观:白色粉末;无明显气味;熔点:117.5 ℃;沸点:318~321 ℃;蒸气压:1.2×10-6mPa(20 ℃)、3.1×10-6mPa (25 ℃)、2.9×10-4mPa(50 ℃);正辛醇/水分配系数:logP=3.3(pH 6.5,20℃);亨利常数:2.98×10-3(蒸馏水)、3.17×10-5(pH 4)、2.98×10-5(pH 7)、3.17×10-5(pH 9) (Pa·m3·mol-1,20 ℃);密度:1.53(20 ℃);溶解性:水 16 (蒸馏水)、15 (pH 4)、16 (pH 7)、15 (pH 9)(mg/L,20 ℃),庚烷0.66,甲苯62.2,二氯甲烷、甲醇、丙酮、乙酸乙酯、二甲亚砜均>250(g/L,20 ℃);稳定性:水中稳定,50 ℃下,pH 4、7、9溶液中均稳定;光解DT50为52~97 d;pKa为 0.5 (23 ℃)[2]。
3 氟吡菌酰胺的合成
氟吡菌酰胺的合成路线主要有2条。
路线 1:该路线以邻三氟甲基苯甲酸为原料,经酰化、酰胺化和羟甲基化得到N-羟甲基-2-三氟甲基苯甲酰胺;然后与乙酰氯或乙酸酐酯化得到N-乙酰氧甲基-2-三氟甲基苯甲酰胺;N-乙酰氧甲基-2-三氟甲基苯甲酰胺与 3-氯-5-三氟甲基-2-吡啶丙二酸二乙酯缩合,水解脱羧得到目的产物氟吡菌酰胺。该合成路线较长,且中间产物不易提纯,致使反应产物颜色极深,副产物较多,对后续反应不利。
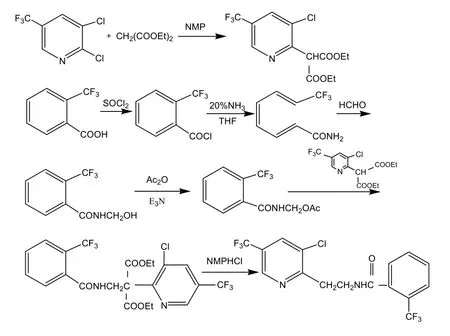
路线2:该路线以2,3-二氯-5-三氟甲基吡啶为原料,与氰基乙酸乙酯缩合,水解脱羧得到2-乙腈基-3-氯-5-三氟甲基吡啶,然后通过加氢、酰胺化反应得到目的产物氟吡菌酰胺。该合成路线短,中间产物和目的产物易提纯,收率也高,适宜工业化生产[3]。

4 氟吡菌酰胺的分析方法进展
4.1 产品分析
胡琴等[4]采用气相色谱法,用HP-5(30 m×0.32 mm×0.25 μm)毛细管柱,以邻苯二甲酸二环己酯为内标物,用氢火焰离子化检测器对氟吡菌酰胺进行定性定量分析。结果表明,该分析方法的线性相关系数为0.999 9,标准偏差为0.25,变异系数为0.60%,平均回收率为99.75%。该方法简便、快速、准确,分离效果好,准确度和精密度均能达到定量分析的要求,适用于产品质量的检测分析。
4.2 残留分析
目前检测样品中的农药残留最常用的仪器有GC、HPLC、气质联用(GC-MS)、液质联用(LC-MS)等。氟吡菌酰胺既可用气相色谱检测,也可用气质联用 (GC-MS)检测。
4.2.1 气相色谱法(GC)
于福利等[5]采用乙腈提取,弗罗里硅土柱固相萃取净化,通过ECD检测器对番茄中的氟吡菌酰胺残留量进行测定。该分析方法的添加回收率为87.0%~99.1%,相对标准偏差为3.5%~4.1%,最低检出质量分数为0.01 mg/kg。
邓曼等[6]采用气相色谱法建立了水果中氟吡菌酰胺残留的分析方法。样品用乙腈匀浆提取,氯化钠和无水硫酸镁盐析后,经N-丙基乙二胺(PSA)分散固相萃取净化,气相色谱-电子捕获检测器(GC-ECD)检测。结果表明:在0.05~1 mg /kg添加水平下,氟吡菌酰胺的平均回收率为83%~116%,相对标准偏差(RSD)为0.7%~13%。氟吡菌酰胺在不同水果样品中的检出限(LOD)为0.01 mg /kg,定量限(LOQ)均为0.05 mg/kg。
4.2.2 气相色谱-串联质谱法(GC-MS/MS)
李文卓等[7]采用气相色谱-串联质谱(GC-MS/MS)技术建立了同时检测7种类型蔬菜中氟吡菌酰胺及其代谢物残留的分析方法。样品采用乙腈提取,无水硫酸镁和氯化钠盐析后,经分散固相萃取(PSA)净化,GC-MS/MS检测。结果表明:在0.01、0.1、1 mg/kg 3个添加水平下,氟吡菌酰胺及其代谢物2-(三氟甲基)苯甲酰胺(BZM)的平均回收率为80%~108%,相对标准偏差(RSD)为1.5%~8.4%。氟吡菌酰胺及其代谢物在7种蔬菜中的检出限(LOD)(S/N=3)分别为2.17~3.13 μg/kg和1.22~2.04 μg/kg,两者的定量限(LOQ)均为0.01 mg/kg。可以满足大部分蔬菜中氟吡菌酰胺及其代谢物的定性与定量分析要求。
侯雪等[8]采用改进的 QuEChERS 气相色谱-串联质谱法建立了检测草莓中21种杀菌剂残留的方法。样品经乙腈提取,采用N-丙基乙二胺(primary secondaryamine,PSA)和石墨化碳黑(graphitized carbon blacks,GCB)作为分散固相萃取(dispersive solid phase extraction,DSPE)的吸附材料,净化液经氮气吹干,用正己烷∶丙酮=9∶1(体积比)混合溶液定容,采用气相色谱-串联质谱(GCMS/MS)测定。结果表明:在0.01、0.05、0.1 mg/kg 添加水平下,氟吡菌酰胺的平均回收率为84%~111%,相对标准偏差(RSD)为3.1%~11.2%。
4.2.3 超高效液相色谱-串联质谱法
Husham NasrEldin Mustafa Hussan[9]采用快速、简单、廉价、有效、可靠、安全的分散固相萃取(QuEChERS)为样品前处理方法,建立了氟吡菌酰胺等 4种杀菌剂在蔬菜(西红柿、豇豆),水果(梨、葡萄、苹果、西瓜)和土壤中超高效液相色谱-串联质谱联用分析方法。样品采用乙腈提取,C18作为吸附剂净化,超高效液相色谱-串联质谱联用测定。多反应检测模式下,3 min内完成了4种目标物的分离。该方法在各个基质中的检出限(LOD)为 0.2~2 μg/kg,定量限(LOQs)为 0.5~7 μg/kg。在 0.01、0.1、1 mg 3个添加水平下,4种杀菌剂在不同基质中的平均回收率为71.7%~116.4%,相对标准偏差为1.3%~20%。氟吡菌酰胺在番茄和土壤中的残留动态表明:氟吡菌酰胺的残留消解动态符合一级动力学方程C=Coek,且决定系数(R2)为 0.976 1~0.999 9。2012-2013年,在山东、河南、北京试验点,氟吡菌酰胺在番茄和土壤中的降解半衰期分别为 7.0~24.5、2.8~13.8、8.9~21.9 d。最终残留浓度分别为 0.12~1.35、1.13~1.53 mg 以及<0.06~1.221 mg。2011-2012 年,在安徽和北京试点,氟吡菌酰胺在西瓜和土壤中的降解半衰期分别为3.1~14.1 d、1.9~8.1 d。最终残留浓度分别为 0.01~0.132 mg,0.01~0.083 mg。
5 氟吡菌酰胺的应用
氟吡菌酰胺可用于防治70多种作物上的病害,其中对核盘菌、灰霉病菌、丛梗孢属病菌和白粉病菌所引起的病害防效优异。国内外目前尚未见黄瓜白粉病菌及其他植物病原菌对该药剂产生抗性的报道[10]。
为了筛选高效、安全的白粉病化学防治药剂,陈彦等[10]进行了田间药效试验,结果表明,氟吡菌酰胺防治甜瓜上白粉病的效果很高,药后7、14 d,防效均高于95%。与之相比较,防治黄瓜上白粉病和草莓上的白粉病效果稍低,其防效也在90%以上。研究表明,氟吡菌酰胺防治白粉病效果良好、持效期长,是防治黄瓜、甜瓜、草莓白粉病的一种新型良好杀菌剂。
刘慧[11]研究了42.8%氟吡菌酰胺·肟菌酯悬浮剂防治草莓炭疽病药效,结果表明:2.8%氟吡菌酰胺·肟菌酯悬浮剂对草莓炭疽病有特效,平均防效为70.61%,可以在草莓生产中广泛应用。
赵志伟等[12]进行了50%氟吡菌酰胺·肟菌酯悬浮剂防治黄瓜白粉病试验,结果表明:50%氟吡菌酰胺·肟菌酯悬浮剂防效优于30%醚菌酯可湿性粉剂,有效成分用量50、75 g/hm2时防效均达到90%以上。
霍建飞等[13]为明确500 g/L氟吡菌酰胺·戊唑醇悬浮剂对黄瓜白粉病的防治效果,对其进行田间药效试验。500 g/L氟吡菌酰胺·戊唑醇悬浮剂有效成分用量25、50、75 g/hm2,第2次药后10 d的防效分别为90.04%、91.12%和93.30%,21 d的防效分别为83.47%、85.64%和87.75%。该制剂防治黄瓜白粉病效果好,持效期长,是防治黄瓜白粉病的一种较好的复配杀菌剂。
聂金泉[14]采用离体叶片法进行了42.8%氟吡菌酰胺·肟菌酯悬浮剂防治番茄灰霉病的试验,结果显示,在推荐剂量下,该剂对番茄灰霉病防效超过80%,能够控制番茄灰霉病的危害。
李云明等[15]以500 g/L氟吡菌酰胺·肟菌酯悬浮剂20 mL/667 m2,在西瓜病害发生初期兑水45 kg进行叶面喷雾后,间隔10 d再喷药一次,对白粉病防效达100%,蔓枯病防效达86.3%,炭疽病防效达84.81%;且对西瓜生长安全,同时还可提高西瓜的品质,可在生产上推广使用。
赵志伟等[16]通过田间试验考察了500 g/L氟吡菌酰胺·肟菌酯悬浮剂对番茄叶霉病的防治效果。结果表明:该制剂对番茄叶霉病具有较好的防治效果,2个处理浓度的防治效果分别达到86.18%和76.77%,均高于对照药剂的59.90%,且对植株生长无不良影响。
芮凯等[17]进行了41.7%氟吡菌酰胺悬浮剂防治香蕉根结线虫病的田间药效试验。结果表明,移栽后30 d和60 d,41.7%氟吡菌酰胺悬浮剂0.04 g/株处理的根结线虫2龄幼虫减退率分别为94.43%和87.04%;0.03 g/株处理60 d后的减退率达83.14%。这表明其不仅对根结线虫2龄幼虫数量具有较好的控制作用,同时也具有较长的持效期。移栽后60 d,其3个剂量处理的根结线虫防效均在65%以上,最高达81.48%,对香蕉根结的形成表现出良好的控制作用,建议使用剂量为0.03~0.04 g/株。
刘润强等[18]采用室内生长速率法研究了氟吡菌酰胺与噁霉灵混配对葡萄霜霉病菌、苹果褐斑病菌、芒果蒂腐病菌、梨树黑星病菌和香蕉黑条叶斑病菌的联合毒力。结果表明,当噁霉灵和氟吡菌酰胺的混配比例为3∶1时,对葡萄霜霉病菌和苹果褐斑病菌的共毒系数分别为200.04和190.71;混配比例为1∶6时,对芒果蒂腐病菌的共毒系数为203.13;混配比例为1∶10时,对梨树黑星病菌的共毒系数为198.07;混配比例为1∶15时,对香蕉黑条叶斑病菌的共毒系数为190.97。这表明噁霉灵和氟吡菌酰胺按适当比例混配对防治5种果树病原菌具有明显的增效作用。
6 氟吡菌酰胺的作用机理及抗药性现状
6.1 氟吡菌酰胺的作用机理
氟吡菌酰胺是一种新型苯甲酰胺类杀菌剂,通过阻碍呼吸链中琥珀酸脱氢酶的电子转移而抑制线粒体呼吸,可抑制病原菌孢子萌发、芽管生长、菌丝体生长及芽孢形成。在植物体内,氟吡菌酰胺可在木质部中传导及转移,主要用于防治由病原真菌引起的灰霉病、白粉病、晚疫病、霜霉病、稻瘟病等[3]。
6.2 氟吡菌酰胺的抗药性现状
张晓柯等[19]采用菌丝生长速率法测定了江苏地区100株草莓灰霉病菌对氟吡菌酰胺的毒力曲线,建立了敏感性基线,并通过交互抗性及相关生物学测定,评价了其潜在的抗性风险。研究结果表明,建立的敏感性基线是一个单峰曲线,接近正态分布,平均EC50为(1.94±1.55) μg/mL;氟吡菌酰胺与同类的啶酰菌胺及其他类型杀菌剂之间不存在交互抗性;氟吡菌酰胺抗性菌株的生物适合度显著低于敏感菌株。因此,草莓灰霉病菌对氟吡菌酰胺的抗性风险属于低至中等水平。
李良孔[20]进行了氟吡菌酰胺抑菌谱的测定,结果表明:氟吡菌酰胺对高等真菌具有广谱的抗菌活性,其中对番茄早疫病菌、黄瓜白粉病菌、人参黑斑病菌、大蒜菌核病菌、黄瓜炭疽病菌、花生褐斑病菌、番茄灰霉病菌、烟草赤星病菌和梨黑斑病菌等有良好的抑制活性,但对卵菌没有活性。采用离体子叶法测定了62株黄瓜白粉病菌对氟吡菌酰胺的敏感性,并建立了敏感性基线。结果表明,氟吡菌酰胺对62个菌株的EC50平均为(0.221 7±0.052 8) μg/mL,其敏感性频率分布呈连续单峰曲线,接近正态分布。因此该敏感性基线可作为监测田间病原菌对氟吡菌酰胺敏感性变化的参考。室内采用药剂继代筛选的方法,共获得了3株抗药性突变体,随着药剂选择压力的增加,抗性出现的速度加快。在这些抗药突变体中,2株为中抗水平,1株为低抗水平,且抗药性均能稳定遗传。室内抗药性风险研究表明:3株抗药性突变体的致病力、适合度与敏感菌株无明显差异,且在有药剂选择压力时抗药性突变体的竞争力明显优于敏感菌株,黄瓜白粉病菌对氟吡菌酰胺具有抗性风险。
7 氟吡菌酰胺的环境行为安全评价
董必章[21]为了探明氟吡菌酰胺在水和土壤环境中的降解行为、转化机理和转化产物的生物毒性,研究了氟吡菌酰胺在实验室条件下水体中的光化学降解机理和土壤中的降解行为以及氟吡菌酰胺和它的光化学转化产物的生物毒性,主要取得如下结果:
⑴ 氟吡菌酰胺在(50±1) ℃,pH 4.0、7.2、9.0和黑暗条件下培养5 d,水解率小于8.1%。依据美国环保署颁布的EPA712-C-08-012,可得出氟吡菌酰胺在25 ℃条件下的水解半衰期大于1年,对水解稳定。因此,在下述光解研究过程中,水解造成的影响可以被忽略。
⑵ 结合LC-QqQ-MS/MS和LC-IT-MS/MS技术的分析结果,氟吡菌酰胺在高压汞灯和氙灯下水环境中主要生成3个光化学转化产物,分别为2,9-二(三氟甲基)-6,7-二氢吡啶[2,3-e] [2]环苯亚胺-8(5H)-萘酮(TPⅠ)、N-[2-(3-羟基-5-三氟甲基-2-吡啶)乙基]-2-三氯甲基苯甲酰胺(TPⅡ)和N-[2-(5-三氟甲基-2-吡啶)乙基]-2-三氯甲基苯甲酰胺(TPⅢ),其中TPⅠ的最高产生量超过20%,TPⅡ约为9%,TPⅢ小于1%。
⑶ 研究了在高压汞灯和氙灯下,Fe(Ⅲ)、Cu(Ⅱ)、NO3、腐殖酸、富里酸和核黄素这几种自然水体组分,pH和TiO2对氟吡菌酰胺光转化的影响。在2种光源下,氟吡菌酰胺在中性条件下较碱性和酸性下光解快,最快可达2倍。
⑷ 建立了氟吡菌酰胺在我国3种典型土壤中的残留分析方法,方法平均添加回收率为97%~105%,相对标准偏差为3.9%~11.6%,最低定量限为0.1 mg/kg,最低检出限为5.0~7.5 μg/L,基质匹配标准曲线相关线性系数大于0.99。用建立的分析方法研究氟吡菌酰胺在土壤中的降解行为,结果表明氟吡菌酰胺在非灭菌条件下在不同土壤含水量和土壤类型中的降解半衰期为55.4~69.3 d,在灭菌条件下不同土壤含水量和土壤类型中的降解半衰期大于1年。这说明所试验土壤类型对氟吡菌酰胺降解影响不显著,微生物降解是氟吡菌酰胺在土壤中降解的主要方式。根据我国农药在土壤中的降解性等级划分标准,氟吡菌酰胺属于较易降解农药。此外,通过对比0、7、30、60 d的色谱图,未发现氟吡菌酰胺在土壤中的主要降解产物。
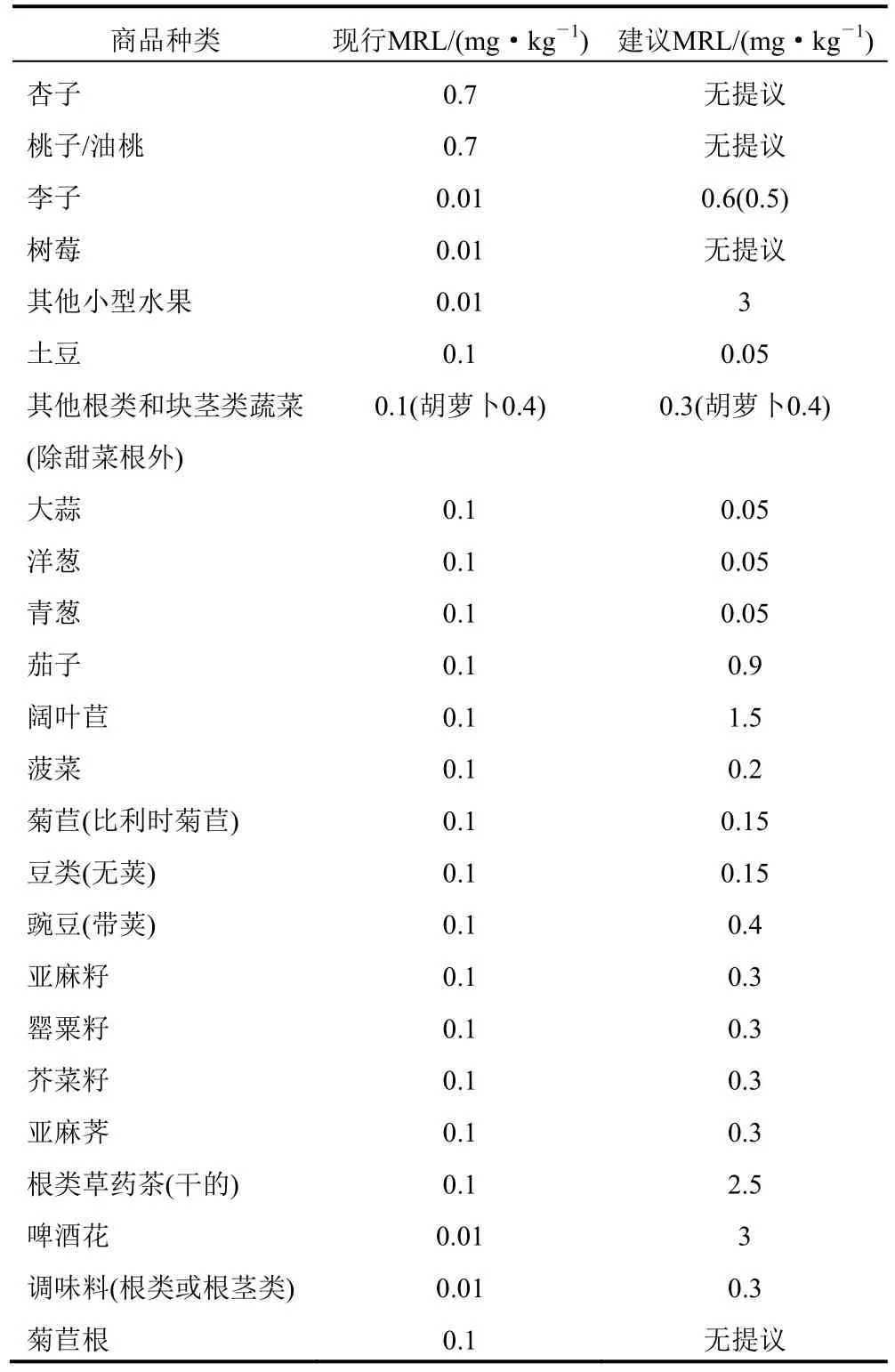
表1 氟吡菌酰胺的最大残留限量修订
8 氟吡菌酰胺的残留
2014年12月12日,欧盟食品安全局(EFSA)就修订多种作物中氟吡菌酰胺的最大残留限量(MRL)[22]。根据风险评估结果,EFSA认为氟吡菌酰胺在多种作物上的使用不会导致消费者接触超出毒理学参考值的氟吡菌酰胺,因此此物质不会危害公众健康。氟吡菌酰胺的最大残留限量具体修订信息见表1。
9 氟吡菌酰胺的发展展望
氟吡菌酰胺是内吸性杀菌剂,具有优异的植物相容性,能被植物吸收并向上传导,其独特的柔性链结构使该产品防效稳定,即使与同类作用机理的杀菌剂也不易产生交互抗性。而且能延长果蔬的货架保鲜期,改善果实的外观和营养品质[23]。氟吡菌酰胺还是新一代优秀的杀线虫剂,它不仅低毒环保,而且高效低用量,使线虫防治迈入“绿色”+“毫升”全新时代,拥有广阔的发展前景[17]。
氟吡菌酰胺是一种具有多功能性的化合物,即杀线虫剂、杀菌剂、种子处理剂、农产品仓储保鲜剂等。但在我国目前仅登记 4个产品,2个分装登记,登记企业均为拜耳作物科学公司,尚无国内农药生产企业登记,因此还需要开展更深入广泛的应用技术研究,进行市场推广。
[1] 周大纲. 新一代优秀杀线虫剂氟吡菌酰胺[J]. 世界农药,2016,38(5): 61-63.
[2] 严智燕. 拜耳公司介绍新型杀菌剂fluopyram[J]. 农药应用与研究,2009,13(5): 46.
[3] 刘安昌,冯佳丽,贺晓璐,等. 新型杀菌剂氟吡菌酰胺的合成[J].农药,2015,54(7): 485-486.
[4] 胡琴,吴进龙,陈铁春. 氟吡菌酰胺500 g/L悬浮剂的气相色谱分析方法研究[J]. 农药科学与管理,2008,29(11): 19-21.
[5] 于福利,付萍萍,王素琴,等. 番茄中氟吡菌酰胺残留量的气相色谱分析[J]. 农药,2016,55(4): 278-279.
[6] 邓曼,曹梦超,王全胜,等. 气相色谱法同时检测水果中氟吡菌酰胺、肟菌唑及其代谢物肟菌酸的残留量[J]. 农药学学报,2013,15(6): 704-707.
[7] 李文卓,钱圆,MATSUMOTO HARUNA,等. 气相色谱-串联质谱检测蔬菜中氟吡菌酰胺及其代谢物残留[J]. 农药学学报,2016,18(6): 759-764.
[8] 侯雪,韩梅,邱世婷,等. 改进的QuEChERS气相色谱-串联质谱法测定草莓中21种杀菌剂残留[J]. 农药学学报 2017,19(1): 46-52.
[9] HUSHAM NASRELDIN MUSTAFA HUSSAN. 氟吡菌酰胺等10农药在中国和苏丹典型农产品和土壤中的残留分析研究[D]. 北京:中国农业科学院,2014.
[10] 陈彦,赵彤华,徐蕾,等. 氟吡菌酰胺防治瓜类及草莓白粉病田间试验[J]. 中国农学通报,2012,28(13): 281-284.
[11] 刘慧. 42.8%氟吡菌酰胺·肟菌酯悬浮剂防治草莓炭疽病药效研究[J]. 现代农业科技,2015,(5): 140-143.
[12] 赵志伟,梁英,孙国臣,等.50%氟吡菌酰胺·肟菌酯悬浮剂防治黄瓜白粉病效果研究[J]. 现代农业科技,2014,(4): 112-115.
[13] 霍建飞,郝永娟,刘春艳,等. 500 g·L-1氟吡菌酰胺·戊唑醇SC防治黄瓜白粉病田间药效试验[J]. 天津农业科学,2015,21(8):144-146.
[14] 聂金泉. 不同杀菌剂对番茄灰霉病的防治效果分析[J]. 南方农业,2016,10(18): 86,88.
[15] 李云明,黄贤夫,冯永斌,等. 氟吡菌酰胺·肟菌酯500g/L悬浮剂防治西瓜病害效果试验[J]. 基层农技推广,2014,(10): 27-29.
[16] 赵志伟,梁英,孙国臣,等. 露娜森防治番茄叶霉病效果试验[J].农业科技与装备,2014,(3): 14-15.
[17] 芮凯,王会芳,符美英,等. 新型药剂氟吡菌酰胺对香蕉根结线虫病的防效[J]. 中国热带农业,2016,(4): 35-37.
[18] 刘润强,王清峻,曹前辉,等. 氟吡菌酰胺与噁霉灵混剂对五种果树病菌的室内毒力测定[J]. 湖北农业科学,2016,(7): 3352-3355.
[19] 张晓柯,韩絮,马薇薇,等. 江苏省草莓灰霉病菌对氟吡菌酰胺敏感性基线的建立及抗性风险评估[J]. 南京农业大学学报,2015,38(5): 810-815.
[20] 李良孔. 黄瓜白粉病菌对氟吡菌酰胺敏感基线的建立及其抗药性风险评估[D]. 吉林: 吉林大学,2011.
[21] 董必章. 新农药氟吡菌酰胺在环境中的转化机理及其转化产物的生物毒性研究[D]. 北京: 北京科技大学,2016.
[22] 郑庆伟. 欧盟拟修订多种作物中氟吡菌酰胺的最大残留限量[J].农药市场信息,2015,(2): 51.
[23] 拜耳作物科学公司(中国)有限公司. 杀菌剂新秀——露娜森[J]. 四川农业科技,2014,(3): 41.
A Review of Research Progress in the Development of Fluopyram
XU Ying,XU Nana,ZHUANG Zhanxing,ZHU Yanfei,ZUO Wenjing,SONG Huwen
(Key Laboratory for Chemical Pesticide of Shandong Province,Shandong Academy of Pesticide Sciences,Jinan 250033,China)
Fluopyram is a novel benzamide fungicide that inhibits mitochondrial respiration by hindering the electron transfer of succinate dehydrogenase in the respiratory chain. It inhibits spore germination,shoot growth,mycelial growth and spore formation,and it can be transmitted and transferred by the xylem of the plant. It is mainly used for the prevention and control of diseases caused by fungal pathogens,such as gray mold,powdery mildew,late blight,downy mildew,rice blast and so on. This paper summarizes the discovery,the physical and chemical properties,synthetic route,analytical method,insecticidal mechanism,resistance,application,safety and residue,and the development prospect of fluopyram.
fluopyram; research and development; progress; review
10.16201/j.cnki.cn31-1827/tq.2017.06.08
TQ455
A
1009-6485(2017)06-0037-05
徐英(1984—),女,山东曲阜人,主要从事室内生物测定和大田药效工作。E-mail:yingzi1044@163.com。
庄占兴(1965—),男,研究员,博士,主要从事农药剂型及应用技术研究工作。E-mail:zhzhx207@126.com。
2017-07-07。

