离子互补型自组装短肽在药物传递系统中应用的研究进展
孟 翠,韦威朋,张坤琴,王玉和,唐富山
(1.遵义医学院 药学院,贵州 遵义 563099;2.遵义医学院附属医院 药剂科,贵州 遵义 563099)
综述
离子互补型自组装短肽在药物传递系统中应用的研究进展
孟 翠1,韦威朋1,张坤琴1,王玉和2,唐富山1
(1.遵义医学院 药学院,贵州 遵义 563099;2.遵义医学院附属医院 药剂科,贵州 遵义 563099)
自组装短肽作为药物传递载体材料开发是生物材料领域近二十余年的一个研究热点。经典的离子互补型自组装短肽由于具有两亲性和自组装特性,可与不同类型的药物相互作用,并在生理条件下形成水凝胶,不同氨基酸序列和肽链长度的自组装短肽可能具有不同的载药和/或缓控释特性,从而使得自组装短肽具有在药物传递系统中应用的潜力。本文重点综述了离子互补型自组装短肽在药物传递领域的应用,介绍了离子互补型自组装短肽与不同水溶性的药物之间的相互作用和给药系统构建的研究进展,讨论了离子互补型自组装短肽载药系统在生物医学中的应用前景。
自组装短肽;水凝胶;药物传递系统
多年来,研究者发现某些多肽能够自组装形成纳米和微米级别的结构,其自组装的性质和组装的形态已有相关研究[1-3]。自组装短肽可以形成多种二级结构,例如α螺旋、β折叠、和无规线圈,它们可以通过非共价超分子相互作用(如静电、氢键、亲水和疏水作用、范德华力、π-π堆叠等)自组装成胶束、纤维、囊泡等[4-7]。
近年来,自组装短肽类生物材料的应用引起了广泛关注,特别是作为纳米材料在生物医药领域表现出相当潜力,得到了该领域相关研究者的肯定。自组装短肽具有合成简单、无毒性、无免疫反应、生物相容性好,可注射等优点[8]。研究表明,自组装短肽能够在生理条件或者改变pH、离子强度、温度或酶催化等条件触发形成水凝胶(含水量达99%)形成过程不需要有毒的交联剂或凝胶剂[9]。合成短肽的氨基酸及其体内降解产物天然氨基酸均无毒,可作为生物材料注射到特定的组织中进行局部治疗[10]。此外,水凝胶的网络状结构使得其能够作为药物载体对药物起到缓释和靶向的作用。目前,自组装短肽已被用于组织工程[11-12]、细胞培养及再生[13-15]、蛋白和抗癌药物运输等各个方面[16-17]。自组装短肽为研究药物的包封与释放提供了一个良好的平台,是纳米生物技术的一个重要组成部分。本文重点对离子互补型自组装短肽在药物传递系统中的应用进行综述。
1 离子互补型自组装短肽的主要类型
目前,研究者已经设计出各种类型的自组装短肽,主要包括环肽、离子互补型短肽、两亲性短肽、芳香性肽、类表面活性肽、淀粉样蛋白肽等,作为药物传递载体的短肽主要有离子互补型自组装短肽、类表面活性肽、淀粉样蛋白肽,研究最多的主要是离子互补型自组装短肽[18],而且以EAK16-II和RAD16-I及其衍生的各种短肽为主。
离子互补型自组装短肽是一类由疏水氨基酸、阳离子氨基酸、阴离子氨基酸交替排列组成的多肽结构。它能在水溶液中自发组装形成特定的纳米纤维,并且包含由非极性氨基酸组成的疏水面和由带电氨基酸组成亲水面[19]。组成短肽的氨基酸可有多种选择性,疏水氨基酸有丙氨酸(A)、亮氨酸(L)、缬氨酸(V)、苯丙氨酸(F),带电氨基酸可有天冬氨酸(N)、谷氨酸(E)、赖氨酸(K)、精氨酸(R)、组氨酸(H)[20]。带电氨基酸的排列也有多种模式,如模式Ⅰ“- + - + - + - +”;模式Ⅱ “- - + + - - + +”;模式Ⅲ“- - - + + +”;模式Ⅳ“- - - - + + + +”。根据氨基酸的排布顺序,肽链自组装的形式也有所不同[21]。常见的离子互补型自组装短肽有EAK16-II、RAD16-I系列。其他从EAK16-II等衍生的离子互补型短肽如P4[22]、P-X8[23]、RGA16[24]等作为药物传递载体也有相关研究和报道。表1所示为部分离子互补型自组装短肽的特征及作为载药系统的相关研究。
表1部分离子互补型自组装短肽的性质特征
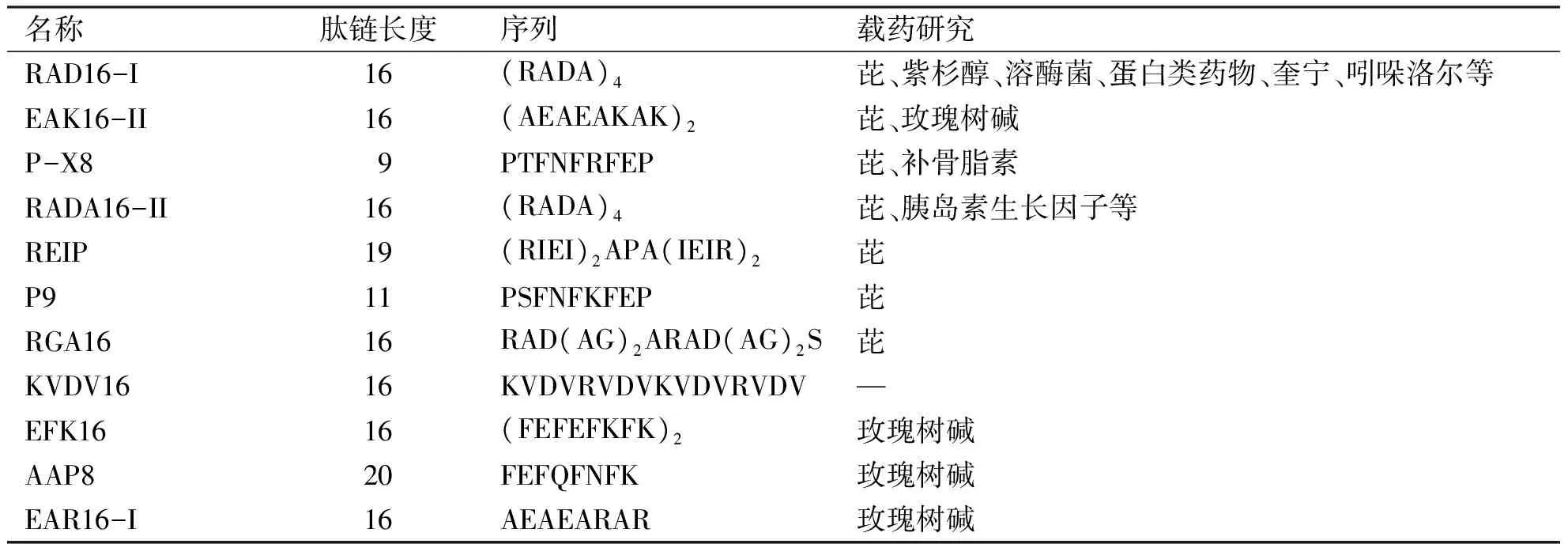
名称肽链长度序列载药研究RAD16-I16(RADA)4芘、紫杉醇、溶酶菌、蛋白类药物、奎宁、吲哚洛尔等EAK16-II16(AEAEAKAK)2芘、玫瑰树碱P-X89PTFNFRFEP芘、补骨脂素RADA16-II16(RADA)4芘、胰岛素生长因子等REIP19(RIEI)2APA(IEIR)2芘P911PSFNFKFEP芘RGA1616RAD(AG)2ARAD(AG)2S芘KVDV1616KVDVRVDVKVDVRVDV—EFK1616(FEFEFKFK)2玫瑰树碱AAP820FEFQFNFK玫瑰树碱EAR16-I16AEAEARAR玫瑰树碱
1.1 EAK16-II 1993年张曙光首次报道了一种来源于Zuotin蛋白质的重复片段EAK16-II,该短肽是由16个氨基酸残基(包括带电的氨基酸E和K与疏水氨基酸A)交替排列组成的,带电氨基酸的排列模式为II型(“- - + + - - + +”),序列为AEAEAKAKAEAEAKAK。由于氨基酸排列的独特性,EAK16-II短肽能通过氢键、离子互补和疏水相互作用自组装成富含纳米纤维的β折叠结构。该二级结构在酸性、碱性、高温以及各种蛋白酶(胰蛋白酶、链霉蛋白酶等)和变性剂(SDS等)条件下均稳定[25]。在水溶液中,EAK16-II自组装使得多肽分子延长从而形成纳米纤维(直径约7~20nm)。在一定的pH或离子强度下,EAK16-II逐渐凝胶化形成水凝胶(含水量达99%)[26]。此外,研究表明,当EAK16-II 用于大鼠、家兔等体内时不产生免疫反应[27]。EAK16-II的特征及优点使得该短肽能够作为疏水药物的载体,不少研究者对EAK16-II的应用进行了深入的研究,特别是其作为药物传递载体的研究[28-30]。
1.2 RAD16-I Zhang等在EAK16-II的基础上,设计了RAD16型自组装短肽,RAD16-I也由16个氨基酸残基(以带正电的氨基酸R和疏水氨基酸A以及带负电的氨基酸D)交替排列形成,带电氨基酸电荷排列模型为I型(“-+-+-+- +”),序列为Ac-RADARADARADARADA-CONH2,在中性pH环境下,精氨酸和天冬氨酸分别带正电和负电,当RAD16-I自组装成具有亲水表面和疏水表面的β折叠结构时,正负电荷形成互补的离子对[31]。RAD16-I能自组装形成有序的纳米纤维(直径约10 nm)并且进一步形成纤维支架(100nm),支架含水量达99%, 类似于天然细胞外基质(Extracellular matrix,ECM)的三维结构,能作为细胞培养支架材料[32-33]。目前RAD16-Ⅰ已经商业化并且用于多种领域的研究,如外科手术快速止血[34]、促进组织再生和重建[11,35-36]、3D细胞培养[26,37]、药物传递[38-39]等。
1.3 其他离子互补型自组装短肽 P-X8是由9个氨基酸残基组成的新型半程电荷匹配的离子互补型短肽,该短肽有一对带电的精氨酸(Arg)和谷氨酸(Glu)残基,其余部分由极性非电荷氨基酸苏氨酸(Thr)和天冬酰胺(Asn)组成,可在纯水中自发组装成有序的纳米纤维[23]。Zhao等合成了离子互补型自组装短肽P9[40]、REIP[41]、RGA16[42]和KVDV16[43], P9是半程电荷匹配的两亲性自组装短肽,由疏水和亲水基团组成,带电赖氨酸和谷氨酸提供电荷[40]。REIP是在RAD16-I结构的基础上,由带正电的精氨酸(Arg)和酸性的谷氨酸(Glu)以及疏水的异亮氨酸(Ile)组成,由于Ile的侧链比Ala更疏水,故该短肽的疏水性较RAD16-I强,与疏水药物也有较强的结合力。RGA16是在EAK16结构的基础上合成的两亲性自组装短肽,由带正电的精氨酸(Arg)和带负电的天冬氨酸(Asp)交替排列组成,这种两亲性短肽能在一定程度上提高GA序列肽在水溶液中的溶解性,为其作为潜在药物载体提供了可能性[41]。KVDV16结构源自RAD16-I,以疏水的缬氨酸(Val)代替RAD16-I中的疏水氨基酸(Ala),然后与亲水性的赖氨酸(Lys)和天冬氨酸(Asp)残基交替排列形成。构建该短肽所用的材料是纯天然的L-氨基酸,在动物体内无免疫反应、无毒性、可降解,降解产物能被生物体利用,能够很好成为理想的疏水药物传递载体。Chen等设计了EFK16[44]、EAR8[45]、AAP8[46]等类似的离子互补型自组装短肽。他们均由疏水氨基酸和亲水氨基酸构成,并且能够作为药物传递载体。
2 离子互补型自组装短肽作为药物传递载体
2.1 离子互补型自组装短肽与水难溶性药物的相互作用 在临床使用的药物中,部分药物因水溶性差导致应用受限,关于难溶性药物相关制剂的开发,目前主要制成纳米释药系统,如脂质体、纳米粒、胶束等。它们虽然可以增加药物的溶解度,提高生物利用度。但部分释药系统通过高分子材料形成,而高分子材料具有生物相容性和生物降解性差等缺点,所以,研究者致力于开发一种既能改善药物溶解性,在体内又有良好生物相容性以及副作用小的药物传输载体。
离子互补型自组装短肽包含一个亲水表面和疏水表面,在分子力的作用下,其疏水面能够与难溶性药物的疏水区域发生相互作用,从而使得药物与短肽粘附,形成短肽-药物的复合物。而自组装短肽的带电残基一端能够在水溶液中稳定疏水化合物。研究发现,许多离子互补型自组装短肽的疏水表面与药物的疏水区结合,能够增强药物在水溶液中的稳定性,具有作为疏水药物载体的潜力。
Chen等研究了EAK16-Ⅱ与水溶性极低的化合物芘和抗癌药物玫瑰树碱的相互作用[47]。EAK16-Ⅱ与芘和玫瑰树碱均能形成胶体混悬液,在混悬液中玫瑰树碱以微晶或质子化的形式存在。芘和玫瑰树碱能从混悬液中释放并转移到脂质体囊泡中,混悬液的形成和芘的转移的速率都可根据短肽的浓度来控制。此外,EAK16-II-玫瑰树碱混悬液比玫瑰树碱水溶液具有更强的抑制肿瘤细胞生长作用[48-50]。EAK16-II作为经典的离子互补型短肽之一是目前研究较多的一类短肽,尤其是其作为药物载体的开发。体内外研究均证明EAK16-II能够作为药物传递载体,相比部分高分子载体材料,其生物相容性和生物可降解性好。EAK16-II的制备简单,但是短肽的合成等原因以至于目前短肽价格的局限性,相关体内研究还需完善。
Tang、Zhao等利用RAD16-I与模型水难溶性药物芘和抗癌药物紫杉醇相互作用。短肽与芘作用后芘被稳定于水溶液中,并且以微晶形式被包载于RAD16-I自组装形成的疏水区域中和非极性微环境中[31,51]。此外,在生理条件下形成的凝胶有一定的粘弹性,能起到缓释药物的作用。与EAK16-II有着相似的结果,芘和紫杉醇都能从混悬液中释放并且进入卵磷脂囊泡,药物的抗肿瘤活性比其单一溶液更强[52]。自组装短肽水凝胶的流变学特性及载药凝胶中药物释放速率等均可通过RAD16-I的浓度调整。Zhao等人还研究了自组装短肽RGA16、REIP 、P9和RAD16-Ⅱ与疏水化合物芘的相互作用,表明该类离子互补型自组装短肽能够作为水难溶性小分子化合物的潜在载体[40-42,53]。RAD16-Ⅰ目前已被商业合成并广泛应用。虽然与构成EAK16-Ⅱ的氨基酸残基不同,但是相当多的研究证明这两种短肽对疏水化合物都有一定的稳定、包裹和释放作用,具有作为水难溶性化合物载体的潜力。但由于研究的局限性,目前对于RAD16-I载药系统的研究大都集中于体外,载药系统在体内的研究较少,同样由于短肽的合成价格作为材料而言相对昂贵,其作为完全现实可用的药物载体还需进行大量后续研究。
在上述经典的离子互补型自组装短肽与水难溶性药物作用的基础上,Chen等设计了其他不同氨基酸组成的短肽。其中包括按照氨基酸配对原则合成的由氢键、离子键、疏水键共同组成的自组装短肽AAP8,以及EAR16-II、EAR8-II、EAR8-IIa及ELR8-IIa,它们与EAK16-II和RAD16-I相似,都能与玫瑰树碱以疏水作用结合,结合的强度、药物的包载和释放量与短肽浓度有关。有所区别的是,AAP8的玫瑰树碱混悬液在水中稀释后药物仍保持稳定,且抗肿瘤活性不变[54]。AAP8在较低的临界胶束浓度下便能稳定玫瑰树碱,并且以中性或微晶型存在,而玫瑰树碱在EAK16-II中则以质子化形式存在,稳定形式有所差异。APP8肽的氨基酸之间以氢键配对,能够减少电荷的形成,使得肽的自组装更稳定。EAR16-II、 EAR8-II、EAR8-IIa及ELR8-IIa是在EAK16-II的基础上分别通过替换氨基酸、缩短氨基酸残基、变换排列模式得到的不同的短肽[30]。但EAR16-II和EAR8-II的载药混悬液对癌细胞的抑制作用较小,且溶血性强,尽管能包载疏水药物,但不适用于作为药物载体及癌症治疗。研究发现,肽链的长度、氨基酸残基的类型、氨基酸的排列模式都能影响药物与短肽的结合能力,从而影响药物的药理作用和细胞特异性。
Wu等用自组装短肽P4肽与玫瑰树碱结合形成混悬液,混悬液能进一步自发形成含水量达99%的水凝胶[22]。P4能稳定玫瑰树碱并且以微晶、中性和质子化的形式存在,相比于微晶型的玫瑰树碱,质子化的玫瑰树碱在混悬液中更容易释放,且能与带负电的细胞膜作用,使其快速的跨越细胞膜,增强对肿瘤细胞的杀伤作用。Kumar在RAD16-I结构的第六个氨基酸残基位置引入一个苯丙氨酸,合成了以π-π键结合的pH依赖性短肽RAD16-F6。RAD16-F6与抗癌药物5-氟尿嘧啶(5-Fu)相互作用,形成的水凝胶比RAD16-I形成的水凝胶释放更规律。在酸性条件下,药物释放较少;在pH 7.8时,药物在某一时间内持续释放,短肽与5-Fu相互作用能将药物保持在肽基质中并持续的释放[55]。RAD16-F6最大的特点就是呈pH依赖性,可以通过调整介质的pH,从而调整药物在体内的释放速率。
总之,离子互补型自组装短肽能在疏水力的作用下包载并缓释药物,药物以质子化、微晶型或中性形式存在。而在不同的短肽中,药物的存在形式不同,可起到不同的包载和释放作用。
2.2 离子互补型自组装短肽与水溶性药物的相互作用 离子互补型自组装短肽带电的另一侧能够与水溶性药物相互作用,作用强度取决于带电氨基酸所带的电荷。目前,RAD16-I被广泛的运用于载水溶性药物。Tang、Zhang、Liu等采用RAD16-I分别载水溶性蛋白类药物溶酶菌[56]、胰蛋白酶抑制剂、牛血清蛋白(BSA)、免疫球蛋白G(IgG)[57]、胰岛素样生长因子1(IGF-1)、酸性成纤维细胞生长因子(aFGF)和血管内皮生长因子(VEGF)等不同性质的蛋白药物[58]。由于短肽带电氨基酸的电荷性,上述蛋白质能够连接于自组装短肽的侧链上,结合后的药物能缓慢的释放,且包封和释放对蛋白质的二、三结构和活性均无改变。药物释放的速率与蛋白质的分子量大小以及所带电荷有关。
自组装肽可能是蛋白质递送的良好候选物,与疏水药物作用不同的是,离子互补型自组装短肽与蛋白质类药物的相互作用与蛋白质所带的电荷有关。药物释放的速率除了取决于短肽的浓度,也取决于蛋白质所带的电荷。短肽与蛋白质之间呈相互吸引作用,药物可以被紧紧吸附于短肽上,当注入体内时,药物从短肽中缓慢的释放出来。但是药物与短肽之间相互排斥,未结合到短肽的结构中,因而能够快速的释放出来。所以,当自组装短肽作为蛋白类药物的传输体系时,应综合考虑短肽和蛋白质的性质,才能充分的利用短肽起到缓释药物的作用。
对于其他非蛋白类水溶性药物,自组装短肽也表现出了缓控释作用,为药物提供包载和释放的能力。Lamproua用自组装短肽RAD16-I载性质不同的三种药物:吲哚洛尔、奎宁、噻吗洛尔。研究发现,药物的释放动力学取决于药物的结构、化学特性(log P、Pka、PI、芳环、空间位阻)和溶剂的选择[59]。RAD16-I或许可以作为一种智能的载体装载水难溶性药物、水溶性药物等各种不同的药物,解决药物传递的问题。
3 展望
离子互补型自组装短肽作为水难溶性药物传递载体首先是基于其两亲性而能够与水难溶性药物发生相互作用,即自组装短肽疏水的一侧能够和药物的疏水区域相互结合,使得水难溶性药物以中性、微晶或质子化的形式存在,从而发挥不同的作用;而自组装短肽亲水一侧则能起到稳定疏水药物的作用。短肽和药物相互作用形成胶体混悬液,比起仅能稳定单体疏水分子的胶束体现更广的应用范围。其次,短肽的自组装能够在疏水化合物的表面形成包裹层,当短肽浓度增加时,形成的包裹层也相应增厚,所以能够对疏水药物产生缓控释的作用。此外,药物包载于短肽中,能够降低药物注入体内直接将药物暴露于组织的机会,从而减少药物的副作用。而离子互补型自组装短肽用于蛋白或其他水溶性药物时,除了肽的氨基酸序列、自组装后的空间结构和浓度都会影响载药体系的形成,药物的物理或化学性质差异也会影响载药系统的构建。所以,为药物载体材料研究而设计不同性质的自组装短肽(例如缩短肽链、替换氨基酸残基等)时,应该充分考虑到不同的短肽与不同药物之间相互作用的差异。
在将来对离子互补型自组装短肽作为药物载体的研究中,应适当扩展研究到其他药物,甚至可以深入研究离子互补型自组装短肽传递基因和细胞。此外,自组装肽的缺点与有限的可用性数据有关,如:虽然尚未报道明显的炎症反应,但尚未进行彻底的免疫学检测;现有的离子互补型自组装短肽作为载药体系研究主要在体外,可能需要适时开展体内研究,使得该载药体系有望真正应用于临床。同时,加强离子互补型自组装短肽的材料学研究,提高材料性能、降低成本费用、切实提高材料作为药物载体开发适用性,仍将是进一步离子互补型自组装短肽作为药物载体的研究所面临的关键挑战。
[1] Accardo A,Tesauro D,Mangiapia G,et al.Nanostructures by self-assembling peptide amphiphile as potential selective drug carriers[J].Peptide Science,2007,88(2):115-121.
[2] Colombo G,Soto P,Gazit E.Peptide self-assembly at the nanoscale:a challenging target for computational and experimental biotechnology[J].Trends in Biotechnology,2007,25(5):211-218.
[3] Wang L,Zhao X J.Investigation of self-assembly structure and properties of a novel designed lego-type peptide with double amphiphilic surfaces[J].Bulletin of the Korean Chemical Society,2010,31(12):3740-3744.
[4] Ruan L,Zhang H,Luo H,et al.Designed amphiphilic peptide forms stable nanoweb,slowly releases encapsulated hydrophobic drug,and accelerates animal hemostasis[J].Proceedings of the National Academy of Sciences,2009,106(13):5105-5110.
[5] Sundar S,Chen Y,Tong Y W.Delivery of therapeutics and molecules using self-assembled peptides[J].Current Medicinal Chemistry,2014,21(22):2469-2479.
[6] Stephanopoulos N,Ortony J H,Stupp S I.Self-assembly for the synthesis of functional biomaterials[J].Acta Materialia,2013,61(3):912-930.
[7] De Santis E,Ryadnov M G.Peptide self-assembly for nanomaterials:the old new kid on the block[J].Chemical Society Reviews,2015,44(22):8288-8300.
[8] Segers V F,Lee R T.Local delivery of proteins and the use of self-assembling peptides[J].Drug Discovery Today,2007,12(13-14):561-568.
[9] Dehsorkhi A,Castelletto V,Hamley I W.Self-assembling amphiphilic peptides[J].Journal of Peptide Science,2014,20(7):453-467.
[10]Koutsopoulos S,Zhang S.Two-layered injectable self-assembling peptide scaffold hydrogels for long-term sustained release of human antibodies[J].Journal of Controlled Release,2012,160(3):451-458.
[11]Wu X,He L,Li W,et al.Functional self-assembling peptide nanofiber hydrogel for peripheral nerve regeneration[J].Regenerative Biomaterials,2017,4(1):21-30.
[12]Eskandari S,Guerin T,Toth I,et al.Recent advances in self-assembled peptides:implications for targeted drug delivery and vaccine engineering[J].Advanced Drug Delivery Reviews,2017,110:169-187.
[13]Liang J,Sun X S,Yang Z,et al.Anticancer drug camptothecin test in 3D hydrogel networks with Hela cells[J].Scientific Reports,2017,7:37626.
[14]Pugliese R,Gelain F.Peptidic biomaterials:from self-assembling to regenerative medicine[J].Trends in Biotechnology,2017,35(2):145-158.
[15]Wang X,Wang J,Guo L,et al.Self-assembling peptide hydrogel scaffolds support stem cell-based hair follicle regeneration[J].Nanomedicine:Nanotechnology,Biology and Medicine,2016,12(7):2115-2125.
[16]Krukiewicz K,Zak J K.Biomaterial-based regional chemotherapy:local anticancer drug delivery to enhance chemotherapy and minimize its side-effects[J].Materials Science and Engineering:C,2016,62:927-942.
[17]Branco M C,Pochan D J,Wagner N J,et al.The effect of protein structure on their controlled release from an injectable peptide hydrogel[J].Biomaterials,2010,31(36):9527-9534.
[18]Liu J,Zhao X.Design of self-assembling peptides and their biomedical applications[J].Nanomedicine,2011,6(9):1621-1643.
[19]Zhang S.Fabrication of novel biomaterials through molecular self-assembly[J].Nature Biotechnology,2003,21(10):1171.
[20]Brea R J,Reiriz C,Granja J R.Towards functional bionanomaterials based on self-assembling cyclic peptide nanotubes[J].Chemical Society Reviews,2010,39(5):1448-1456.
[21]Zhang S.Building from the bottom Up[J].Cheminform,2003,34(40):20-27.
[22]Wu M,Ye Z,Liu Y,et al.Release of hydrophobic anticancer drug from a newly designed self-assembling peptide[J].Molecular Biosystems,2011,7(6):2040-2047.
[23]唐丽丽.两亲性短肽的自组装及其应用基础研究[D].广州:华南理工大学,2012.
[24]Zhou Q,Lin J,Wang J,et al.A designed amphiphilic peptide containing the silk fibroin motif as a potential carrier of hydrophobic drugs[J].Progress in Natural Science,2009,19(11):1529-1536.
[25]Zhang S,Holmes T,Lockshin C,et al.Spontaneous assembly of a self-complementary oligopeptide to form a stable macroscopic membrane[J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(8):3334-3338.
[26]刘子佳,米坤,王贵侠,等.自组装纳米短肽 RADA16-I水凝胶在肿瘤细胞三维培养中的应用[J].中国组织工程研究与临床康复,2009,13(8):1468-1471.
[27]Zhang S,Holmes T C,DiPersio C M,et al.Self-complementary oligopeptide matrices support mammalian cell attachment[J].Biomaterials,1995,16(18):1385-1393.
[28]Wang J,Tang F,Li F,et al.The amphiphilic self-assembling peptide EAK16-I as a potential hydrophobic drug carrier[J].Journal of Nanomaterials,2014,2008(1):145-152.
[29]Pacheco S,Kanou T,Fung S Y,et al.Formulation of hydrophobic therapeutics with self-assembling peptide and amino acid:A new platform for intravenous drug delivery[J].Journal of Controlled Release,2016,239:211-222.
[30]Wan Z,Lu S,Zhao D,et al.Arginine-rich ionic complementary peptides as potential drug carriers:Impact of peptide sequence on size,shape and cell specificity[J].Nanomedicine:Nanotechnology,Biology and Medicine,2016,12(6):1479-1488.
[31]Tang F,Zhao X.Interaction between a self-assembling peptide and hydrophobic compounds[J].Journal of Biomaterials Science,Polymer Edition,2010,21(5):677-690.
[32]Song H,Han Y Z,Cai G H,et al.The effects of self-assembling peptide RADA16 hydrogel on malignant phenotype of human hepatocellular carcinoma cell[J].International Journal of Clinical & Experimental Medicine,2015,8(9):14906-14915.
[33]Yokoi H,Kinoshita T,Zhang S.Dynamic reassembly of peptide RADA16 nanofiber scaffold[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(24):8414-8419.
[34]李佳楠,钟小忠,王 婷.短肽 RADA16-I 自组装纤维长度与止血关系研究[J].江汉大学学报 :自然科学版,2013,41(5):76-80.
[35]吕斐,王松涛,王婷,等.自组装短肽在脊髓急性创伤早期减少细胞凋亡的研究[J].四川动物,2010,29(2):180-183.
[36]Wu H,Zhou T,Tian L,et al.Self-Assembling RADA16-I peptide hydrogel scaffold loaded with tamoxifen for breast reconstruction[J].Biomed Res Int,2017,2017(9):3656193.
[37]Kakiuchi Y,Hirohashi N,Murakami-Murofushi K.The macroscopic structure of RADA16 peptide hydrogel stimulates monocyte/macrophage differentiation in HL60 cells via cholesterol synthesis[J].Biochemical and Biophysical Research Communications,2013,433(3):298-304.
[38]Li R,Pang Z,He H,et al.Drug depot-anchoring hydrogel:A self-assembling scaffold for localized drug release and enhanced stem cell differentiation[J].Journal of Controlled Release,2017,261:234-245.
[39]Koss K,Tsui C,Unsworth L D.Induced neural differentiation of MMP-2 cleaved (RADA) 4 drug delivery systems[J].Journal of Controlled Release,2016,243:204-213.
[40]阮丽萍,张航与,罗涵琳,等.一种新型设计肽作为药物载体的潜在应用研究[J].中国科学:B 辑,2009,39 (5):452-458.
[41]林娟,周庆翰,赵晓军.荧光光谱对自组装多肽作为药物载体的初步研究[J].光谱学与光谱分析,2009,29(10):2792-2797.
[42]Lu Y,Zhao X.Fluorescence studies on a designed peptide of REIP as a potential hydrophobic drug carrier[J].International Journal of Peptide Research and Therapeutics,2011,17(2):81-86.
[43]王顺康,赵晓军.新型纳米自组装短肽 KVDV-16 作为生物支架材料的可行性[J].中国组织工程研究与临床康复,2009,13(16):3011-3015.
[44]Fung S Y,Yang H,Chen P.Sequence effect of self-assembling peptides on the complexation and in vitro delivery of the hydrophobic anticancer drug ellipticine[J].Plos One,2008,3(4):1956.
[45]Sadatmousavi P,Chen P.Self/Co-assembling peptide,EAR8-II,as a potential carrier for a hydrophobic anticancer drug pirarubicin (THP)—characterization and in-vitro delivery[J].International Journal of Molecular Sciences,2013,14(12):23315-23329.
[46]Sadatmousavi P,Mamo T,Chen P.Diethylene glycol functionalized self-assembling peptide nanofibers and their hydrophobic drug delivery potential[J].Acta Biomaterialia,2012,8(9):3241-3250.
[47]Fung S Y,Yang H,Chen P.Formation of colloidal suspension of hydrophobic compounds with an amphiphilic self-assembling peptide[J].Colloids and Surfaces B:Biointerfaces,2007,55(2):200-211.
[48]Wu Y,Sadatmousavi P,Wang R,et al.Self-assembling peptide-based nanoparticles enhance anticancer effect of ellipticine in vitro and in vivo[J].International Journal of Nanomedicine,2012,7:3221-3233.
[49]Fung S Y,Yang H,Bhola P T,et al.Self-assembling peptide as a potential carrier for hydrophobic anticancer drug ellipticine:complexation,release and In vitro delivery[J].Advanced Functional Materials,2009,19(1):74-83.
[50]Lu S,Wang H,Sheng Y,et al.Molecular binding of self-assembling peptide EAK16-II with anticancer agent EPT and its implication in cancer cell inhibition[J].Journal of Controlled Release,2012,160(1):33-40.
[51]唐富山,原凌燕,高冬芳,等.自组装短肽 RAD16-I 在水溶液中对疏水性化合物的稳定作用[J].遵义医学院学报,2015,38(1):92-96.
[52]Liu J,Zhang L,Yang Z,et al.Controlled release of paclitaxel from a self-assembling peptide hydrogel formed in situ and antitumor study in vitro[J].International Journal of Nanomedicine,2011,6:2143-2153.
[53]Li F,Wang J,Tang F,et al.Fluorescence studies on a designed self-assembling peptide of RAD16-II as a potential carrier for hydrophobic drug[J].Journal of Nanoscience and Nanotechnology,2009,9(2):1611-1614.
[54]Fung S Y,Yang H,Sadatmousavi P,et al.Amino acid pairing for de novo design of self-assembling peptides and their drug delivery potential[J].Advanced Functional Materials,2011,21(13):2456-2464.
[55]Ashwanikumar N,Kumar N A,Babu P S S,et al.Self-assembling peptide nanofibers containing phenylalanine for the controlled release of 5-fluorouracil[J].International Journal of Nanomedicine,2016,11:5583-5594.
[56]唐富山,李锋,王竞,等.自组装短肽原位凝胶用作蛋白药物载体的初步研究[J].中国药房,2009,20(7):522-525.
[57]Koutsopoulos S,Unsworth L D,Nagai Y,et al.Controlled release of functional proteins through designer self-assembling peptide nanofiber hydrogel scaffold[J].Proceedings of The National Academy of Sciences,2009,106(12):4623-4628.
[58]刘燕飞,吴敏,刘博,等.自组装短肽水凝胶对功能性蛋白质 IGF-1,aFGF 以及 VEGF 的缓释[J].生物医学工程学杂志,2011,28(2):310-313.
[59]Briuglia M L,Urquhart A J,Lamprou D A.Sustained and controlled release of lipophilic drugs from a self-assembling amphiphilic peptide hydrogel[J].International Journal of Pharmaceutics,2014,474(1):103-111.
[收稿2017-08-12;修回2017-09-20]
(编辑:谭秀荣)
Researchprogressonapplicationofion-complementaryself-assemblingpeptidesindrugdeliverysystems
MengCui1,WeiWeipeng1,ZhangKunqin1,WangYuhe2,TangFushan1
(1.School of Pharmacy,Zunyi Medical University,Zunyi Guizhou 563099,China;2.Department of Pharmacy,First Hospital Affiliated of Zunyi Medical University,Zunyi Guizhou 563099,China)
It has been of great research interest in biomaterial area to develop self-assembling peptides as drug delivery materials in recent two decades.The typical ionic-complementary self-assembling peptides can interact with various types of drugs and form hydrogels under physiological conditions due to their amphiphilic and self-assembly properties.Different peptides with different amino acid sequence and chain length may show different drug loading and/or slow release performance,thus leading to great potential of self-assembling peptides in drug delivery system.This review focused on researches of ion-complementary self-assembling peptides as drug carriers mainly introduced the interaction between ion-complementary self-assembling peptides and hydrophobic or hydrophilic drugs and the drug encapsulation and release performance,and discussed the prospect of ion-complementary self-assembling peptides in further applying to drug delivery systems.
self-assembling peptide;hydrogel;drug delivery system
国家自然科学基金资助项目(NO:31460246);贵州省科学技术基金资助项目(NO:黔科合LH字[2014]7564);NO:黔科合LH字[2015]7481);遵义市“15581人才精英工程”经费资助项目(NO:31460246);遵义市临床药学重点实验室(NO:省市科合(2015)53);遵义科技局联合科研课题(NO:遵市科合社字(2014)96);贵州省药剂学研究生卓越人才培养计划(NO:黔教研合ZYRC字[2014]019)。
王玉和,男,主任药师,硕士生导师,研究方向:临床药学,医院药学,药物经济学,E-mail:1149076068@qq.com;唐富山,男,博士,教授,硕士生导师,研究方向:生物药剂学,医疗机构药事管理,E-mail:fstang@zmc.edu.cn。
R943
A
1000-2715(2017)06-0686-07

