云南藤黄提取物对人结肠癌裸鼠皮下移植瘤的抑制作用及其机制研究
段琳琳 隋华 朱蕾 张莉 谭红胜


摘要 目的:探讨云南藤黄提取物抑制裸鼠大肠癌植性实体瘤的作用机制。方法:建立裸鼠人结肠癌皮下移植瘤模型,随机分为:模型对照组、阳性对照组(5-氟脲嘧啶)、云南藤黄提取物低、中、高剂量组。连续治疗28 d,于末次给药后12 h,剥取肿瘤,称重,计算抑瘤率;并检测肿瘤细胞凋亡情况;免疫组化法检测肿瘤组织中cyclinE1,c-Met和hnRNPK的表达。结果:云南藤黄提取物低、中、高剂量对肿瘤的抑瘤率分别为12.5%、20.83%和29.17%,与空白对照组相比,差异有统计学意义(P<0.01)。肿瘤细胞凋亡率增加,并且随着云南藤黄提取物浓度的增加而增加,具有剂量依赖性(P<0.05)。云南藤黄提取物能明显降低肿瘤组织中cyclinE1,c-Met和hnRNPK的表达,具有剂量依赖性(P<0.01)。结论:云南藤黄具有较好的体内抗肿瘤作用,可能是通过降低cyclinE1,c-Met和hnRNPK的表达,抑制肿瘤细胞在体内增殖。
关键词 云南藤黄;大肠癌;裸鼠;凋亡;cyclinE1;c-Met;hnRNPK
Abstract Objective:To observe the mechanism of garcinia yunnanensis extract on subcutaneously implanted tumor of human colorectal carcinoma in nude mouse.Methods:A nude mouse model of subcutaneously implanted tumor of human colorectal carcinoma was established,and experimental nude mice were randomly divided into 5 groups:model group,positive control group (5-Fluorouracil),and high/middle/low doses of garcinia yunnanensis group.After 28 days of treatment,the tumor was cut to weigh and anti-tumor rate was calculated,and the apoptosis ratio of tumor cells was analyzed.CyclinE1,c-Met,hnRNPK expression level were analyzed by immuno-histochemical method.Results:The experimental results showed that,the anti-tumor rates in low/middle/high doses of garcinia yunnanensis group were 12.5%,20.83% and 29.17%,which were significantly different from the normal control group (P<0.01).The apoptosis rate of tumor cells was increased with the increasing of extract concentration of garcinia yunnanensis,which showed a dose-dependent manner (P<0.05).Garcinia yunnanensis could significantly reduce the expression of cyclinE1,c-Met and hnRNPK with a dose-dependent manner (P<0.01).Conclusion:Garcinia yunnanensis has an obvious anti-tumor effect in vivo,and it may inhibit the proliferation of tumor cells in vivo by reducing the expression of cyclinE1,c-Met and hnRNPK.
Key Words Garcinia yunnanensis; Colorectal cancer; Nude mice; Apoptosis; CyclinE1; C-Met; HnRNPK
中图分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2017.02.035
大肠癌是我国常见的恶性肿瘤之一,发病率和病死率逐年上升[1-2]。目前,大肠癌的治疗多以手术治疗为主,但大多数患者发病时已属晚期,治疗及预后不佳。中医药在防治大肠癌的复发转移及改善患者生存质量方面具有较好的治疗优势[3-4],但临床治疗效果个体差异较大,作用机制和作用靶点仍有待进一步明确。我们前期研究表明云南藤黄及其提取的单体成分具有对大腸癌抗凋亡作用[5],但是云南藤黄抗大肠癌的作用机制仍不明确。因此,我们建立裸鼠人结肠癌皮下移植瘤耐药模型,采用云南藤黄提取物进行治疗,观察其对裸鼠人结肠癌的治疗效果,旨在探讨云南藤黄提取物体内抑制大肠癌的作用机制,为其在临床应用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞株
人肠癌SW620细胞购自上海细胞研究所。
1.1.2 动物
Babl/c/nu代小鼠30只,雄性,体质量(18±2)g,SPF级,购自中科院动物实验中心,合格证编号:SCHK(新)2010-0005。实验前在实验室常规饲养1周。
1.1.3 药物 云南藤黄(Garcinia yunnanensis)采集于中国云南省,由中国科学院西双版纳热带植物园王洪教授鉴定,样品保存在上海中医药大学创新中药实验室。云南藤黄的果皮经剥离粉碎成粗粉,取100 g果皮粗粉,用500 mL 95%乙醇于室温浸泡24 h后,90 ℃加热回流3次,第2次与第3次均为500 mL,每次1 h。合并3次滤液,浓缩至浸膏。实验前定量称取,紫外线照射灭菌,无菌蒸馏水溶解,4 ℃冰箱保存备用。
1.1.4 试剂 5-氟脲嘧啶(5-FU)为上海旭东海普药业有限公司生产(批号:20070802),抗体,四甲基偶氮唑盐MTT购自Sigma公司。
1.2 方法
1.2.1 细胞培养
人肠癌SW620细胞于含10%胎牛血清的L-15培养液(含青霉素、链霉素各100(U/mL)中,37 ℃、5% CO2、饱和湿度培养箱中常规培养。每2~3 d传代1次,取对数生长期细胞用于实验。
1.2.2 模型制备与分组
取对数生长的人肠癌SW620细胞,以5×106/只数量接种于小鼠腋下。7~10 d后形成肿瘤,生长旺盛期的瘤组织剪切成1 mm3左右,在无菌条件下,接种于小鼠右侧腋窝皮下,如此传3代后,大批接种裸鼠腋下,待瘤体生长约100 mm3随机分为5组。
1.2.3 给药方法 每组6只,分别为模型组,阳性对照(5-FU)组,云南藤黄提取物低、中、高剂量联合5-FU组。云南藤黄提取物低2.56 mg/(kg·d)、中5.12 mg/(kg·d)、高10.24 mg/(kg·d)剂量组分别每只灌胃,5-FU组尾静脉注射0.5 mg/(kg·d)的5-FU,模型组每天注射等量的生理盐水,连续给药28 d后,每组中随机取6只荷瘤裸鼠以颈椎脱臼法处死,剥离肿瘤组织,称重,测量肿瘤长、宽及质量。计算抑瘤率:抑瘤率(%)=(对照组平均瘤质量-给药组平均瘤质量)/对照组平均瘤质量×100%。
1.2.4 检测指标与方法 免疫细胞化学法检测Ki-67蛋白的表达水平在LNCaP。
组织采用中性福尔马林4 ℃过夜固定,进行常规的石蜡包埋并切片。表面抗原修复后孵育一抗hnRNPK,cyclinE1和c-Met(1∶500)并在4 ℃过夜;室温放置10 min,孵育二抗30 min后,与HRP生物标志链反应;苏木素染色5~20 min,蒸馏水冲洗2 min,盐酸乙醇分化15 s后蒸馏水冲洗泛蓝5 min;脱水后以中性树脂封片,晾干,置于显微镜下拍照观察。
1.3 统计学方法
采用SPSS 13.0统计软件包处理数据。各组数据采用均数±标准差(±s)表示,两独立样本均数比较,采用Independent-Samples T Test,多样本均数比较采用单因素方差分析,均数间两两比较采用SNK-q检验(Student-Newman-Keuls法),求出组间差异。以P<0.05为有统计学意义,P<0.01为有显著统计学意义。
2 结果
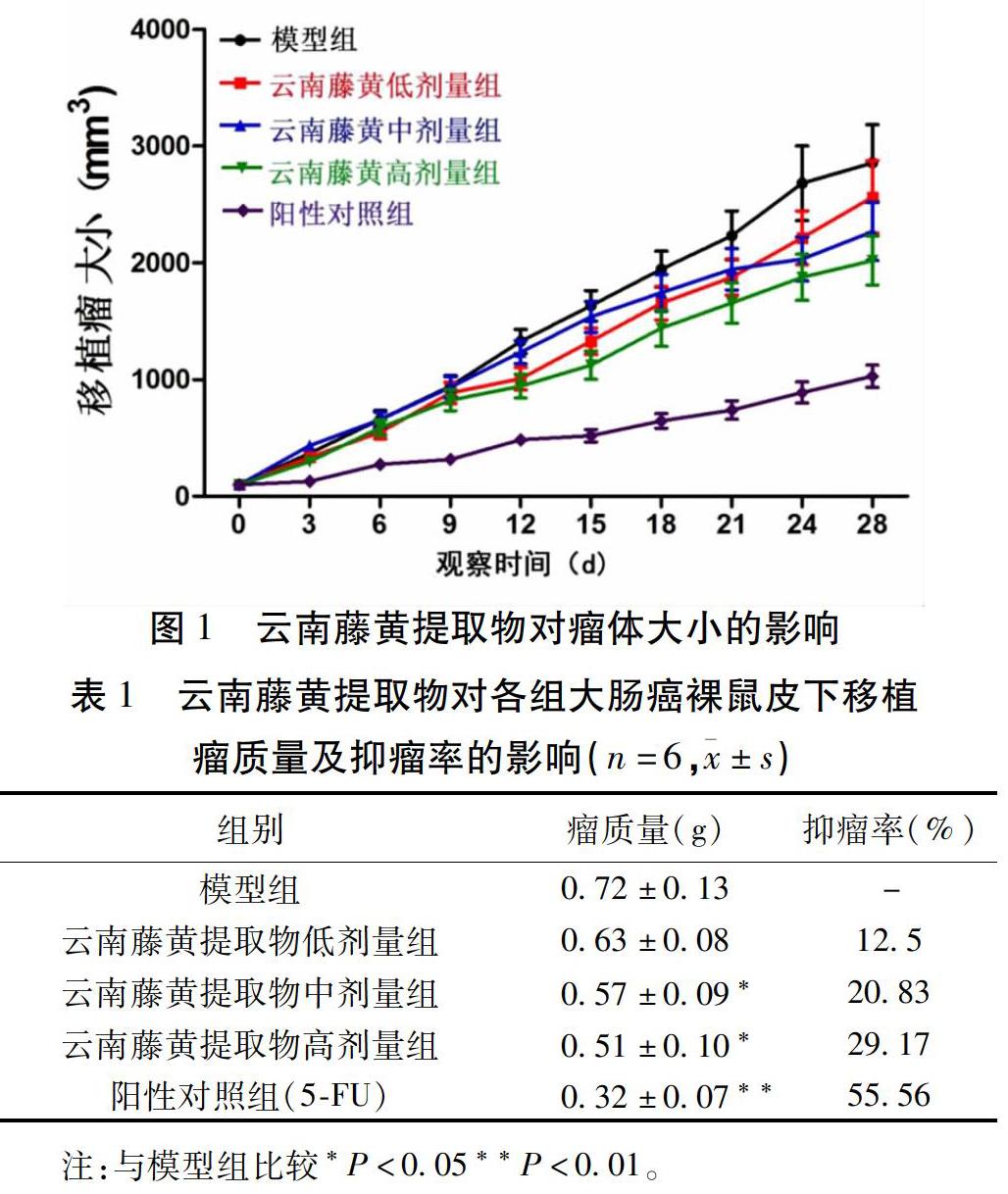
2.1 云南藤黄提取物对大肠癌HCT-116细胞裸鼠移植瘤生长情况的影响
给药前用游标卡尺测量给药前各组小鼠肿瘤体积大小,各组之间差异无统计学意义(P>0.05)。给药1周各组瘤体差别不明显,进食饮水如常,随给药时间延长,各组瘤体大小逐渐出现差距,在用药24 d开始,各组瘤体体积差异有统计学意义。其中,阳性对照组和云南藤黄提取物高剂量组的瘤体体积相比,有明显的缩小,差异有统计学意义(P<0.01)。但是云南藤黄提取物各剂量组对肿瘤的抑制作用不如阳性对照组。提示云南藤黄提取物可以抑制裸鼠肠癌皮下移植瘤的生长,且呈剂量依赖性。
2.2 云南藤黄提取物对大肠癌裸鼠皮下移植瘤抑制率的影响
依表1可见,云南藤黄提取物各个剂量组和5-FU组的皮下移植瘤质量均低于模型对照组(P<0.05),5-FU组的抑瘤率最高,云南藤黄提取物剂量组随云南藤黄取物剂量的升高,抑瘤率逐渐升高,呈剂量依賴性。
2.3 云南藤黄提取物对大肠癌裸鼠移植瘤组织中细胞凋亡的影响
TUNEL检测显示:与模型组相比,阳性对照组中肠癌组织细胞凋亡率最高(P<0.01);云南藤黄提取物剂量组肿瘤组织中肠癌组织细胞凋亡率明显高于模型组(P<0.05)。见图2、图3。图2结果显示,云南藤黄提取物治疗的裸鼠,其肿瘤内凋亡的细胞明显增加(P<0.01);云南藤黄提取物低、中、高剂量组与阳性对照组(5-FU)相比凋亡细胞均明显减少,且具有剂量依赖性,云南藤黄提取物低剂量组与高剂量组相比,差异有统计学意义(P<0.05)。
2.4 云南藤黄提取物对裸鼠移植瘤组织细胞内cyclinE1,c-Met和hnRNPK的影响
治疗后,模型对照组肿瘤组织中cyclinE1,c-Met和hnRNPK的表达阳性率均高于治疗组(P<0.05),阳性对照组中hnRNPK,cyclinE1和c-Met的表达与模型对照组无统计学意义,提示5-FU对大肠癌SW620裸鼠皮下移植瘤的抑制作用可能与hnRNPK,cyclinE1和c-Met无关。但是与对照组相比,云南藤黄提取物各剂量组的hnRNPK,cyclinE1和c-Met的表达明显低于模型对照组,且成剂量依赖性(P<0.05),提示云南藤黄提取物能够降低大肠癌SW620裸鼠皮下移植瘤组织内cyclinE1,c-Met和hnRNPK的表达。结果见图4、表2、表3、表4。
3 讨论
目前,在多种肿瘤中均可发现细胞周期素E(CyclinE)的基因扩增和蛋白表达失调,CyclinE的异常表达可促进肿瘤的发展,该基因已经被证实是一种癌基因[6]。有报道称,CyclinE的过度表达与大肠癌的恶性程度和预后密切相关[7];抑制CyclinE的表达可以通过抑制细胞周期在G1-S期限制点的转化,阻滞细胞周期,控制肿瘤发生发展[8]。
原癌基因c-Met属于具有酪氨酸激酶活性的生长因子受体类,编码肝细胞生长因子(Hepatocyte Growth Factor,HGF)受体,它参与细胞信息传导、细胞骨架重排的调控,是细胞增殖、分化和运动的重要因素[9,10]。目前研究表明,c-Met基因在大肠癌组织中的表达明显高于大肠腺瘤组织和正常大肠黏膜组织,且与肿瘤的浸润深度、Dukes分期、淋巴转移及远处转移密切相关,提示c-Met的过度表达在大肠腺瘤发展至大肠腺癌的过程中可能发挥一定作用[11]。
hnRNPs是存在于细胞核中,由30多个蛋白质小分子组成的一种RNA结合蛋白族[12]。在调节转录、前体mRNA剪切、mRNA输出和降解等方面起着重要的作用[13]。hnRNPK是该家族中的一员,与多种癌基因及生长因子有密切的关系[14]。课题组前期研究发现:从中国藤黄属植物怒江藤黄(Garcinia nujiangensis C.Y.Wu et Y.H.Li)中分离的化合物Nujiangexanthone A(NJXA)通过下调宫颈癌细胞HeLa中hnRNPK和CyclinE的表达,从而抑制肿瘤细胞的合成、死亡以及细胞周期的改变[15]。云南藤黄为其同属植物,且已证实云南藤黄及其提取的单体成分具有对大肠癌抗凋亡作用[5],其单体成分Oblongifolin C对c-Met蛋白激酶具有较好的抑制活性[16],但对大肠癌体内的研究目前尚未开展,因此本实验旨在探索云南藤黄对大肠癌裸鼠实体瘤的抑制效果以及具体的作用机制。
云南藤黄(Garcinia yunnanensis Hu)为中国藤黄属植物,又名小姑娘果,是我国特有种,分布于云南省西南部,生于海拔1 300~1 600 m丘陵、坡地的杂木林中。其果实成熟后味酸甜,当地民族喜食用[17]。现代研究表明,云南藤黄所含化合物具有抗肿瘤和抗炎活性[18-19]。近年来,本课题组对云南藤黄进行了系统的抗肿瘤活性成分研究,提取并發现了多个具有显著抗肿瘤活性的化合物。体外实验表明,云南藤黄中的有效成分对多种肿瘤细胞具有抗癌活性,包括人肝癌细胞(HepG2细胞)、人结肠癌细胞株(HCT116细胞)、人乳腺癌细胞株(MCF-7)以及小鼠胚胎成纤维细胞(MEF)[20-27]。本研究旨在建立大肠癌裸鼠皮下移植瘤动物模型的基础上,探讨云南藤黄对大肠癌的抑制效果及其作用机制。
本实验结果显示,模型对照组与治疗组在裸鼠体重、生活质量方面无明显差异。治疗前3周,模型对照组与云南藤黄各剂量组瘤体大小差异不明显,无统计学意义。进入第4周后,随给药时间延长,各组瘤体大小逐渐出现差距,在用药28 d时,云南藤黄各组呈现剂量依赖性的抑制肿瘤的生长(P<0.01)。该结果与课题组前期的体外实验结果一致,说明云南藤黄能够抑制人大肠癌肿瘤细胞的生长。TUNEL结果显示,云南藤黄对裸鼠肿瘤细胞的凋亡也具有抑制作用,且成剂量依赖性。此外,本研究结果还显示,大肠癌SW620裸鼠皮下移植瘤组织内cyclinE1,c-Met和hnRNPK的表达较高,给予云南藤黄治疗后,其表达明显下降(P<0.01)。提示云南藤黄抑制大肠癌的生长可能与调节cyclinE1,c-Met和hnRNPK三者相关。说明云南藤黄可能是通过下降cyclinE1,c-Met和hnRNPK等蛋白的表达抑制大肠癌的生长。
综上所述,本研究在前期证实云南藤黄及其有效成分具有抗肿瘤的基础上,发现云南藤黄提取物可以抑制人肠癌皮下移植瘤的生长,增加肿瘤抑制率,诱导肿瘤细胞凋亡。并且,以剂量依赖的方式降低cyclinE1,c-Met和hnRNPK蛋白的表达。因此,明确云南藤黄在人肠癌中的作用及具体机制,将是我们今后需要深入研究的方向,鉴于其来源于植物,在当地具有可食用、不良反应小的临床使用价值。后期研究云南藤黄抗肿瘤活性的靶向性将是我们进一步需要深入探讨的课题。
参考文献
[1]O′Keefe SJ.Diet,microorganisms and their metabolites,and colon cancer[J].Nat Rev Gastroenterol Hepatol,2016,13(12):691-706.
[2]Punt CJ,Koopman M,Vermeulen L.From tumour heterogeneity to advances in precision treatment of colorectal cancer[J].Nat Rev Clin Oncol,2016,doi:10.1038/nrclinonc.2016:171.
[3]Sui H,Zhu H R,Wu J,et al.Effects of Jianpi Jiedu Recipe on reversion of P-glycoprotein-mediated multidrug resistance through COX-2 pathway in colorectal cancer[J].Chin J Integr Med,2014,20(8):610-617.
[4]Sui H,Pan SF,Feng Y,et al.Zuo Jin Wan reverses P-gp-mediated drug-resistance by inhibiting activation of the PI3K/Akt/NF-κB pathway[J].BMC Complem Altern M,2014,14:279.
[5]Li H,Meng XX,Zhang L,et al.Oblongifolin C and guttiferone K extracted from Garcinia yunnanensis fruit synergistically induce apoptosis in human colorectal cancer cells in vitro[J].Acta Pharmacol Sin,2016,38(2):252-263.
[6]张百蕾,武栋成.NIRF蛋白和CyclinE在细胞周期调控及肿瘤发生中的作用[J].中国肿瘤,2008,17(5):402-406.
[7]杨宏梅,郑美珍,刘云鹏.COX-2、CyclinE的表达与大肠癌临床病理因素关系的研究[J].临床肿瘤学杂志,2006,11(7):499-501.
[8]Wang Y,Yu H,Zhang J,et al.Hesperidin inhibits HeLa cell proliferation through apoptosis mediated by endoplasmic reticulum stress pathways and cell cycle arrest[J].BMC Cancer,2015,15:682.
[9]Shali H,Ahmadi M,Kafil HS,et al.IGF1R and c-met as therapeutic targets for colorectal cancer[J].Biomed Pharmacother,2016,82:528-536.
[10]Zhang J,Jiang X,Jiang Y,et al.Recent advances in the development of dual VEGFR and c-Met small molecule inhibitors as anticancer drugs[J].Eur J Med Chem,2016,108:495-504.
[11]姜英俊,孔心涓,张可爽,等.c-Met在大肠癌中的表达及在大肠癌发生发展中的作用[J].山东大学学报:医学版,2011,49(5):90-93.
[12]Geuens T,Bouhy D,Timmerman V.The hnRNP family:insights into their role in health and disease[J].Hum Genet,2016,135(8):851-867.
[13]Barboro P,Ferrari N,Balbi C.Emerging roles of heterogeneous nuclear ribonucleoprotein K(hnRNPK)in cancer progression[J].Cancer Lett,2014,352(2):152-159.
[14]Ciarlo M,Benelli R,Barbieri O,et al.Regulation of neuroendocrine differentiation by AKT/hnRNPK/AR/β-catenin signaling in prostate cancer cells[J].Int J Cancer,2012,131(3):582-590
[15]Zhang L,Feng J,Kong S,et al.Nujiangexathone A,a novel compound from Garcinia nujiangensis,suppresses cervical cancer growth by targeting hnRNPK[J].Cancer Lett,2016,380(2):447-456.
[16]Wang L,Wu R,Fu W,et al,Synthesis and biological evaluation of Oblongifolin C derivatives as c-Met inhibitors[J].Bioorgan Med Chem,2016,24(18):4120-4128
[17]中国科学院昆明植物研究所.云南植物志[M].北京:科学出版社,2006.
[18]付文卫,谭红勝,徐宏喜.中国产藤黄属植物中抗肿瘤活性化学成分的研究概况[J].药学学报,2014,49(2):166-174.
[19]Lv Y,Cai S,Tan H,et al,Inhibitory effect of oblongifolin C on allergic inflammation through the suppression of mast cell activation[J].Mol Cell Biochem,2015,406(1/2):263-271
[20]Xu G,Feng C,Zhou Y,et al.Bioassay and ultraperformance liquid chromatography/mass spectrometry guided isolation of apoptosis-inducing benzophenones and xanthone from the pericarp of Garcinia yunnanensis Hu[J].J Agr Food Chem,2008,56(23):11144-11150.
[21]Wang X,Lao Y,Xu N,et al.Oblongifolin C inhibits metastasis by up-regulating keratin 18 and tubulins[J].Sci Rep,2015,5:10293
[22]Shen K,Xi Z,Xie J,et al.Guttiferone K suppresses cell motility and metastasis of hepatocellular carcinoma by restoring aberrantly reduced profilin 1[J].Oncotarget,2016,7(35):56650-56663.
[23]Xu W,Cheng M,Lao Y,et al.DNA damage and ER stress contribute to oblongifolin C-induced cell killing in Bax/Bak-deficient cells[J].Biochem Biophys Res Commun,2015,457(3):300-306.
[24]Lao Y,Wan G,Liu Z,et al.The natural compound oblongifolin C inhibits autophagic flux and enhances antitumor efficacy of nutrient deprivation[J].Autophagy,2014,10(5):736-749.
[25]Wu M,Lao Y,Xu N,et al.Guttiferone K induces autophagy and sensitizes cancer cells to nutrient stress-induced cell death[J].Phytomedicine,2015,22(10):902-910.
[26]Feng C,Zhou L Y,Yu T,et al.A new anticancer compound,oblongifolin C,inhibits tumor growth and promotes apoptosis in HeLa cells through Bax activation[J].Int J Cancer,2012,131(6):1445-1454.
[27]Xi Z,Yao M,Li Y,et al.Guttiferone K impedes cell cycle re-entry of quiescent prostate cancer cells via stabilization of FBXW7 and subsequent c-MYC degradation[J].Cell Death Dis,2016,7(6):e2252.

