丹红注射液对动脉粥样硬化小鼠主动脉斑块的干预作用及基因组DNA甲基化水平和甲基化转移酶的影响
张颖 周明学 李思耐 任攀 刘卫红 尚菊菊 刘红旭


摘要 目的:研究丹紅注射液对高脂喂养的ApoE基因敲除(ApoE-/-)小鼠动脉粥样硬化(As)斑块的干预作用及基因组DNA甲基化水平和DNA甲基化转移酶(DNMTs)的影响。方法:将40只8周龄雄性ApoE-/-小鼠高脂饲料喂养6周后随机分为模型组、阿托伐他汀钙片(商品名:立普妥)(阳性对照组)、丹红注射液低剂量组和高剂量组(n=10),给予药物腹腔注射6周后。检测其血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平。行HE染色,图像分析测量小鼠主动脉As斑块面积。采用高效液相色谱(HPLC)法检测小鼠血清基因组甲基化水平,采用ELISA法检测各组小鼠血清DNMTs水平。免疫组化染色,图像分析测量小鼠主动脉As斑块内DNMT1的表达。结果:与模型组相比,丹红注射液高剂量和低剂量组小鼠血清TG水平明显降低(P<0.01)、丹红注射液高剂量组LDL-C水平明显降低(P<0.01),丹红注射液低剂量组HDL-C水平明显升高(P<0.05),丹红注射液高剂量组小鼠动脉粥样硬化指数显著降低(P<0.01)。丹红注射液高剂量和低剂量组小鼠血清基因组甲基化和DNMTs水平显著降低(P<0.01)。丹红注射液与模型组相比,丹红注射液组As小鼠的校正后主动脉As斑块面积显著降低,以及斑块内DNMT1表达显著降低(P<0.01)。结论:丹红注射液可降低As小鼠血脂水平,减少As斑块面积,其机制可能与降低As小鼠血清基因组甲基化水平和整体DNMTs水平和抑制As小鼠主动脉斑块DNMT1表达有关。
关键词 动脉粥样硬化;丹红注射液;DNA甲基化;血脂异常;DNA甲基化转移酶1
Abstract Objective:To study the effects of Danhong Injection on atherosclerotic plaque and the levels of the global genomic DNA methylation and DNMTs in ApoE knockout (ApoE-/-) mice fed with a high fat diet.Methods:Forty 8 week-old male ApoE-/-mice were fed with a high fat diet for 6 weeks were randomly divided into the control group,the Lipitor (positive control group),the Danhong injection low-dose group (DHI-L group),and the Danhong injection high-dose group (DHI-H group),then were intraperitoneally injected corresponding medicine for 6 weeks,n=10.The levels of total cholesterol (TC),triglyceride (TG),low density lipoprotein cholesterol (LDL-C),and high density lipoprotein cholesterol (HDL-C) in serum were detected.HE staining was used to measure the area of As plaque of mice.Immuno-histochemical staining and image analysis were used to measure the expressions of DNMT1 in the Atherosclerosis (As) plaques of mice.Results:Compared with the control group,the TG levels in serum of the mice in the DHI-L group and DHI-H group were significantly decreased (P<0.01),and the LDL-C levels on DHI-H group were significantly decreased (P<0.01).Besides,the HDL-C levels in DHI-L group were significantly increased (P<0.05).The atherosclerosis indexes of the mice in DHI-H group were significantly decreased (P<0.01).The levels of global genomic DNA methylation and the DNMTs in serum of the mice on the DHI-L group and DHI-H group were significantly decreased (P<0.01).Compared with the control group,the atherosclerotic plaque areas of the mice on the DHI-L group and DHI-H group were significantly reduced (P<0.01),and the expressions of DNMT1 on the DHI-L group and DHI-H group were significantly reduced (P<0.01).Conclusion:Danhong Injection can reduce the blood lipid level and the plaque area of As mice.The mechanism can be related to the reduction of levels of global genomic DNA methylation and the DNMTs in serum and the inhibition of DNMT1 expression in the aortic plaques of As mice.
Key Words Atherosclerosis; Danhong injection; Dyslipidemia; DNA methyltransferase 1; Peroxisome proliferator activated receptor gamma
中图分类号:R285;R543.1+2;R242文献标识码:Adoi:10.3969/j.issn.1673-7202.2017.02.003
丹红注射液主要由活血化瘀中药丹参和红花组成,具有活血和血、通脉舒络的作用。临床上广泛应用于动脉粥样硬化(As)性心脑血管疾病的治疗,具有抗炎、抗血栓、调节血脂、抗凋亡和神经保护等药理作用。新近研究表明,As性心脑血管疾病的发生发展与DNA甲基化为代表的表观遗传学机制密切相关[1],而DNA甲基化是参与As形成发展的重要机制[2]。但目前从表观遗传学角度研究丹红注射液干预As及其相关心脑血管病的研究尚未见报道。新近研究表明,巨噬细胞中的DNA甲基化转移酶1(DNMT1)被抑制可调控小鼠的慢性炎性反应和As的进展[3]。因此,本研究以高脂喂养的ApoE-/-小鼠为观察对象,探讨丹红注射液对高脂喂养的ApoE基因敲除(ApoE-/-)小鼠As斑块的干预作用,并通过检测斑块内DNMT1的表达,来研究丹红注射液抗As的可能DNA甲基化机制。
1 材料与方法
1.1 材料
1.1.1 动物 6~8周龄ApoE-/-小鼠(品系C57BL/6J),8周龄,体重18~20 g,购自北京维通利华实验技术有限公司,40只,高脂饲养6周。
1.1.2 药物 阿托伐他汀钙片(商品名:立普妥),购买于上海辉瑞制药公司,批号H20051408。丹红注射液,商品名倍通,批号16071028,购买于山东丹红制药有限公司。
1.1.3 试剂与仪器 血清总胆固醇(TC)检测试剂盒(批号7007210506)、血清三酰甘油(TG)检测试剂盒(批号7006210506)、血清低密度脂蛋白胆固醇(LDL-C)检测试剂盒(批号7021220605)、血清高密度脂蛋白胆固醇(HDL-C)检测试剂盒(批号7020210506),均购自英科新创(厦门)科技有限公司。小鼠血清DNA甲基化转移酶(DNMTs)检测试剂盒购于美国R&D公司(CK-E433652M)。DNMT1抗体(货号ab13537)购自Abcam公司。血生化指标检测采用日本奥林巴斯株式会社全自动生化仪(AU480)。美国Image-ProPlus Version 5.0(IPP)图像分析软件。
1.2 方法
1.2.1 分组与模型制备 所有小鼠随机分为模型组、阿托伐他汀钙片(商品名:立普妥))组(阳性对照组)3.34 mg/kg、丹红注射液高剂量组6 mL/kg,和丹红注射液低剂量组3 mL/kg,n=10。
1.2.2 给药方法 丹红注射液高剂量和低剂量分别选取临床常用剂量和临床常用剂量的1/2,并按成人与小鼠的给药剂量换算系数折算成小鼠用量灌胃给药[4],1次/d,灌胃给药6周。模型组给予等量的生理盐水。高脂饲料配方为脂肪21%(wt/wt)、胆固醇0.15%的西方类型膳食饲料[5]。喂养12周。各组动物在喂养12周后,颈椎脱臼法处死,眶下静脉丛取血,保留血清,无菌条件下取心脏,心脏用4%多聚甲醛固定。
1.2.3 检测指标与方法 1)血脂检测:采用氧化酶法和直接法检测丹红注射液对高脂喂养12周ApoE-/-小鼠血清TC、TG、LDL-C和HDL-C水平。动脉粥样硬化指数(atherosclerosis index,AI)=(TC-HDL-C)/HDL-C。2)基因組DNA甲基化水平检测:采用高效液相色谱法(HPLC)法检测茶饮料对高脂喂养12周ApoE-/-小鼠血清DNA甲基化水平。3)整体DNA甲基化转移酶水平检测:采用ELISA法检测茶饮料对高脂喂养12周ApoE-/-小鼠血清DNA甲基化转移酶(DNMTs)水平的影响。4)组织病理:a.小鼠心底部横断面连续切片,每隔50 μm连续取6张切片,切片厚5 μm。按Suzuki等[6]确立的方法,主动脉根部以主动脉瓣为标志选取4个切面,分别为:升主动脉最近端横截面,切面形态呈圆形;主动脉瓣起始横截面;主动脉瓣附着部位,并有冠状动脉开口;主动脉瓣完全出现并汇合在一起。我们在实验中统一选取第四切面,分别进行病理HE染色。b.IPP图像软件分析测量小鼠主动脉As斑块面积,具体如下:测量管腔面积(Lumen Area,LA,mm2)、内弹力膜围绕面积(Internal Elastic Laminal Area.IELa,mm2),并计算斑块面积、校正后斑块面积。公式换算如下:斑块面积(Plaque Area,PA,mm2)=IELa-LA;校正后斑块面积=PA/IELa。5)免疫组化法检测:免疫组化染色选取第三切面,采用两步法测定斑块内DNMT1蛋白表达(抗体稀释度为1∶100),每组均以PBS代替一抗作为阴性对照,在100倍镜下每张切片选取5个不同的视野,对阳性区域累积面积进行定量测定,最后求取斑块内阳性区域面积占斑块面积的百分比。
1.3 统计学方法 应用SPSS 11.5软件对数据进行统计分析。计量资料采用(±s)形式表示,组间比较在方差齐时用方差分析,两两比较用t检验。以P<0.05为差异有统计学意义,以P<0.01为差异有极显著统计学意义。
2 结果
2.1 小鼠主动脉粥样硬化模型的复制 高脂喂养12周后,ApoE-/-小鼠主动脉出现典型的As斑块,主动脉管壁上可观察到典型的富含胆固醇结晶的As斑块,斑块有成熟的纤维帽覆盖(图1B,黑箭头所示),说明复制小鼠As模型成功。
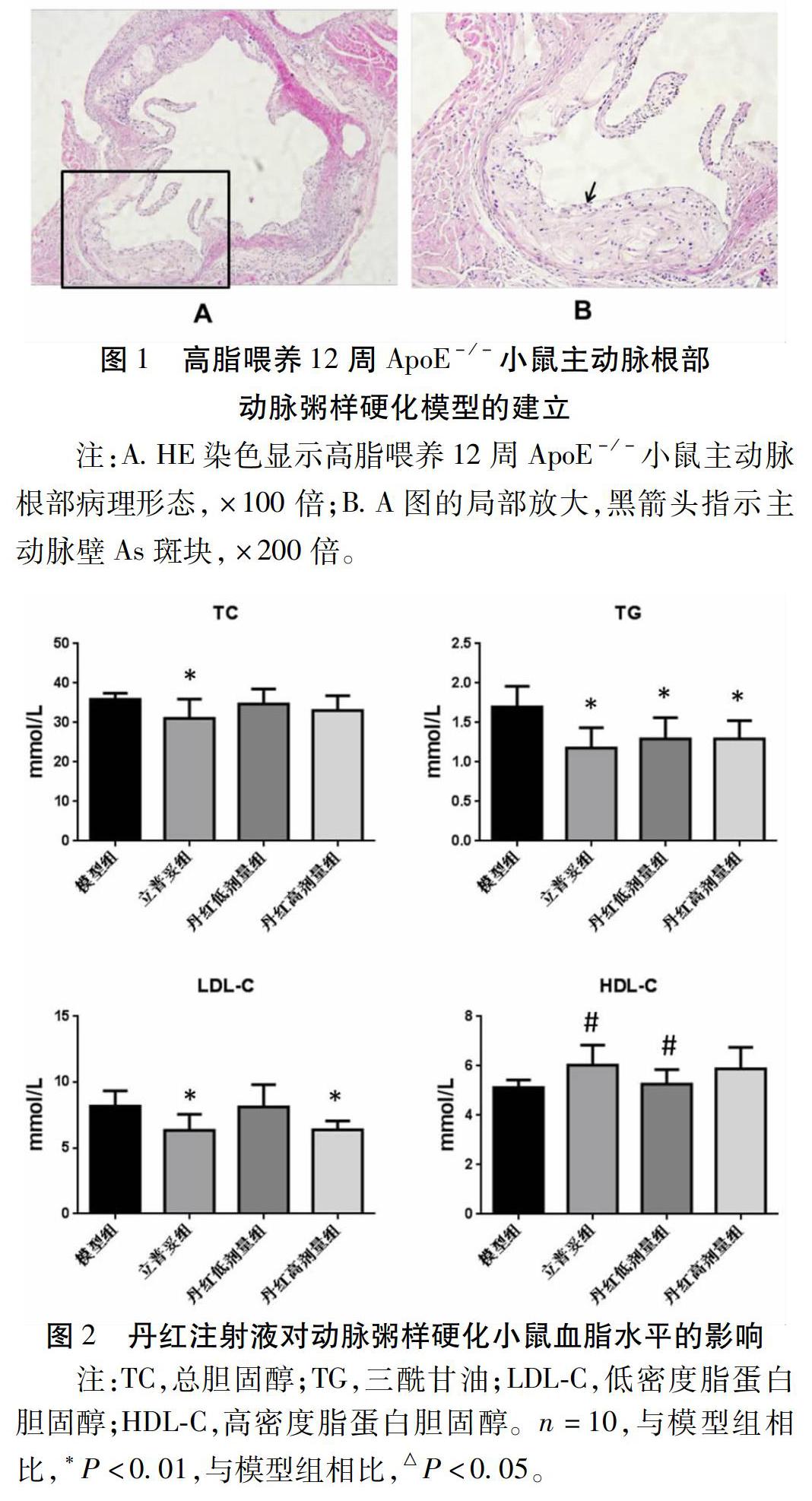
2.2 丹红注射液对高脂喂养12周ApoE-/-小鼠血脂和动脉粥样硬化指数的影响 如图2和图3所示,与模型组相比,丹红注射液高剂量和低剂量组小鼠血清TG水平明显降低(P<0.01)、丹红注射液高剂量组LDL-C水平明显降低(P<0.01),丹红注射液低剂量组HDL-C水平明显升高(P<0.05),和丹红注射液高剂量组小鼠动脉粥样硬化指数(atherosclerosis index,AI)显著降低(P<0.01),与阳性对照阿托伐他汀钙片(商品名:立普妥)组相比,丹红注射液高剂量和低剂量组小鼠血脂各指标和AI均无统计学意义(P>0.05)。
2.3 丹红注射液对高脂喂养12周ApoE-/-小鼠校正后主动脉斑块面积的影响 药物干预6周后,经HE染色和IPP图像软件分析结果显示:与模型组相比,丹红注射液高、低剂量组和阿托伐他汀钙片(商品名:立普妥)组小鼠的校正后主动脉As斑块面积均显著降低(P<0.01),两给药组之间无统计学意义(P>0.05)(图4)。
2.4 丹红注射液对高脂喂养12周ApoE-/-小鼠血清基因组DNA甲基化水平和DNMTs表达的影响 药物干预6周后,处死采血后经HPLC法检测小鼠血清DNA甲基化水平和采用ELISA法检测血清DNMTs水平。结果显示:与模型组相比,阿托伐他汀钙片(商品名:立普妥)组和丹红注射液组小鼠血清DNA甲基化和DNMTs水平显著降低(P<0.01),与阳性对照药
2.5 丹红注射液对高脂喂养12周ApoE-/-小鼠主动脉斑块内DNMT1表达的影响 药物干预6周后,经免疫组化染色和IPP图像软件分析结果显示:与模型组相比,阿托伐他汀钙片(商品名:立普妥)组和丹红注射液低剂量、高剂量组小鼠主动脉As斑块DNMT1表达显著降低(P<0.01),两给药组之间无统计学意义(P>0.05)(图6)。
3 讨论
丹红注射液临床上广泛应用于动脉粥样硬化(As)性心脑血管疾病的治疗,具有抗炎、抗血栓、调节血脂、抗凋亡和神经保护等药理作用。新近研究发现DNA甲基化是导致As和脂代谢紊乱发生发展的重要机制[7]。本实验发现,丹红注射液可降低血脂和动脉粥样硬化指数(AI),减小As斑块面积,其机制可能与降低主动脉斑块内DNMT1表达有关。
我们的研究结果同样发现,丹红注射液可在不同程度上改善高脂饮食喂养的ApoE-/-小鼠的血脂水平,并且明显降低AI。此外,病理实验结果表明,丹红注射液可明显降低As小鼠的主动脉斑块面积,与既往研究结果相一致[8]。
As是一种由多个基因及环境因素相互作用所致的常见复杂性疾病,其发病机制根本在于一系列基因的功能或表达水平的改变。现有研究表明,DNA甲基化异常是As发生发展的重要机制。Sharma等[9]用队列研究的方法研究了137例造影证实的冠心病患者和150例健康人外周血淋巴细胞的基因组甲基化水平,发现冠心病患者淋巴细胞基因组甲基化水平明显高于健康人。Zaina等[10]高通量微阵序列技术比较了人主动脉粥样硬化组织和正常主动脉组织所有的基因甲基化水平,发现粥样硬化组织许多基因位点呈高甲基化水平,并给出了粥样硬化组织高甲基化基因位点图谱。我们的研究结果显示,经HPLC法检测,丹红注射液可显著降低As小鼠血清基因组DNA甲基化水平,经ELISA法检测,丹红注射液可显著降低As小鼠血清DNMTs水平,说明干预DNA甲基化可能是丹红注射液抗As的作用机制之一。
DNA甲基化包括从头甲基化和维持甲基化2种类型。催化和维持甲基化的酶被称为甲基化转移酶(DNMT),主要包括DNMT1,DNMT2,DNMT3三种。DNMT1的作用主要是在DNA复制时维持甲基化[11]。DNMT3可以分為DNMT3A,DNMT3B和DNMT3L三种,DNMT3A和DNMT3B的作用主要是介导DNA的从头甲基化[12]。基因新近研究表明,巨噬细胞中的DNMT1被抑制可调控小鼠的慢性炎性反应和As的进展[3]。本研究结果显示,丹红注射液可明显抑制高脂喂养12周的ApoE-/-小鼠主动脉As斑块内DNMT1的表达,说明DNMT1可能是丹红注射液抗As甲基化机制的重要靶点。
综上所述,丹红注射液可明显降低As小鼠血脂水平,减少As斑块面积,发挥抗As作用,其机制可能与降低As小鼠血清基因组甲基化水平和整体DNMTs水平和抑制As小鼠主动脉斑块DNMT1表达有关。
参考文献
[1]惠红,陈文佳,尹新华.DNA甲基化修饰在心血管疾病中的研究进展[J].心脏杂志,2013,25(6):722-725.
[2]谭剑凯,谭小进,王佐.DNA甲基化与动脉粥样硬化[J].中国生物化学与分子生物学报,2014,11(2):132-136.
[3]Jie Y,Qiu Y,Jie Y,et al.DNMT1-PPARγ pathway in macrophages regulates chronic inflammation and atherosclerosis development in mice[J].Scientific Reports,2016:6.
[4]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:202-204.
[5]Yang X R,Wat E,Wang Y P,et al.Effect of Dietary Cocoa Tea(Camellia ptilophylla)Supplementation on High-Fat Diet-Induced Obesity,Hepatic Steatosis,and Hyperlipidemia in Mice[J].Evidence-based complementary and alternative medicine:eCAM,2013,2013(3):243-243.
[6]Suzuki H,Kurihara Y,Takeya M,et al.A role for macrophage scavenger receptors in atherosclerosis and susceptibility to infection[J].Nature,1997,386(6622):292-296.
[7]陈婕,王肖龙.DNA甲基化对动脉粥样硬化影响的研究进展[J].中西医结合心脑血管病杂志,2015,15(10):1177-1179.
[8]Chen Y,Liu M,Zhao T,et al.Danhong injection inhibits the development of atherosclerosis in both Apoe-/- and Ldlr-/- mice[J].Journal of Cardiovascular Pharmacology,2014,63(5):441-452.
[9]Granger A,Abdullah I,Huebner F,et al.Histone deacetylase inhibition reduces myocardial ischemia-reperfusion injury in mice[J].Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology,2008,22(10):3549-3560.
[10]Zaina S,Heyn H,Carmona F J,et al.DNA methylation map of human atherosclerosis[J].Circulation Cardiovascular Genetics,2014,7(5):692-700.
[11]Svedruic M.Dnmt1 structure and function[J].Progress in Molecular Biology & Translational Science,2011,101(101):221-254.
[12]Chédin F.The DNMT3 family of mammalian de novo DNA methyltransferases[J].Progress in Molecular Biology & Translational Science,2011,101:255-285.

