补肾活血中药对SD大鼠慢性高眼压模型初级视皮质PI3K/AKt通路凋亡相关因子BAX及BCL-2的影响
刘红佶 李翔 李祥玉 李华宏 杨凤娇 田梦瑶 王泰
补肾活血中药对SD大鼠慢性高眼压模型初级视皮质PI3K/AKt通路凋亡相关因子BAX及BCL-2的影响
刘红佶 李翔 李祥玉 李华宏 杨凤娇 田梦瑶 王泰
目的观察补肾活血中药对SD大鼠慢性高眼压(elevated intraocular pressure,EIOP)模型初级视皮质(primary visual cortex,PVC)B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)、B细胞淋巴瘤/白血病-2相关x基因(bcl-associated X protein,Bax)的干预作用,探讨其作用机理。方法30只SD大鼠随机分为3组(对照组、给药组、模型组)。模型组和给药组采用烙闭上巩膜静脉法建立SD大鼠慢性EIOP模型,连续灌胃8周后处死大鼠,予TONO-PEN笔式眼压计测量大鼠眼压、免疫组化检测PVC Bcl-2、Bax蛋白表达及电镜下观察PVC神经元细胞超微结构。结果给药组与模型组大鼠眼压在造模后即刻直至造模后8周与造模前相比均升高,说明慢性EIOP模型造模成功;造模后8周眼压与造模后即刻相比,给药组有降低趋势,模型组无明显变化。免疫组化检测显示给药组Bcl-2蛋白阳性表达最多,其总面积、积分光密度及平均黑度较对照组差异无统计学意义;模型组Bcl-2蛋白表达最少,总面积、积分光密度及平均黑度较对照组及给药组低。模型组Bax蛋白阳性表达最多,其总面积、积分光密度及平均黑度较给药组与对照组高,给药组与对照组无明显差别。给药组PVC超微结构较模型组明显改善。结论补肾活血中药(杞菊地黄丸合复方丹参片)能促进EIOP SD大鼠初级视皮质神经元损伤的修复,其机制可能通过作用于PI3K/AKt通路,增强Bcl-2表达、下调Bax表达、改善神经元细胞超微结构及降低眼压有关。
青光眼; 视功能保护; 初级视皮质; Bcl-2; Bax; 补肾活血中药(杞菊地黄丸合复方丹参片)
青光眼是目前世界第二位的不可逆性致盲眼病,其发病率和致盲率均在不断上升。在我国,目前至少有500万名青光眼患者,其中双目失明患者有79万人,占盲人总数的50%[1,2]。2013年,全球40~80岁的青光眼患者约为6430万,预计2020年将增加到7600万,而2040年将增加到1亿1180万[3]。既往认为视网膜神经节细胞(retinal ganglion cells,RGCs)丢失是导致青光眼视功能损害主要原因,新近研究表明青光眼是自RGCs到PVC整个视路均存在形态和功能改变的神经退行性病变[4,5]。因此,青光眼视功能保护研究应深入到视神经颅内段更广阔的范畴。
PVC是视觉的最高中枢,青光眼患者尸检证明与活体影像学表明青光眼病程及严重程度与PVC损害呈正相关关系[6,7],但中医中药的干预除我们前期研究外无相关报道[8,9]。本实验采用烙闭上巩膜静脉法[10]制作眼压稳定、持久的SD大鼠EIOP模型,通过观察补肾活血中药(杞菊地黄丸合复方丹参片)对慢性EIOP模型SD大鼠眼压、PVC Bcl-2、Bax表达及神经元细胞超微结构的影响,探讨其保护视功能的作用机理,为临床应用提供实验依据。
1 材料
1.1 动物及实验分组
标准1级8~12周龄SD大鼠30只(雌雄不拘,体重约160~200g,大鼠及饲料均由成都中医药大学实验动物中心提供。纳入标准:①无外眼疾病;②双眼瞳孔直接对光反射和间接对光反射正常;③无歪颈)。SD大鼠购回后,适应性喂养3天,进行眼压测量,正常眼压区间估计,取平均眼压在9~18mmHg者,随机分为对照组、模型组、给药组。
1.2 药物及试剂
复方丹参片、杞菊地黄丸(北京同仁堂科技发展股份有限公司制药厂);Bax抗体、Bcl-2抗体(武汉博士德生物工程有限公司);3%戊巴比妥钠(上海化学试剂厂);0.25%氯霉素眼液(天津市万嘉制药有限公司);75%消毒酒精(成都市蓉康医疗保健实业有限公司);碘伏(杭州杨驰医疗用品有限公司);0.5%盐酸丙美卡因滴眼液(Alcon公司);0.5%盐酸金霉素眼膏(芜湖三亿信成制药有限公司);3%戊二醛组织固定液(成都中医药大学病理教研室);FAA固定液(成都中医药大学附属医院病理科)。
2 方法
2.1 模型建立
模型组和给药组进行单眼(右眼)造模,左眼不做处理。方法如下:(1)0.25%氯霉素眼液滴右眼3天,每日2次;(2)75%酒精浸泡消毒器械备用,予1.5ml/kg麻醉量给大鼠腹腔注射3%戊巴比妥钠;(3)固定大鼠,予碘伏棉签在眼睑及其周围消毒3次,0.25%氯霉素滴眼液冲洗术眼结膜囊,用0.5%盐酸丙美卡因滴眼液行术眼表面麻醉,铺巾;(4)在眼科显微镜下进行以下操作:拉开术眼眼睑,暴露角膜上方球结膜,距上方角巩膜缘约1~2mm处剪开球结膜,分离筋膜后可在角巩膜缘后3~4mm见到4~5只暗红色、粗大的树枝状血管,压迫血管,可见近角膜缘段血管明显怒张,而远角膜缘段血管却血流消失;(5)选择位于10点、12点和1点处血管,并使用眼科手术止血器对其进行烙闭(烙闭成功标志:血管立即收缩,远端血流中断);(6)术后用生理盐水冲洗术眼结膜囊,整复球结膜,涂盐酸金霉素眼膏于术眼预防感染,注意保暖,待大鼠麻醉恢复之后送回笼子。造模后,予术眼滴用0.25%氯霉素眼液2次/日,盐酸金霉素眼膏1次/晚,连续使用5天。该造模方法应用于模型组与给药组,而对照组仅仅打开结膜囊未行烧灼上巩膜静脉处理,为假烙闭,余操作相同。因为灌胃、麻醉等原因导致8只大鼠死亡。
2.2 给药方法
每日16:00~18:00给大鼠灌胃1次,连续8周,方法如下:模型组及对照组每日予3ml生理盐水灌胃;给药组每日予(0.96g/kg体重的复方丹参片、3.0g原生药/kg体重的杞菊地黄丸)3ml混悬液灌胃,相当于20倍成人剂量,每2周称体重1次,据体重调整给药量。
2.3 IOP测量
造模前,连续测量3天IOP,取平均值作为正常IOP,造模后即刻、2w、4w、6w、8w各测1次IOP。IOP测量时间为2:00 pm~5:00 pm,待测眼盐酸丙美卡因滴眼液表面麻醉后,用TONO-PEN笔式眼压计测量,每回连测3次,取平均值作为该次测定的眼压值。
2.4 免疫组化检测
给药8周后用颈椎脱臼法处死大鼠,开颅完整剥离脑组织,立即放入复合固定液中,同时将该固定液注入大脑纵裂中部。固定72小时后,参照《大鼠脑立体定位图谱》[11],取左侧枕叶17区脑组织(PVC),标本逐级酒精脱水,二甲苯透明,石蜡包埋,做10μm连续切片,烘干备用,Bcl-2及Bax免疫组化染色:Bcl-2及Bax呈细颗粒状、细丝状棕黄色着色,寻找Bcl-2、Bax阳性物质最丰富区域(即“热点”区,染色颜色最深或染色面积最多的区域),每张切片选取5个200倍视野的阳性细胞热点区,用Mias-2000型图形图像分析仪测量PVC部位Bcl-2或Bax阳性染色总面积、积分光密度与平均黑度,求取每张切片5个视野的染色面积总和、积分光密度总和与平均黑度均值。
2.5 电镜下PVC超微结构观察
各组随机选取1只SD大鼠,麻醉、固定、断头取脑,将初级视皮质17区切成2mm 3小块,放入3%戊二醛组织固定液,4℃冰箱内固定2h,1%锇酸后固定30min,观察初级视皮质神经元超微结构。由四川大学华西医学中心电镜室完成。
2.6 统计学方法
3 结果
3.1 补肾活血中药对慢性EIOP SD大鼠IOP的影响
表1显示,造模前各组大鼠IOP比较差异无统计学意义(P>0.05);造模后即刻与造模前相比,对照组IOP无明显变化(P>0.05),给药组、模型组IOP较造模前明显升高(P<0.01),这说明造模成功;造模后8周与造模后即刻相比,给药组IOP明显下降(P<0.01),模型组IOP无明显变化(P>0.05)。
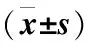
表1 补肾活血中药对慢性EIOP SD大鼠IOP的影响(单位:mmHg)
注:与造模前比较△P<0.01;与对照组比较▲P<0.01;与造模后即刻比较☆P<0.01
3.2 补肾活血中药对EIOP大鼠PVC神经元超微结构的影响
图1显示,对照组:细胞核(nucleus,N)圆形或卵圆形,胞浆中细胞器丰富,核膜完整;模型组:细胞核轮廓极不规则,核膜清晰可见,核内染色质固缩,残存线粒体(mitochondrion,Mi)、内质网(Endoplasmic reticulum,ER)变形、空泡化、破裂,胞浆空泡化;给药组:部分细胞核形态欠规则,核膜清晰可见,核内染色质呈聚集趋势,线粒体、内质网轻度肿胀、变形,胞浆中细胞器减少。

图1 PVC神经元细胞超微结构电镜观察(×1200)注: 1A:对照组;1B:模型组;1C:给药组
3.3 补肾活血中药对慢性EIOP大鼠初级视皮质Bcl-2蛋白表达的影响
表2及图2显示,各组以给药组Bcl-2蛋白表达最多,其总面积、积分光密度及平均黑度值最高;对照组Bcl-2蛋白表达与给药组无明显差异(P>0.05);模型组Bcl-2蛋白表达相较对照组及给药组均明显偏低,其总面积、积分光密度及平均黑度值均低于对照组及给药组(P<0.05或P<0.01)。
3.4 补肾活血中药对慢性EIOP大鼠初级视皮质BAX蛋白表达的影响
表3及图3显示,各组以模型组Bax蛋白表达最多,其阳性染色总面积、积分光密度及平均黑度相较对照组及给药组均明显偏高(P<0.05),而对照组及给药组Bax蛋白表达无明显差异(P>0.05)。
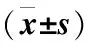
表2 补肾活血中药对慢性EIOP大鼠初级视皮质Bcl-2蛋白表达的影响
注:与对照组比较▲P<0.01,△P<0.05;与给药组比较★P<0.01

图2 补肾活血中药对慢性EIOP大鼠初级视皮质Bcl-2蛋白表达的影响(×200)注: 2A:对照组;2B:模型组;2C:给药组
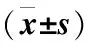
表3 补肾活血中药对慢性EIOP大鼠初级视皮质BAX蛋白表达的影响
注:与对照组比较▲P<0.01;与给药组比较★P<0.01,△P<0.05
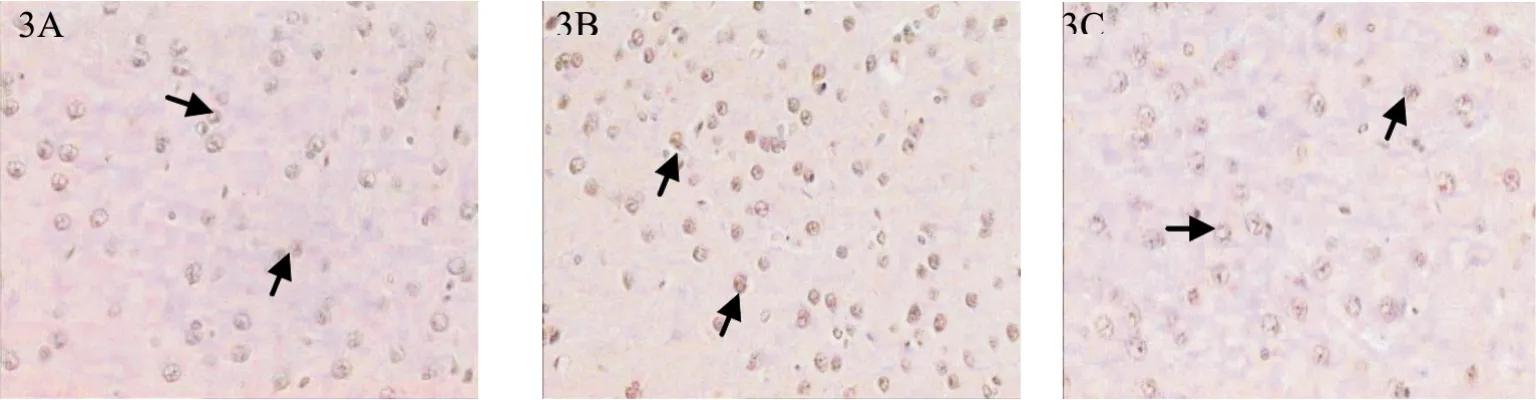
图3 补肾活血中药对慢性EIOP大鼠初级视皮质Bax蛋白表达的影响(×200)注: 3A:对照组;3B:模型组;3C:给药组
3.5 补肾活血中药对慢性EIOP大鼠初级视皮质Bcl-2/Bax的影响
表4显示,对照组及给药组Bcl-2/Bax比率均比模型较高(P<0.05);对照组Bcl-2/Bax较给药组无明显差异(P<0.05)。
4 讨论
近年来,PI3K/Akt信号通路(磷脂酰肌醇3激酶/丝氨酸/苏氨酸蛋白激酶,phosphatidylinositol 3-kinase pathway/protein kinase B,PI-3K/Akt)已成为凋亡基因调控热点,且PI3K/Akt信号通路促进神经元存活的作用已得到许多研究的证实[12-14],但具体作用机理仍不清楚。PI3K/Akt信号通路的主要成员Bcl-2及Bax已被证实在RGCs及视神经损伤中起着重要作用,Bcl-2由Bcl-2基因编码,是最早发现的抑制细胞凋亡的蛋白,其定位在线粒体膜、核外膜和内质网外膜的整合蛋白,是一种重要的抑制细胞凋亡的基因,而Bax是Bcl-2家族中最具有促进死亡特征的基因。Bcl-2与Bax基因表达水平的高低与凋亡调控直接相关,细胞内Bax表达升高时,细胞对死亡信号敏感,并加速细胞凋亡;当Bcl-2高表达时,Bax-Bax分开,Bcl-2可与Bax形成异源性二聚体,即中和了Bax-Bax促凋亡的作用,从而抑制细胞凋亡[15,16]。李翔[17]等观察到慢性EIOP模型大鼠RGCs Bcl-2较空白组明显降低、Bax较空白组明显升高。Isenmann[18]等在视神经挤压伤实验研究中发现,Bcl-2蛋白在神经节细胞中呈低水平表达,而Bax蛋白在损伤后表达明显增高,认为视神经损伤后,Bax的增加与Bcl-2低水平表达导致了RGCs凋亡。以上研究均证明Bax、Bcl-2与青光眼病理损害相关的RGCs凋亡存在密切联系,但其研究部位只局限于RGCs、视神经层次。
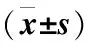

指标眼数总面积积分光密度对照组81.35±0.491.34±0.33模型组70.64±0.10▲★0.68±0.16▲★给药组71.29±0.471.22±0.20F14.2877.176P0.0000.005
注:与对照组比较▲P<0.01;与给药组比较★P<0.01
本研究检测各组SD大鼠8周的眼压变化情况、PVC Bcl-2、Bax蛋白表达水平,计算各组Bcl-2/Bax比率,并观察PVC神经元电镜超微结构,发现烙闭上巩膜静脉法制造的慢性EIOP模型可引起SD大鼠眼压升高、PVC Bcl-2蛋白表达下调、Bax蛋白表达上升、Bcl-2/Bax比率降低、PVC神经元电镜超微结构异常,补肾活血中药(杞菊地黄丸合复方丹参片)可促使SD大鼠慢性EIOP模型眼压下降、PVC Bcl-2蛋白表达上升、Bax蛋白表达、Bcl-2/Bax比率下降及PVC神经元细胞超微结构改善,说明补肾活血中药(杞菊地黄丸合复方丹参片)也可能是通过作用于PI3K/AKt通路在慢性EIOP SD大鼠视皮质受损过程中发挥视功能保护作用。
前期研究也表明补肾活血中药(杞菊地黄丸合复方丹参片)对SD大鼠慢性EIOP模型视网膜、视神经、LGN均有一定的保护作用:可抑制视网膜神经纤维层(retinal nerve fiber layer,RNFL)和视网膜神经节细胞层(retinal ganglion cells layer,RGCL)变薄、改善RGCs超微结构,防止RGCs与RNFL损害[19,20],有助于多焦视网膜电图(multifocal electroretinogram,mfERG)总波及1、2、3、4环P1波反应密度、总波P1波峰潜时、2环及3环N1波反应密度,3环、4环N1波峰潜时的恢复[21];上调RGCs抗凋亡基因Bcl-2、抑制凋亡促进基因Bax[17];提高视神经纤维髓鞘总面积、平均光密度值及积分光密度值,改善视神经超微结构[22];改善LGN神经元细胞密度、神经元剖面积密度、有髓纤维密度、尼氏小体积分光密度等[23]。临床也证实补肾活血中药(杞菊地黄丸合复方丹参片)可改善原发性青光眼术后眼压已控制患者的视野、P-VEP及RNFL厚度等指标,从而保护青光眼患者视神经和视功能[24,25]。
本实验通过研究补肾活血中药(杞菊地黄丸合复方丹参片)对PI3K/AKt信号通路的影响,发现在慢性高眼压的影响下,初级视皮质抗凋亡基因Bcl-2表达明显减少,促凋亡基因Bax表达明显增多。可能Bcl-2蛋白表达增多,通过异源二聚体形成抑制了Bax转位与Bax二聚体形成,从而抑制Bax表达。随着Bax-Bax二聚体减少,即阻断了细胞凋亡的信号途径,从而抑制细胞凋亡。多项研究表明青光眼与帕金森、阿尔茨海默氏病、肌萎缩侧索硬化症等常见的中枢神经系统疾病具有相同的发病机制,即“跨突触或跨神经元变性”[26-29]。跨神经元变性是指一组神经元受到损害后,不仅受损的神经元会发生改变,其通路远端与受损神经元突触联系的靶神经元接受的传入冲动减少,活性降低,亦出现退行性改变[19]。即初级视皮质的受损也许会削弱对其下级神经元RGCs的下行营养支持而加重RGCs病变,故补肾活血中药(杞菊地黄丸合复方丹参片)可能通过提高慢性高眼压模型促使SD大鼠慢性EIOP模型眼压下降、PVC Bcl-2蛋白表达上升、Bax蛋白表达、Bcl-2/Bax比率下降及PVC神经元细胞超微结构改善而保护受损视皮质,从而减轻PVC的下级神经元RGCs损害,而发挥保护视功能作用。
[1] 刘冠禹.青光眼视神经损伤发病机制的研究进展[J].医学综述,2010,16(8):1223-1225.
[2] 赵家良.减少青光眼导致的盲和视力损伤是防盲的重要内容[J].中华眼科杂志,2009,45(10):865-867.
[3] Yih-Chung Tham,Xiang Li,Tien Y Wong,etal.Global Prevalence of Glaucoma and Projections of Glaucoma Burden through 2040:A Systematic Review and Meta-Analysis[J].Ophthalmology,2014,121(11):2081-2090.
[4] Gupta N,Ang LC,Noelde Tilly L,etal.Human glaucoma and neural degeneration in intracranial optic nerve,lateral geniculate nucleus and visual cortex[J].Br J Ophthalmol,2006,90(6):674-678.
[5] Schwartz M,London A.Erratum to:Immune maintenance in glaucoma: boosting the body's own neuroprotective potential[J].J Ocul Biol Dis Infor,2009,2(3):104-108.
[6] 刘旭阳,王宁利,陈晓明.青光眼是一种中枢神经系统疾病吗?[J].眼科,2010,19(1):4-7.
[7] 赵颖,戴惟葭.原发性开角型青光眼中枢视觉通路的改变[J].眼科新进展,2010,30(2):182-185.
[8] 李翔,郭红建,文晓霞,等.补肾活血中药对大鼠慢性高眼压模型初级视皮质BDNF损害的影响[J].国际眼科杂志,2013,13(4).647-651.
[9] 李翔,郭红建,文晓霞,等.补肾活血中药对大鼠慢性高眼压模型初级视皮质尼氏小体损害的影响[J].国际眼科杂志,2012,12(12):2256-2260.
[10] Sawada A,Neufeld AH.Confirmation of the rat model of chronic,moderately elevated intraocular pressure[J].Exp Eye Res,1999,69(5):525-531.
[11] 王平宇.大白鼠中枢神经系统解剖学基础[M].第1版.北京:人民卫生出版社.1986:160.
[12] 冯美江,丁新生.Akt与细胞生存[J].国外医学:分子生物学分册,2002,24(5):283-285.
[13] 杨章民,王一理,司履生.磷酯酰肌醇一3激酶家族研究进展[J].国外医学:分子生物学分册.2003,25(5):285-289.
[14] 张薇薇,苗玲.PI3K/Akt信号通路及其在神经疾病中的研究进展[J].中风与神经疾病杂志,2007,24(6):755-757.
[15] Sattler M,Liang H,Netreaheim D,etal.Structure of Bcl-xL-Bak Peptide Complex: Recognition Between Regulators of Apoptosis[J].Science,1997,275(5302): 983-986.
[16] Knudson CM,Korsmeyer SJ.Bcl2 and Bax function independently to regulated cell death[J].Nat Genet,1997,16:358-363.
[17] 李翔,曹水清,毛欣,等.补肾活血中药对大鼠慢性高眼压模型视网膜神经节细胞凋亡相关基因Bcl-2、Bax表达的影响[J].四川中医,2010,28(2):22-24.
[18] Isenmann S,Wahl C,Krajewski S,etal.Up-regulationof bax proteinin degenerating retinal ganglion cells preeedes apoptotic cell deathafter opticnervelesionintherat[J].Eur J Neurosci,1997,9(8):1763-1772.
[19] 李翔,毛欣,张富文.补肾活血中药对大鼠慢性高眼压模型视网膜病理改变的影响[J].北京中医药大学学报,2010,33(6):390-393.
[20] 毛欣,李翔.补肾活血中药对慢性高眼压模型大鼠视功能损害的干预作用[J].国际眼科杂志,2010,10(2):238-240.
[21] 李翔,毛欣,张富文.补肾活血中药对大鼠慢性高眼压模型多焦视网膜电图的影响[J].四川中医,2009,27(8):18-21.
[22] 李翔,马世勇,李娟,等.补肾活血中药对大鼠慢性高眼压模型视神经病理改变的影响[J].眼科新进展,2013,33(2):122-125.
[23] 李翔,谢钊,郭红建,等.补肾活血中药对大鼠慢性高眼压模型外侧膝状体病理改变的影响[J].眼科新进展,2012,32(1):20-23.
[24] 汪伟,李妍,刘红佶,等.补肾活血中药对原发性青光眼术后视神经保护作用的临床研究[J].北京中医药大学学报,2016,39(2):132-135.
[25] 张静,李翔.补肾活血中药治疗原发性闭角型青光眼的临床观察[J].湖北中医药杂志,2014,36(3):10-11.
[26] Gupta N,Ang LC,Noel de Tilly L,Bidaisee L and Yucel YH,Human glaucoma and neural degeneration in intracranial optic nerve,lateral geniculate nucleus,and visual cortex[J].Br J Ophthalmol,2006,90(6):674-678.
[27] Gupta N,Yucel YH.Glaucoma as a neurodegenerative disease[J].Curr Opin Ophthalmol,2007,18(2):110-114.
[28] Yucel Y,Gupta N.Glaucoma of the brain:A disease model for the study of transsynaptic neural degeneration[J].Prog Brain Res,2008,17(3):465-478.
[29] Yenice Ozlem,Onal Sumru,Midi Ipek,etal.Visual field analysis in patients with Parkinson's disease[J].Parkinsonism & Related Disorders,2008,14(3):193-198.
InfluenceofBuShenHuoXueonprimaryvisualcortex'Bcl-2andBaxofPI3K/AKtpathwayinSDratmodelofchronicelevatedintraocularpressure
LIUHong-ji,LIXiang,LIXiang-yu,LIHua-hong,YANGfeng-jiao,TIANmeng-yao,WANGTai
(ChengduUniversityofTCM,Chengdu,Sichuan,610072)
ObjectiveTo observe the effect traditional Chinese medicine(TCM)of BuShenHuoXue(QijuDihuang pills and DaShen tablets)on the expression of primary visual cortex's Bcl-2 and Bax in the SD rat model of chronic EIOP,and preliminarily explore its mechanism.Methods30 SD rats were randomly and equally divided into 3 groups:control group,model group and treatment group.By unilaterally cauterizing 3 episcleral vessels,the rat model of chronic EIOP was established on model group and treatment group.After given TCM drugs of BuShenHuoXue and normal saline for 8 weeks respectively,the rats were put to death.The intraocular pressure(IOP)of SD rats were measured by handheld tonometer(TONO-PEN),the protein expression of PVC's Bcl-2,Bax were detected by Immuno-histochemistry,Electron microscopy were performed to observe the ultrastructure of PVC's neurons.ResultsIOP in treatment groups and model group from models building until 8 weeks postoperation were higher compared with pre-operation,indcated that the EIOP model was successfully established.There was obviously decrease in treatment group between 8 weeks postoperation and models building,While model group was not obvious change.8 weeks postoperation,Immuno-histochemistry analysis on PVC showed that the positive expression on Bcl-2 protein of treatment group was highest,it's total area,integrated optical density and average density had not obvious difference compared with control group.while model group 's Bcl-2 positive expression(total area,integrated optical density and average density)were slower than treatment group and control group.the positive expression on Bax of model group was highest,it's total area,integrated optical density and average density were higher than treatment group and control group.treatment group had not obvious difference than control group.PVC's ultrastructure of neurons in treatment group was significantly improved compared model group.
ConclusionTCM of BuShenHuoXue(QijuDihuang pills and DaShen tablets)can promote the repairment of neurons cell of PVC in the rat model of chronic EIOP,its mechanism may be through the effect on PI3K/AKt pathway,enhance the expression of Bcl-2,dwonregulate the expression of Bax,improve ultrastructure of neurons cell and reducing IOP.
Glaucoma; Visual function protection; Primary visual cortex; Bcl-2; Bax; TCM of BuShenHuoXue(QijuDihuang pills and DaShen tablets)
国家自然科学基金资助项目(NO:81373695)-补肾活血法调控青光眼RGCs PI3K/Akt信号转导通路的研究
610072,四川成都,成都中医药大学附属医院
李翔,E-mail:jeannelxiang@126.com
10.3969/j.issn.1674-9006.2017.04.004
R775

