PD-L1及TGF-β在非小细胞肺癌中的表达及其临床意义
周建英 刘敏知 黄 晖 黄传生
PD-L1及TGF-β在非小细胞肺癌中的表达及其临床意义
周建英 刘敏知 黄 晖 黄传生
目的探讨在非小细胞肺癌(NSCLC)中PD-L1及TGF-β表达水平,及其与NSCLC临床病理参数和术后无病生存期(DFS)的关系。方法收集81例NSCLC标本,采用免疫组化方法检测术后肿瘤组织中PD-L1、PD-1、Foxp3+和TGF-β蛋白的表达水平。结果81例患者中PD-L1阳性表达为46 例(56.8%),阴性表达35 例(43.2%)。TGF-β阳性36例(44.4%),阴性45例(55.6%)。PD-1阳性33例(40.7%),阴性48例(59.3%);Foxp3+阳性44例(54.3%),阴性37例(45.7%)。NSCLC中PD-L1蛋白表达与各临床病理参数无明显相关性。单因素分析发现T分期、TGF-β表达、PD-L1表达 影响.SCLC术后DFS,具有统计学差异(P<0.05),多因素分析发现T分期、TGF-β表达、PD-L1表达是影响NSCLC术后DFS的独立因素(P<0.05)。PD-L1阳性表达组术后DFS为(21.000±1.429)个月,阴性表达组为(14.500±1.615)个月,两组有统计学差异(χ2=6.930,P=0.008)。TGF-β阳性组PFS为(14.500±0.813)个月,阴性组为(21.000±1.639)个月,两组有统计学差异(χ2=8.71,P=0.003)。结论非小细胞肺癌中PD-L1及TGF-β蛋白是预测NSCLC术后DFS的重要指标,且PD-L1表达越高预示术后DFS越长,而TGF-β则表达越高,预示术后DFS越短。
PD-L1;TGF-β;非小细胞肺癌;无病生存期(DFS)
原发性肺癌(以下简称肺癌)是我国最常见的恶性肿瘤之一。全国肿瘤登记中心2014年发布的数据显示,2010年,我国新发肺癌病60.59万,居恶性肿瘤首位(男性首位,女性第2位),占恶性肿瘤新发病例的19.59%。同期,我国肺癌死亡人数为48.66万,占恶性肿瘤死因的24.87%。而非小细胞肺癌占所有原发性肺癌病例数的80%~85%[1]。手术仍然是早期非小细胞肺癌(NSCLC)患者唯一可能治愈的方法,然而,一部分肺癌患者即使经过完全手术切除仍会复发,但临床工作中很难预测术后患者的复发时间。本实验运用免疫组化方法检测术后肿瘤组织中PD-L1、PD-1、Foxp3+和TGF-β蛋白的表达水平,分析PD-L1及TGF-β与患者各项临床指标及预后的关系。
1 材料与方法
1.1 临床资料
2012至2013年期间江西省肿瘤医院手术治疗的非小细胞肺癌(NSCLC) 81例,患者术前均未接受任何形式的化疗或放疗。其中男性68例,女性13 例,年龄35~77岁,中位年龄60岁,按照WHO肺癌分型标准其中腺癌34例,鳞癌47例;所有手术标本采用10%的中性福尔马林液固定,常规石蜡包埋,4 μm厚连续切片。
1.2 病例随访
所有81例病例均有完整的随访资料并以电话、门诊、住院等形式对所有病例进行随访,无病生存期(DFS)的计算从手术日期到疾病复发或由于疾病进展导致患者死亡的时间。
1.3 免疫组织化学法
兔抗人PD-L1克隆抗体、兔抗人PD-1单克隆抗体、兔抗人TGF-β单克隆抗体和兔抗人Foxp3+单克隆抗体由武汉博士德公司提供。用PBS缓冲液代替一抗做空白对照。石蜡切片,常规二甲苯脱蜡,梯度酒精水化,然后石蜡切片采用柠檬酸钠缓冲液经过微波炉进行抗原修复10 min,再用3%H2O2溶液封闭30 min以阻断内源性过氧化物酶,蒸馏水洗涤后,5%BSA封闭非特异性结合位点,于室温孵育15 min。然后分别加入一抗,于4 ℃冰箱过夜。取出切片,加入HRP标记的二抗,室温下孵育 30 min,用DAB显色,苏木精复染,梯度酒精脱水,中性树脂封片,光镜观察。
1.4 结果判断标准
每张染色片均由两名病理医生进行单盲评分,以细胞膜或细胞质出现黄色至棕褐色颗粒为阳性显色。PD-L1根据染色强度和阳性细胞百分比来进行评分。每张染色片均选取5 个高倍镜视野(400×),根据阳性细胞百分比评分:阳性细胞数≤10%为1分,10%~50%为2分,>50%为3分。根据阳性细胞染色强度记分:无色计0分,弱阳性(淡黄色)计1 分,中度阳性(棕黄色)计2分,强阳性(棕褐色)计3 分。上述两项得分的乘积>3分为阳性。PD-1和Foxp3+阳性细胞主要为癌间质淋巴细胞。随机选取5个高倍视野(×400倍),计数阳性淋巴细胞数,求其平均值作为该例PD-1和Foxp3+阳性淋巴细胞组。TGF-β阳性判断,随机选取5个高倍镜视野(400×),计数500个细胞中染色阳性细胞数,阳性细胞<20%为阴性,阳性细胞>20%为阳性。
1.5 统计学处理
应用SPSS 19.0统计软件进行统计学分析,计数资料采用率表示,不同组间比较采用χ2检验和Spearman等级相关分析。 生存率的组间比较采用Kaplan-Meier生存分析法及Log-rank检验,用Cox比例风险模型进行多因素分析,研究各临床病理因素对肺癌预后的影响。所有分析均以双侧P<0.05为差异有统计学意义。
2 结果
2.1 PD-L1、PD-1、TGF-β和Foxp3+蛋白表达的免疫组化检测结果
PD-L1蛋白 和TGF-β蛋白主要表达于肺癌细胞上。在81例非小细胞肺癌中,PD-L1阳性56.8%(46/81),阴性43.2%(35/81);TGF-β阳性44.4%(36/81),阴性 55.6%(45/81)(表1)。PD-1蛋白和Foxp3+蛋白主要表达于癌间质淋巴细胞。在81例非小细胞肺癌中,PD-1阳性40.7%(33/81),阴性59.3%(48/81);Foxp3+阳性54.3%(44/81),阴性45.7%(37/81)(表1)。
2.2 NSCLC中PD-L1的表达情况及患者一般资料
本组非小细胞肺癌患者共81 例,其中≤60岁46 例,>60岁35 例,有吸烟史64例,淋巴结转移者31例。肿瘤分期中,T1~2期 63 例,T3~4期 18 例。病理分化程度中,低分化46例,中分化32例,高分化3例。在非小细胞肺癌的81例中,PD-L1蛋白表达与患者年龄、性别、吸烟史、T分期、淋巴结转移、病理类型、分化程度、PD-1表达、TGF-β表达和Foxp3+表达无明显相关性(表1)。
2.3 临床病理参数与NSCLC术后DFS的关系
单因素分析:患者T分期、TGF-β表达、PD-L1表达与NSCLC患者术后DFS相关(P<0.05);年龄、性别、吸烟史、淋巴结转移、病理类型、分化程度、PD-1表达和Foxp3+表达与患者术后DFS无关(P>0.05)。多因素分析发现:T分期、TGF-β表达、PD-L1表达与患者术后DFS有显著相关性(P<0.05),是影响NSCLC术后DFS的独立因素,而PD-1表达与Foxp3+表达无相关性(P>0.05),与NSCLC术后DFS无明显相关性,见表2。
2.4 PD-L1和TGF-β蛋白表达与患者术后DFS的关系
对81 例患者进行Kapalan-Meier 生存曲线分析,结果显示PD-L1阳性表达组DFS为(21.000±1.429)个月,阴性表达组为(14.500±1.615)个月,两组差异显著(图1A)(χ2=6.930,P=0.008)。TGF-β 阳性组DFS为(14.500±0.813)个月,阴性组为(21.000±1.639)个月,两组差异显著(图1B)(χ2=8.71,P=0.003)。

表1 PD-L1表达情况及患者一般资料/例
3 讨论
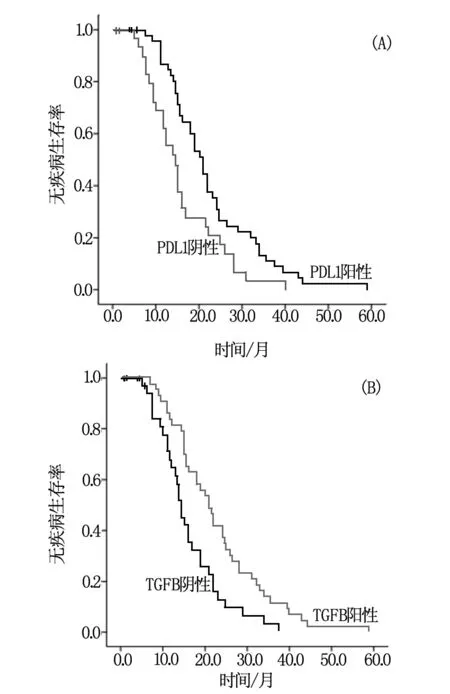
图1 PD-L1和TGF-β不同表达水平对NSCLC术后DFS的影响
TNM分类系统辅以组织学和遗传学特征是目前最重要的生存预测因子,是非小细胞肺癌治疗决策的重要指南。然而,即使同一个TNM分期的非小细胞肺癌患者生存时间仍存在重大差异,阻碍其预测预后的准确性[2]。因此,目前的基于临床和病理结果的TNM分期系统可能已经达到了其有用性的极限[3]。准确地预测肿瘤可能复发的病例不仅可有助于指导术后辅助治疗方案的制定,而且能够预测哪些治疗可能使患者受益[4-5],同时因为手术本身具有一定的风险,准确地预测肿瘤可能复发的病例也有助于选择完整手术切除患者[6-7]。所以目前临床急需更好的方法来判断患者的预后以指导临床决策。
肿瘤微环境是肿瘤免疫学的重要研究内容,已有研究证实肿瘤微环境中的肿瘤细胞表面程序性死亡配体-1(Programmed death-1-ligand PD-L1)增高,同时与活化的T细胞表面的受体 PD-1 结合,传递负性调控信号,导致肿瘤抗原特异性T细胞的凋亡或免疫无效,从而抑制免疫免疫,进而促使肿瘤细胞的逃逸。而TGF-β的存在则可增强其抑制T细胞的功能。在本研究中通过单因素分析发现患者的T分期、TGF-β的表达、PD-L1的表达影响NSCLC术后DFS,具有统计学差异(P<0.05)。为了排除不同因素之间的相互影响,我们把单因素分析有统计学意义的临床病理特征和可能影响NSCLC术后DFS的临床病理特征进行COX比例风险模型预后分析,多因素分析发现T分期、TGF-β的表达、PD-L1的表达对DFS影响具有统计学差异(P<0.05),是影响NSCLC术后DFS的独立因素。

表2 NSCLC临床病理参数与DFS 的相关性
目前已有较多文献关于PD-L1的表达对肺癌患者预后价值的研究,关于PD-1表达的调节机制尚未完全明了,肿瘤细胞中PD-L1的表达在NSCLC预后的预测价值尚存在争议。有的研究认为 NSCLC肿瘤细胞 PD-L1 高表达与预后差相关[8-9],同时也有多项研究认为NSCLC肿瘤细胞 PD-L1 高表达者预后好于低表达者[10-12],这与本研究结果一致。然而,还有一些研究[13-15]认为二者根本没有关系。造成实验结果差异性可能的原因在于:①PD-L1的表达水平检测采用免疫组化(手动和自动)方法使用的是不同抗PD-L1抗体和染色方法;②采用不同的PD-L1临界值确定PD-L1阳性表达,1%,5%和10%是最常用的临界值;③PD-L1的表达是肿瘤免疫编辑过程中1个动态的过程[16]。所以想要阐明PD-L1对NSCLC预后的影响,一致性检测技术、临界值、时间点和非小细胞肺癌特定阶段的组织学是必要的。更为重要的是,以往的研究表明,肿瘤组织中,肿瘤浸润淋巴细胞、PD-L1和Foxp3+是顺铂化疗反应的重要指标[17-18]。而本研究中纳入的病例有相当一部分病人接受了含铂两药方案术后辅助化疗,这可能也会影响研究结果。
肿瘤微环境中转化生长因子β (transform ing grow th factors-B,TGF-β) 是1种多功能的多肽类细胞因子,几乎体内所有细胞都能产生 TGF-β并存在其受体。其在体内外具有广泛的生物学功能,包括调控细胞生长、调节细胞表型等作用,然而其在肿瘤进展中的机制尚未完全阐明[19]。肿瘤发生发展的重要原因之一是由于免疫系统抑制,而TGF-β在免疫系统的抑制中起着至关重要的作用,在TGF-β1基因敲除小鼠身上产生的严重自身免疫性疾病证明了这一点[20]。T细胞被认为是TGF-β免疫抑制活性的主要靶细胞,因为TGF-β选择性和特异性的T细胞TGFBR2切除导致了与TGF-β1基因敲除动物相似的自身免疫性疾病[21],由此可以认为T细胞中的TGF-β信号能抑制T细胞的炎症反应和细胞分化程度。除了降低T细胞的效应功能,TGF-β同时被认为能有效的诱导调节性T细胞(Treg细胞)的产生,调节性T细胞能够抑制效应T细胞的细胞毒性和炎症。调节性T细胞的发育及功能均在叉头家族转录因子Foxp3+的控制下[22]。本研究表明TGF-β与术后NSCLC患者DFS呈负相关,但在本研究中并未发现Foxp3+与术后NSCLC患者DFS的相关性,这可能是由于Foxp3+本身并不能提示非细胞肺癌患者的预后,若肿瘤组织中低Foxp3+/高CD8+的患者往往有长期PFS[23]。
通过本实验研究发现,非小细胞肺癌中PD-L1及TGF-β蛋白是预测NSCLC术后DFS的重要指标,PD-L1表达越高预示术后DFS越长,而TGF-β则表达越高,预示术后DFS越短,二者联合检测可用于预测肺癌术后复发可能性,不仅可有助于指导辅助治疗方案的制定,同时也可帮助选择完整手术切除机会的患者,带来生存获益。
[1] D'Addario G,Felip E,Group EGW.Non-small-cell lung cancer:ESMO clinical recommendations for diagnosis treatment and follow-up〔J〕.Ann Oncol,2009,20 (Suppl4):68-70.
[2] Goldstraw P,Crowley J,Chansky K,et al.The IASLC Lung Cancer Staging Project:proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM Classification of malignant tumours〔J〕.J Thorac Oncol,2007,2(8):706-714.
[3] Pollack JR.A perspective on DNA microarrays in pathology research and practice〔J〕.Am J Pathol,2007,171(2):375-385.
[4] Patnaik SK,Kannisto E,Knudsen S,et al.Evaluation of microRNA expression profiles that may predict recurrence of localized stage Ⅰ non-small cell lung cancer after surgical resection〔J〕.Cancer Res,2010,70(1):36-45.
[5] Uramoto H,Nakanishi R,Nagashima A,et al.A randomized phase II trial of adjuvant chemotherapy with bi-weekly carboplatin plus paclitaxel versus carboplatin plus gemcitabine in patients with completely resected non-small cell lung cancer〔J〕.Anticancer Res,2010,30(11):4695-4699.
[6] Uramoto H,Nakanishi R,Fujino Y,et al.Prediction of pulmonary complications after a lobectomy in patients with non-small cell lung cancer〔J〕.Thorax,2001,56(1):59-61.
[7] Uramoto H,Takenoyama M,Hanagiri T.Simple prophylactic fixation for lung torsion〔J〕.Ann Thorac Surg,2010,90(6):2028-2030.
[8] Chen YB,Mu CY,and Huang JA.Clinical significance of programmed death-1 ligand-1 expression in patients with non-small cell lung cancer:a 5-year-follow-up study〔J〕.Tumori,2012,98(6):751-755.
[9] Azuma K,Ota K,Kawahara A,et al.Association of PD-L1 overexpression with activating EGFR mutations in surgically resected nonsmall-cell lung cancer〔J〕.Ann Oncol,2014,25(10):1935-1940.
[10] Velcheti V,Schalper KA,Carvajal DE,et al.Programmed death ligand-1 expression in non-small cell lung cancer〔J〕.Lab Invest,2014,94(1):107-116.
[11] Cooper WA,Tran T,Vilain RE,et al.PD-L1 expression is a favorable prognostic factor in early stage non-small cell carcinoma〔J〕.Lung Cancer,2015,89(2):181-188.
[12] Lin C,Chen X,Li M,et al.Programmed death-ligand 1 expression predicts tyrosine kinase inhibitor response and better prognosis in a cohort of patients with epidermal growth factor receptor mutation-positive lung adenocarcinoma〔J〕.Clin Lung Cancer,2015,16(5):e25-e35.
[13] Konishi J,Yamazaki K,Azuma M,et al.B7-H1 expression on non-small cell lung cancer cells and its relationship with tumor-infiltrating lymphocytes and their PD-1 expression〔J〕.Clin Cancer Res,2004,10(15):5094-5100.
[14] Boland JM,Kwon ED,Harrington SM,et al.Tumor B7-H1 and B7-H3 expression in squamous cell carcinoma of the lung〔J〕.Clin Lung Cancer,2013,14(2):157-163.
[15] Yang CY,Lin MW,Chang YL,et al.Programmed cell deat-h-ligand 1 expression in surgically resected stage Ⅰ pulmonary adenocarcinoma and its correlation with driver mutations and clinical outcomes〔J〕.Eur J Cancer,2014,50(7):1361-1369.
[16] Gatalica Z,Snyder C,Maney T,et al.Programmed cell dea-th 1 (PD-1) and its ligand (PD-L1) in common cancers and their correlation with molecular cancer type〔J〕.Cancer Epidemiol Biomarkers Prev,2014,23(12):2965-2970.
[17] Lee JY,Son T,Cheong JH,et al.Association between che-motherapy-response assays and subsets of tumor-infiltrating lymphocytes in gastric cancer:a pilot study〔J〕.J Gastric Cancer,2015,15(4):223-230.
[18] Lee SY,Jung DK,Choi JE,et al.PD-L1 polymorphism can predict clinical outcomes of non-small cell lung cancer patients treated with first-line paclitaxel-cisplatin chemotherapy〔J〕.Sci Rep,2016,6:25952.
[19] Principe DR,Doll JA,Bauer J,et al.TGF-β:Duality of fu-nction between tumor prevention and carcinogenesis〔J〕.JNCI Journal of the National Cancer Institute,2014,106(2):djt369.
[20] Shull MM,Ormsby I,Kier AB,et al.Targeted disruption of the mouse transforming growth factor-beta 1 gene results in multifocal inflammatory disease〔J〕.Nature,1992,359(6397):693-699.
[21] Marie JC,Liggitt D,Rudensky AY.Cellular mechanisms of fatal early-onset autoimmunity in mice with the T cell-specific targeting of transforming growth factor-beta receptor〔J〕.Immunity,2006,25(3):441-454.
[22] Fontenot JD,Gavin MA,Rudensky AY.Foxp3 programs the development and function of CD4+CD25+regulatory T cells〔J〕.Nat Immunol,2003,4(4):330-336.
[23] Teng F,Meng X,Wang X,et al.Expressions of CD8+TIL-s,PD-L1 and Foxp3+TILs in stage Ⅰ NSCLC guiding adjuvant chemotherapy decisions〔J〕.Oncotarget,2016,7(39):64318-64329.
ExpressionofPD-L1andTGF-βinNon-smallCellLungCancerandItsClinicalSignificance
ZHOUJianying,LIUMinzhi,HUANGHui,etal.
JiangxiCancerHospital,Nanchang,330029
ObjectiveTo investigate the expression of PD-L1 and TGF-β in non-small cell lung cancer (NSCLC),and its relationship with clinical pathological parameters and disease free survival (DFS) of NSCLC after operation.Methods81 specimens of NSCLC were collected,Immunohistochemical method was used to detect the levels of PD-L1,PD-1,Foxp3+and TGF-β protein in tumor tissues after operation.ResultsIn 81 patients,the positive expression of PD-L1 was 46 cases(56.8%),and the negative expression was 35 cases(43.2%).TGF-β positive in 36 cases (44.4%),negative in 45 cases (55.6%).PD-1 positive in 33 cases (40.7%),negative in 48 cases (59.3%),Foxp3+positive in 44 cases (54.3%),negative in 37 cases (45.7%).The expression of PD-L1 protein in NSCLC was not significantly correlated with clinicopathological parameters.Single factor analysis Indicate that the T staging,the expression of TGF-β,and the expression of PD-L1 influenced the postoperative DFS of NSCLC,and there was a statistical difference (P<0.05),Multivariate analysis showed that the T stage,the expression of TGF-β and the expression of PD-L1 were independent factors influencing the postoperative DFS of NSCLC (P<0.05).The postoperative DFS in the PD-L1 positive expression group was (21+1.429) months,and the negative expression group was (14.500+1.615) months,and the difference between the 2 groups was statistically significant (χ2=6.930,P=0.008).In the TGF-β positive group,DFS was (14.500+0.813) months,and the negative group was (21+1.639) months,and the difference between the 2 groups was statistically significant (χ2=8.71,P=0.003).ConclusionPD-L1 and TGF-β protein in NSCLC are important indexes to predict the DFS of NSCLC,and the higher the expression of PD-L1,the longer the postoperative DFS,the higher the expression of TGF-β,the shorter the postoperative DFS.
PD-L1;TGF-beta;Non-small cell lung cancer(NSCLC);Disease free survival(DFS)
(ThePracticalJournalofCancer,2017,32:1922~1927)
江西省科技支撑计划项目(编号:20141BBG70049)
330029 江西省肿瘤医院
刘敏知
10.3969/j.issn.1001-5930.2017.12.003
R734.2
A
1001-5930(2017)12-1922-06
2017-09-15
2017-10-31)
(编辑:吴小红)

