越冬期前后菲律宾蛤仔体成分变化研究
杨东敏, 王化敏, 丁鉴锋、2, 杨凤、2, 闫喜武、2
越冬期前后菲律宾蛤仔体成分变化研究
杨东敏1, 王化敏1, 丁鉴锋1、2, 杨凤1、2, 闫喜武1、2
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023)
为研究菲律宾蛤仔Ruditapes philippinarum的低温耐受机制,对采集于大连市金石滩体质量为(15.45±1.00)g的越冬期蛤仔生理生化物质 (结合水、糖原、甘油、脂肪、脂肪酸和氨基酸)含量的变化进行了检测。结果表明:与越冬前相比,越冬期后菲律宾蛤仔的糖原和脂肪含量均显著降低 (P<0.05),甘油含量则显著升高 (P<0.05); 脂肪酸 C18∶0、 C20∶4n-6、 C22∶5n-6和 C22∶5n-3含量显著降低 (P<0.05),C20∶5n-3(EPA)含量显著升高 (P<0.05);异亮氨酸、谷氨酸和赖氨酸含量显著升高 (P<0.05)。研究表明,蛤仔体成分的变化与其低温耐受能力存在密切联系,该研究可为菲律宾蛤仔越冬期管理提供理论参考。
菲律宾蛤仔;结合水;糖原;脂肪酸;氨基酸
菲律宾蛤仔Ruditapes philippinarum属广温、广盐性贝类,是中国重要的海洋生物资源,主要栖息于内湾、河口和沿海滩涂等区域[1-4],在水产品消费、渔业经济和贸易等方面占有十分重要的地位。
研究发现,低温影响生物体正常的生长和代谢,当温度降低时生物体会通过一系列的适应对策减少体液过冷对组织和细胞的损伤。目前,关于生物抗寒性的研究多见于昆虫。黄国洋等[5]报道,黄地老虎Agrotis segetum幼虫的抗寒系统主要由小分子糖、氨基酸、糖蛋白组成。王鹏等[6]研究发现,桃小食心虫Carposia niponensis幼虫在越冬期间,主要由总蛋白、总糖、总脂肪组成抗寒系统以增强其自身防护能力。另有报道表明,耐寒性昆虫主要通过维持虫体的过冷却状态以免在越冬期间的严寒,而其过冷却能力的维持与体内生化物质的种类和含量变化有密切关系[5-8]。在贝类研究中发现,越冬期低温的海水可对贝类养殖造成较大的影响。烟台海区曾由于冬季海水温度变化导致的溶氧和pH降低等造成贝类大量死亡[9]。在蛤仔养殖的研究中,室外培育的蛤仔苗种在越冬期间成活率要远低于其他时期[1]。对长牡蛎Crassostrea gigas体成分季节性变化的检测也发现,在不同季节其体成分会发生相应的变化,冬季体内的营养物质减少,繁殖过程出现休止期[10]。对贝类的耐低温研究已有少量报道,福寿螺Pomacea canaliculata在越冬期到来前通过改变体内糖原、脂肪、水分、氨基酸和蛋白质等成分含量增强其耐寒能力[11-13],贻贝Mytilus edulis血淋巴中的牛磺酸和丙氨酸已被证实可作为血淋巴的低温保护剂[14]。在蛤仔的养殖研究中发现,成体菲律宾蛤仔能在低于零度的海水中存活,表明其体内可能具有应对低温条件的机制。目前,国内外对菲律宾蛤仔低温机制的研究尚未见相关报道,为此,本研究中对菲律宾蛤仔越冬期间体成分的变化及耐低温机制进行初步探讨,旨在为蛤仔越冬抗寒策略提供理论依据。
1 材料与方法
1.1 材料
试验用菲律宾蛤仔为大连市金石滩北方野生群体,分别于12月和翌年3月进行采集。选取壳长为 (2.50±0.50)cm、 体质量为 (15.45±1.00)g健康且壳型完整的蛤仔进行试验。
1.2 方法
1.2.1 样品处理 随机选取越冬期前、后的蛤仔各35只,放在滤纸上干露24 h,解剖取出软体部,用于结合水、脂肪、糖原、甘油、氨基酸和脂肪酸含量测定。
1.2.2 蛤仔体成分指标的测定与计算
(1)结合水。随机选取越冬期前、后各10只蛤仔样品软体部并称重记为w;放入烘箱 (60℃)中烘至恒重,称重记为w1;在105℃下烘至恒重,称重记为w2。结合水含量计算公式为

(2)糖原。随机选取越冬期前、后各10只蛤仔样品的软体部,采用冷冻干燥法烘干,研磨成干粉后采用蒽酮比色法进行糖原含量测定,按照南京建成生物工程研究所糖原试剂盒说明书进行操作。
(3)甘油。参考仵均祥[15]的方法并做改进,取0.02 g冷冻干燥的蛤仔粉末放入匀浆器,加入1 mL蒸馏水充分匀浆,再用1 mL蒸馏水冲洗干净玻璃棒。在室温下以10 000 r/min离心10 min,将上清液转入10 mL带塞试管中。取1 mL上清液加蒸馏水稀释1倍,通过制作标准曲线测定吸光值。计算公式为

(4)脂肪。随机选取越冬期前、后各10只蛤仔样品软体部,放入60℃烘箱烘至恒重,磨成干粉,采用索氏提取法 (GB 5009.6—1985)测定样品脂肪含量。
(5)脂肪酸。随机选取越冬期前、后各10只蛤仔样品新鲜软体部,放入剪切匀浆机中研碎,采用气相色谱法 (GB/T5009.168—2003)测定样品脂肪含量。
(6)氨基酸。取0.03 g经冷冻干燥处理的蛤仔干粉,采用酸水解法,使用氨基酸自动分析仪(日立835-50),测定样品中的氨基酸含量。
1.3 数据处理
采用SPSS 20.0统计软件对试验结果进行分析,对蛤仔体成分指标数据进行t检验,显著性水平设为0.05。
2 结果与分析
2.1 越冬期前后菲律宾蛤仔结合水、糖原、甘油、脂肪含量的变化
从表1可见,与越冬期前相比,越冬期后,蛤仔结合水含量较略有降低,但无显著性变化 (P>0.05),糖原含量和脂肪含量显著下降 (p<0.05),而甘油含量则显著升高 (p<0.05)。

表1 越冬期前后菲律宾蛤仔结合水、糖原、甘油、脂肪含量的变化Tab.1 Changes in contents of hydration water, glycogen,glycerol and fat in Manila clam Ruditapes philippinarum before and after overwintering
2.2 越冬期前后蛤仔脂肪酸含量变化
蛤仔越冬期前后脂肪酸含量变化如表2所示,在蛤仔体内共检测出19种脂肪酸,其中饱和脂肪酸 (SFA)3种,单不饱和脂肪酸 (MUFA)4种,多不饱和脂肪酸 (PUFA)12种。在越冬期后,其中 C18∶0、 C20∶4n-6、 C22∶5n-6、 C22∶5n-3含量较越冬期前显著降低 (p<0.05), C20∶5n-3(EPA) 含量则显著升高 (p<0.05)。
2.3 越冬期前后蛤仔氨基酸含量变化
蛤仔越冬期前后氨基酸含量变化如表3所示,在蛤仔体内共检测出16种氨基酸,在越冬期后,其中赖氨酸、谷氨酸和丙氨酸含量较越冬期前显著升高 (p<0.05),而其他氨基酸含量无显著性变化(P>0.05),且氨基酸总量也无显著性变化 (P>0.05)。
3 讨论
当外界温度下降时,变温动物为防止体液过冷对自身产生危害,其体温调节系统会作出反应,该系统主要通过抗寒物质发挥作用,如结合水、甘油、小分子糖、冰核成剂和抗冻蛋白等[12,16]。
3.1 结合水
通常在冬季时,生物会排出体内部分游离水以降低结冰的危险,而结合水无渗透活性,增加结合水的含量有利于抗寒物质的积累,从而降低生物的过冷却点,增强生物的抗寒能力。越冬意蜂Apis mellifera Ligustica Spinola体内结合水含量随温度下降而升高,之后随着温度升高,在3月时其结合水含量又恢复至越冬前水平,这种变化与其过冷却能力呈正向关[17]。桃小食心虫结茧越冬期含水量无显著变化,是由于其自由水含量能降低过冷却点,而裸露幼虫体内含水量过高可能是造成其无法过冬的原因[6]。研究发现,福寿螺入冬后体内一部分自由水转化成结合水,这种变化过程可能与自由水含量降低有利于耐受低温环境有关[13]。对散大蜗牛Helix aspersa的研究也发现,其在冬季体内的结合水含量高于秋季[18]。本研究中,蛤仔在越冬期前后结合水含量无显著变化,可能与采样期 (3月)海水温度已升高蛤仔体内结合水含量恢复至越冬前水平有关,但这尚需进一步研究证实。

表2 越冬期前后菲律宾蛤仔脂肪酸含量变化Tab.2 Changes in fatty acid content of Manila clam Ruditapes philippinarum before and after overwintering period %
3.2 生化物质成分
越冬生物通常会在体内合成和积累抗寒物质,脂肪、糖类、甘油等物质可以与酶及其他蛋白质共同作用起到保护生物系统的作用[6,17]。脂肪、糖原和蛋白质分解成的小分子化合物也可直接参与抗寒作用[19]。如脂肪水解出的甘油在生物体内发挥多种作用,不仅能够储存饱和脂肪酸并供机体能量代谢需要,还可以结合糖提供能量,并可以作为PUFA临时的储存库[20-21]。糖原分解的葡萄糖也可为机体提供能量,一些生物体内的小分子糖如海藻糖和山梨醇等是较好的抗寒物质。这些小分子物质的积累还能改变溶质浓度,降低生物的过冷却点。游离氨基酸可以参与体内能量代谢的过程,也是体内蛋白质、酶和一些激素的组成成分,在细胞渗透压调节中也可发挥主要作用,已有研究表明,蛤蜊Macoma balthica体内游离氨基酸的种类变化与温度改变存在某种相关性[22]。因此,生物体内的这些生化物质成分可以通过直接或者间接过程参与对低温的耐受过程,在机体抗寒系统中发挥作用。
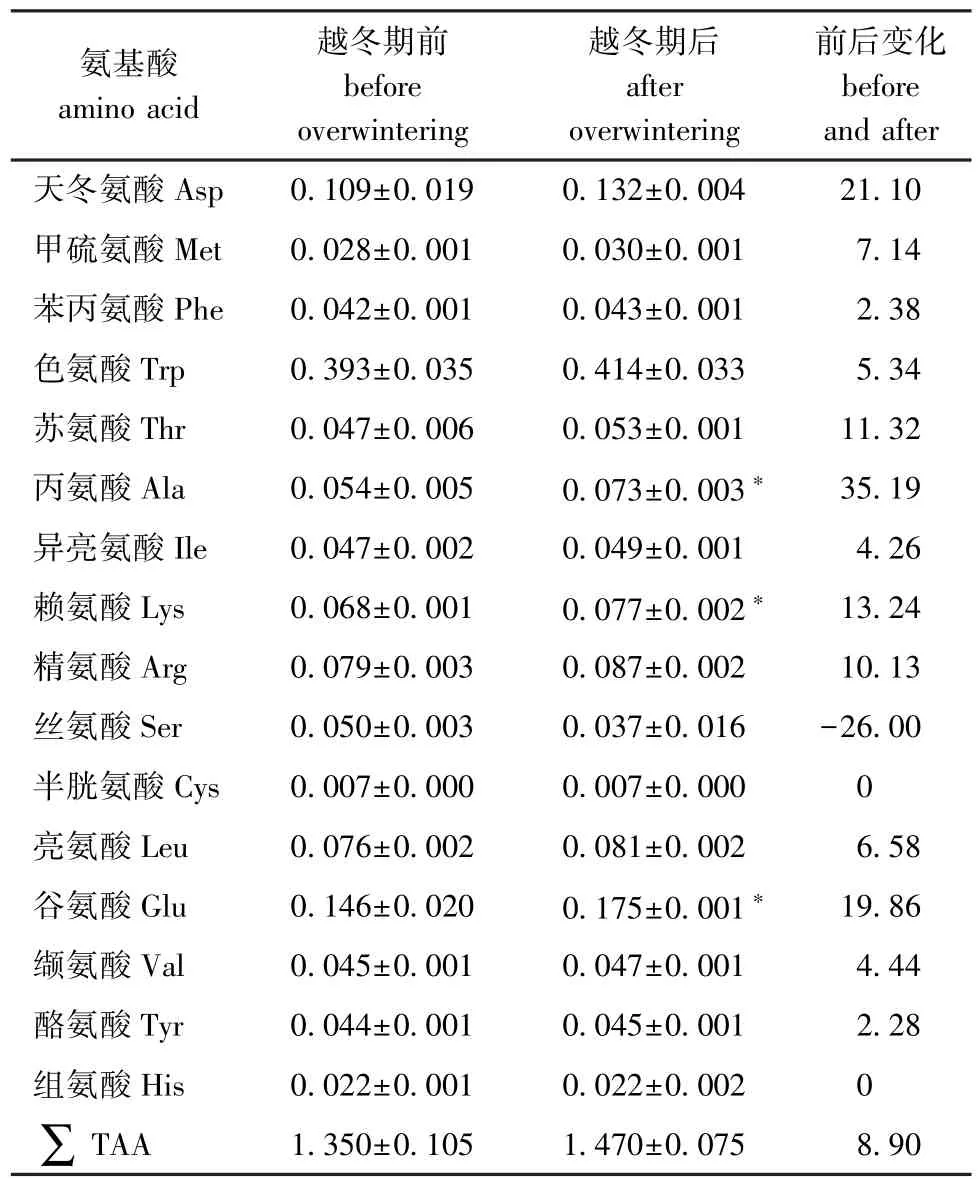
表3 越冬期前后菲律宾蛤仔氨基酸含量变化Tab.3 Changes in amino acid content of Manila clam Ruditapes philippinarum before and after overwintering period %
3.2.1 糖原 糖原在生物体内是一种重要的能量储备物质,温度下降时,机体内的糖原会停止积累并开始分解。除了作为能源物质外,糖原分解生成的葡萄糖及其转换的海藻糖等小分子碳水化合物,可以调节胞内外渗透压,从而稳定蛋白质的结构,减少细胞损伤,海藻糖作为越冬昆虫体内的冷冻保护剂已被多个研究证实[17,23-24]。 Li等[25]研究发现,美国白蛾Hyphantria cunea在1—3月糖原含量低于12月,而其海藻糖在1—3月却高于12月,推断糖原含量降低和海藻糖含量升高有利于机体抗寒能力的增强。在对桃小食心虫幼虫的研究中也发现,在入冬后其体内糖原含量逐渐降低[7]。郭靖等[13]对福寿螺的研究发现,其糖原含量在冬季时高于秋季,可能与其为入冬进行能量储备有关。在对其他水生生物的研究中也发现类似结果,山东沿海牡蛎在进入冬季后糖原含量升高,在2月又出现降低的趋势,表明牡蛎在越冬期前进行糖原储备并在越冬过程中通过消耗糖原来应对低温环境[26-27]。本研究中,蛤仔糖原含量在越冬期后显著降低,初步证实了蛤仔体内的糖原在其越冬过程中发挥了重要的作用。
3.2.2 甘油 甘油 (多元醇)在水中溶解度高,无毒且相容性好,对酶或代谢过程影响较小,且能自由跨膜,是良好的抗寒保护物质,它的合成是昆虫应对环境因子 (特别是低温)的一种固有模式;而且多元醇的羟基能与水结合以减少水分流动性,保证体内正常代谢的进行,在昆虫越冬期间起低温保护剂的作用,其含量高低与昆虫的抗寒能力呈正相关[17,28]。甘油一方面可以抑制冰成核剂的生成防止体内水分冷冻结晶;另一方面可以降低生物体液的结冰点, 增强其对寒冷的耐受能力[11,29-30]。对松阿扁叶蜂幼虫Acantholyda posticalis Matsumura[31]和亚洲玉米螟Ostrinia furnacalis[32]的研究发现,冬季时这两种昆虫体内甘油含量增加。对福寿螺的研究中也得到了类似结果,冬季时福寿螺体内甘油含量高于秋季,对其进行冷驯化后其体内甘油含量也会逐渐升高,表明甘油在福寿螺的低温耐受过程中发挥重要作用[11,13]。本研究中,越冬期后蛤仔体内甘油含量显著升高,进一步证实了甘油在蛤仔等贝类体内的耐低温耐机制中发挥了作用,但具体的作用途径还需要进一步研究。
3.2.3 脂肪 脂肪不仅是贝类和昆虫冬季代谢的主要能量来源,还是生物体内重要的抗寒物质[23,33]。在越冬期间,生物体内的游离脂肪能被水解为甘油和脂肪酸,这些物质可提高机体的抗寒能力;脂肪分解产物作为生物膜的重要组成成分,在维持细胞的正常生理功能方面具有重要的作用,尤其是在寒冷的海水环境中,它能维持生物膜正常的流动性和稳定性[34]。研究表明,越冬期间昆虫脂肪含量降低、甘油含量增加有利于增强其抗寒能力[35]。郑怀平等[36]发现,扁玉螺Glossaulax didyma在冬季时其体内脂肪含量显著降低。对长牡蛎研究发现,越冬期内其总脂肪含量先降低后升高,而甘油三脂含量先升高后降低,表明体内脂肪的转化过程是贝类对低温环境的一种反应机制[37]。本研究中,蛤仔在越冬期后同样出现了脂肪含量降低和甘油含量升高的变化过程,可以推测,这两种物质间的变化与抗寒能力存在相互关系,但还需要进一步验证,本结果初步证实了脂肪及其分解产物甘油在贝类越冬过程中具有重要的作用。
3.2.4 脂肪酸 贝类体内脂肪酸含量受物种、温度、饵料、季节等因素影响[37-38]。对生物来说,机体在温度改变时,其饱和脂肪酸和不饱和脂肪酸含量也会随之变化,这种变化与细胞膜流动性有关,如n-3脂肪酸对于维持细胞膜的流动性具有重要作用[37,39-42]。 西伯利亚蝗 Aeropus sibiricus在温度升高时,其体内饱和脂肪酸含量升高,不饱和脂肪酸含量降低,细胞膜流动性减弱[43]。此外,脂肪酸也可以提高细胞因子的产生,增强巨噬细胞的吞噬能力,尤其是n-3系列高度不饱和脂肪酸对鱼类免疫能力具有重要的调节作用[44]。本研究中发现,蛤仔的饱和脂肪酸 (C18∶0)在越冬期后显著降低,而不饱和脂肪酸 (n-3脂肪酸、EPA)含量在越冬期后显著高于越冬期前。这一结果与对澳洲鲍Haliotis laevigata和Haliotis rubra的研究结果一致,在进入冬季时,随温度降低其肌肉组织中n-3脂肪酸含量升高,SFA含量下降[40]。上述研究结果表明,贝类体内的脂肪酸对其低温耐受性具有重要作用。n-3脂肪酸含量的升高可能与蛤仔进入越冬期后,体内免疫酶活性和细胞流动性减弱有关,n-3脂肪酸一方面可以提高蛤仔的免疫能力,另一方面可以在温度降低时保持细胞膜的流动性、降低组织和细胞损伤的程度,因此,n-3脂肪酸可能是蛤仔体内一种重要的耐低温组分。
3.2.5 氨基酸 生物体内的氨基酸能够参与机体对低温的耐受过程[34]。如金针瘿蚊 Eurosta soliddaginis幼虫的线粒体在冬季低温条件下可以利用脯氨酸氧化提供能量;昆虫在冬季低温环境下能量代谢途径发生了转变,主要通过无氧酵解提供能量,且体内多肽和蛋白质降解产物以丙氨酸为主[45]。研究发现,松阿扁叶蜂和兴凯湖红鳍原鲌Cultrichthys erythropterus体内丙氨酸含量均在冬季出现显著升高的现象[46-47]。在极地海洋鱼体内的温滞蛋白中有60%左右的氨基酸残基是丙氨酸,该蛋白的主要功能是吸附潜在的晶核,其含有的丙氨酸侧链甲基具有疏水屏障的作用,可以阻止水分子同晶核结合[48]。因此,极地海洋鱼类体内的游离丙氨酸可能参与屏蔽晶核的作用,以降低生物体冰点和过冷却点,提高其对低温的适应能力。本研究中,蛤仔体内的丙氨酸在越冬期后显著升高,表明丙氨酸在蛤仔的越冬过程中可能也具有降低冰点和冷冻点的作用。动物体内的谷氨酰胺在谷氨酰胺酶的作用下,能水解成谷氨酸和氨调节体内的酸碱平衡,以维持组织和细胞的正常代谢[49]。Duman等[50]在额斑黄胡蜂Vespula maculifrons中提取的冰核蛋白中谷氨酸残基占20%,冰核蛋白可以诱导昆虫在遭遇低温前先进行胞外结冰,从而减轻细胞损伤和渗透压胁迫。本研究中蛤仔体内谷氨酸含量在越冬期后显著升高,表明其可能参与到蛤仔的耐低温过程,但蛤仔体内的谷氨酸是否由谷氨酰胺代谢途径提供以及其在耐低温过程中的具体作用机制还需进一步研究证实。
4 结论
本研究结果发现,在越冬期前后蛤仔体内脂肪、糖原、甘油、脂肪酸和氨基酸含量均发生了显著变化,这些变化与一些昆虫及水生生物在越冬过程中的体内生化物质的变化相一致,表明蛤仔体内可能具有类似的耐低温机制,但其具体的作用机制和途径还需进一步地深入研究证实。本研究结果为贝类的耐低温研究提供了基础数据,同时也可为菲律宾蛤仔越冬期管理提供一定的科学依据。
[1] 闫喜武.菲律宾蛤仔养殖生物学、养殖技术与品种选育[D].青岛:中国科学院研究生院(海洋研究所),2005.
[2] 林笔水,吴天明,黄炳章.温度和盐度对菲律宾蛤仔稚贝生长及发育的影响[J].水产学报,1983,7(1):15-23.
[3] 范超,温子川,霍忠明,等.盐度胁迫对不同发育时期菲律宾蛤仔生长和存活的影响[J].大连海洋大学学报,2016,31(5):497-504.
[4] 杨东敏,张艳丽,丁鉴锋,等.高温、低盐对菲律宾蛤仔免疫能力的影响[J].大连海洋大学学报,2017,32(3):302-309.
[5] 黄国洋,王荫长,尤子平.黄地老虎耐寒机理初探[J].浙江林学院学报,1990,7(2):140-146.
[6] 王鹏,于毅,门兴元,等.越冬过程中桃小食心虫结茧和裸露幼虫体内耐寒性物质动态变化[J].昆虫学报,2011,54(3):279-285.
[7] 景晓红,康乐.昆虫耐寒性的测定与评价方法[J].昆虫知识,2004,41(1):7-10.
[8] 钟景辉,张飞萍,江宝福,等.不同地区松突圆蚧耐寒性的研究[J].中国生态农业学报,2010,18(1):117-122.
[9] 纪灵.邱家地热越冬养殖鱼、贝类死亡原因分析及对策[J].海洋科学,1997(2):72-73.
[10] 刘文广,李琪,高凤祥,等.长牡蛎繁殖周期、生化成分的季节变化与环境因子的关系[J].热带海洋学报,2011,30(3):88-93.
[11] Matsukura K,Tsumuki H,Izumi Y,et al.Changes in chemical components in the freshwater apple snail,Pomacea canaliculata(Gastropoda:Ampullariidae),in relation to the development of its cold hardiness[J].Cryobiology,2008,56(2):131-137.
[12] 赵本良,章家恩,罗明珠,等.福寿螺的过冷却研究[J].生态学报,2012,32(5):1538-1545.
[13] 郭靖,徐武兵,章家恩,等.雌雄福寿螺耐寒能力的差异[J].应用生态学报,2014,25(6):1791-1798.
[14] Loomis S H,Carpenter J F,Crowe J H.Identification of strombine and taurine as cryoprotectants in the intertidal bivalve Mytilus edulis[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,1988,943(2):113-118.
[15] 仵均祥.麦红吸浆虫滞育与化学物质变化研究[D].杨凌:西北农林科技大学,2002.
[16] Gehrken U,Strømme A,Lundheim R,et al.Inoculative freezing in overwintering tenebrionid beetle,Bolitophagus reticulatus Panz[J].Journal of Insect Physiology,1991,37(9):683-687.
[17] 常志光,高洪学,葛英,等.越冬意蜂体内水分、蛋白质、脂肪的变化与抗寒性的关系[J].中国蜂业,2007,58(2):17.
[18] Ansart A,Vernon P,Daguzan J.Elements of cold hardiness in a littoral population of the land snail Helix aspersa(Gastropoda:Pulmonata)[J].Journal of Comparative Physiology B,2002,172(7):619-625.
[19] 孙绪艮,李恕廷,郭慧玲.桑尺蠖越冬幼虫的耐寒性研究[J].蚕业科学,2000,26(3):129-133.
[20] Napolitano G E,Ratnayake W M N,Ackman R G.Fatty acid components of larval Ostrea edulis(L.):importance of triacylglycerols as a fatty acid reserve[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1988,90(4):875-883.
[21] Swift M L.Phosphono-lipid content of the oyster,Crassostrea virginica,in three physiological conditions[J].Lipids,1977,12(5):449-451.
[22] Sokolowski A,Wolowicz M,Hummel H.Free amino acids in the clam Macoma balthica L.(Bivalvia,Mollusca)from brackish waters of the southern Baltic Sea[J].Comparative Biochemistry and Physiology Part A:Molecular& Integrative Physiology,2003,134(3):579-592.
[23] 张永普,应雪萍,贾守菊,等.橄榄蚶含水量、肥满度和生化成分的周年变化[J].温州大学学报:自然科学版,2008,29(6):26-31.
[24] 曾志南,李复雪.青蛤软体部重量和生化组分含量的季节变化[J].热带海洋,1990,9(2):8-15.
[25] Li Y P,Goto M,Ito S,et al.Physiology of diapause and cold hardiness in the overwintering pupae of the fall webworm Hyphantria cunea(Lepidoptera:Arctiidae)in Japan[J].Journal of Insect Physiology,2001,47(10):1181-1187.
[26] Linehan L G,O’Connor T P,Burnell G.Seasonal variation in the chemical composition and fatty acid profile of Pacific oysters(Crassostrea gigas)[J].Food Chemistry,1999,64(2):211-214.
[27] 张智翠,薛长湖,李兆杰.山东沿海牡蛎糖原、游离氨基酸及重金属含量的季节变化[J].食品研究与开发,2006,27(5):6-8.
[28] Baust J G.Environmental triggers to cold hardening[J].Comparative Biochemistry and Physiology Part A:Physiology,1982,73(4):563-570.
[29] Leather S R,Walters K F A,Bale J S.The ecology of insect overwintering[M].Cambridge:Cambridge University Press,1995.
[30] Lee R E Jr,Denlinger D L.Insects at low temperature[M].New York:Chapman & Hall,1991.
[31] 梁中贵,孙绪艮.松阿扁叶蜂越冬幼虫体内氨基酸含量的测定分析[J].华东昆虫学报,2007,16(4):281-284.
[32] Goto M,Sekine Y,Outa H,et al.Relationships between cold hardiness and diapause,and between glycerol and free amino acid contents in overwintering larvae of the oriental corn borer,Ostrinia furnacalis[J].Journal of Insect Physiology,2001,47(2):157-165.
[33] 闫喜武,姚托,张跃环,等.冬季饥饿再投喂对菲律宾蛤仔生长、存活和生化组成的影响[J].应用生态学报,2009,20(12):3063-3069.
[34] 陈永杰.桑螟越冬幼虫抗寒性及有效积温的研究[D].泰安:山东农业大学,2004.
[35] 徐淑,周兴苗,曾俊,等.二化螟不同年龄段越冬幼虫的耐寒性比较[J].植物保护学报,2009,36(1):11-15.
[36] 郑怀平,高健.扁玉螺蛋白质、脂肪含量的季节变化[J].海洋科学,2002,26(4):52-55.
[37] Pazos A J,Ruíz C,García-Martin O,et al.Seasonal variations of the lipid content and fatty acid composition of Crassostrea gigas cultured in E1 Grove,Galicia,N.W.Spain[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1996,114(2):171-179.
[38] Copeman L A,Parrish C C.Lipids classes,fatty acids,and sterols in seafood from Gilbert Bay,Southern Labrador[J].Journal of Agricultural and Food Chemistry,2004,52(15):4872-4881.
[39] Murphy K J,Mooney B D,Mann N J,et al.Lipid,FA,and sterol composition of New Zealand green lipped mussel(Perna canaliculus)and Tasmanian blue mussel(Mytilus edulis)[J].Lipids,2002,37(6):587-595.
[40] Su X Q,Antonas K,Li D,et al.Seasonal variations of total lipid and fatty acid contents in the muscle of two Australian farmed abalone species[J].Journal of Food Lipids,2006,13(4):411-423.
[41] Fraenkel G,Hopf H S.The physiological action of abnormally high temperatures on poikilothermic animals I.Temperature adaptation and the degree of saturation of the phosphatides[J].Biochemical Journal,1940,34(7):1085-1092.
[42] Bell M V,Henderson R J,Sargent J R.The role of polyunsaturated fatty acids in fish[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1986,83(4):711-719.
[43] 李娟.温度变化对西伯利亚蝗体内生理生化物质含量变化影响及HSP70 cDNA部分片段克隆研究[D].乌鲁木齐:新疆师范大学,2015.
[44] 左然涛,麦康森,徐玮,等.脂肪酸对鱼类免疫系统的影响及调控机制研究进展[J].水产学报,2015,39(7):1079-1088.
[45] 李毅平,龚和.昆虫低温生物学:Ⅰ.昆虫耐冻的生理生化适应机制[J].昆虫知识,1998,35(6):364-369.
[46] 梁中贵,孙绪艮,张同心,等.松阿扁叶蜂越冬幼虫体内氨基酸含量变化与抗寒性的关系[J].山东农业大学学报:自然科学版,2003,34(4):467-470.
[47] 陈清华,刘伟,唐富江,等.兴凯湖红鳍原鲌消化酶活力和肌肉氨基酸组成的季节变化[J].水产学杂志,2012,25(4):50-55.
[48] 孙绪艮,王兴华,李恕廷.昆虫的耐寒机制及其研究进展[J].山东农业大学学报:自然科学版,2001,32(3):393-396.
[49] 王洪荣,季昀.氨基酸的生物活性及其营养调控功能的研究进展[J].动物营养学报,2013,25(3):447-457.
[50] Duman J G,Morris J P,Castellino F J.Purification and composition of an ice nucleating protein from queens of the hornet,Vespula maculata[J].Journal of Comparative Physiology B,1984,154(1):79-83.
Changes in biochemical composition of Manila clam Ruditapes philippinarum before and after overwintering
YANG Dong-min1, WANG Hua-min1, DING Jian-feng1,2, YANG Feng1,2, YAN Xi-wu1,2
(1.College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, China; 2.Engineering Research Center of Shellfish Culture and Breeding in Liaoning Province, Dalian 116023, China)
The contents of hydration water, glycogen, glycerol, fat, fatty acid and amino acid were determined in wild Manila clam Ruditapes philippinarum with body weight of(15.45±1.00)g collected from Jinshitan Bay in northern China in December(pre wintering)and in March(post wintering)to study cold resistance mechanism of Manila clam.The results showed that there were significantly lower contents of glycogen and fat and significantly higher glycerol levels in clams after overwintering(p<0.05).The contents of fatty acid including C18:0, C20:4n-6,C22:5n-6and C22:5n-3were significantly decreased after winter(p<0.05), while the content of C20:5n-3(EPA)was significantly increased after winter(p<0.05).The contents of amino acid including isoleucine, glutamic acid and lysine were significantly increased in the clam after overwinter(p<0.05).These findings indicated that there was a close relationship between the clam biochemical composition and cold resistance,and that provide theoretical reference for the winter management of clam.
Ruditapes philippinarum; hydration water; glycogen; fatty acid; amino acid
5968.31
A
10.16535/j.cnki.dlhyxb.2017.06.010
2095-1388(2017)06-0694-06
2017-03-07
辽宁省教育厅科研计划项目 (L2014276)
杨东敏 (1990—),女,硕士研究生。E-mail:ydm9110@163.com
丁鉴锋 (1977—),男,博士,副教授。E-mail:jfding@dlou.edu.cn

