基于纹党参鲜药材的产地加工炮制一体化技术研究
强思思,高霞,马玉玲,郑晓萍,胡芳弟,,李应东
1.兰州大学药学院,甘肃 兰州 730000;2.北京中医药大学第三附属医院,北京 100029;3.甘肃中医药大学,甘肃 兰州 730000
论著·中药研究与开发
基于纹党参鲜药材的产地加工炮制一体化技术研究
强思思1,2,高霞1,马玉玲1,郑晓萍1,胡芳弟1,3,李应东3
1.兰州大学药学院,甘肃 兰州 730000;2.北京中医药大学第三附属医院,北京 100029;3.甘肃中医药大学,甘肃 兰州 730000
目的 研究不同干燥过程对纹党参饮片有效成分的影响,确定最佳的基于纹党参鲜药材的产地初加工与炮制一体化工艺。方法 对采收期的纹党参鲜药材分别采用3种加工炮制方法:①烘箱80 ℃烘至含水量为药材原始含水量不同百分比(30%~100%)时,分别取出切片,50 ℃烘干,制得8个饮片样品(XⅠYP1~8)。②鲜纹党参直接在不同温度(50~120 ℃)分别烘至含水量为药材原始含水量的50%时,取出切片,50 ℃烘干,制得8个饮片样品(XⅡYP1~8)。③纹党参干药材,闷润,切片,自然晾干,制得传统饮片。采用HPLC测定各样品中党参炔苷和苍术内酯Ⅲ,苯酚-硫酸法和比色法分别测定多糖及总黄酮含量,并同时测定醇浸出物、水浸出物含量。结果 饮片XⅠYP3的醇浸出物(55.36%)、水浸出物(54.91%)和苍术内酯Ⅲ(10.95 µg/g)含量均高于其他饮片。结论 优选的工艺为:80 ℃烘至含水量50%,切片,干燥。获得的一体化加工工艺较传统方法省时、省力。制得的饮片活性成分含量高。
鲜纹党参;产地加工;炮制;一体化
中药饮片的质量优劣直接影响着中药材资源的科学应用及临床用药的安全性和有效性。当前中药饮片生产企业开始提倡饮片生产的规范化,以减少饮片污染,从而全面提升饮片质量,减少对药材资源的浪费,推动中药饮片向品牌化、标准化、产业化方向发展[1]。中药产地加工炮制一体化是将药材产地初加工与炮制结合在一起的加工技术,可缩短加工时间、能耗,减少内在成分的流失,并能加快饮片上市时间,具有良好的产业化前景[2]。
纹党参(素花党参)Codonopsis pilosula Nannf. var.modesta(Nannf.)L.T.Shen主产于甘肃文县,根条粗实,具狮子盘头、皮松肉甜等特点,断面有细横纹,通身有“螺纹”[3-4]。纹党参产地初加工程序如下:药材原料→淘洗→上串→晾晒→揉搓→发汗→揉搓→清洗→整形(修枝)→晾晒至干燥成品[5]。饮片的制备过程需要二次闷润[6]。整个产地初加工+炮制过程费时、耗力[7],且天气等情况对饮片品质的影响也比较大[8],揉搓过程中稍有不慎,可能出现出油现象(油条)[9]。研究一种简单可行的基于纹党参鲜药材产地加工一体化的饮片加工技术,是提高和改善党参饮片品质迫切需要解决的问题。
党参多糖、党参总黄酮、水浸出物、醇浸出物具有显著的生理活性。现代药理学研究表明,党参水提或醇提液具有降压作用,党参水浸液对化学药品诱导的小鼠学习记忆障碍有明显改善作用[10],并具有减轻应激性溃疡大鼠胃黏膜溃疡指数[11]和增加血浆中皮质酮含量以及抗高温作用[12]。党参多糖具有抗氧化[13]、增强免疫[14-15]、抗肿瘤[16-17]、抗疲劳[18]及改善学习记忆[19-20]等作用。党参黄酮类化合物具有明显的抗疲劳功效[11]。另外党参炔苷显示抗胃溃疡活性[10-11],党参中的苍术内酯Ⅲ具有明显的抗炎活性[10]。
2015年版《中华人民共和国药典》关于党参的定量评价仅有醇浸出物的含量一项指标[6],显然存在着一定的局限性。为了建立一种简单、可行的能够全面改善党参饮片质量标准的产地加工炮制一体化工艺,本研究从纹党参鲜药材入手,以饮片醇浸出物含量、水浸出物含量及多糖、总黄酮、党参炔苷和苍术内酯Ⅲ含量为指标,综合优选纹党参饮片的产地加工炮制一体化工艺。
1 仪器与试药
Waters e2695系列高效液相色谱仪,配备Waters 2998二极管阵列检测器及Empower 3色谱管理软件;紫外分光光度计(UV-1700,Shimadzu);电热鼓风干燥箱(DHG 9070A,上海一恒科学仪器有限公司);多功能粉碎机(750T,上海市浦恒信息科技有限公司);恒温水浴锅(HH-2,常州国华电器有限公司);分析天平(CPA225D,赛多利斯科学仪器);旋转蒸发仪(Eyela OSB-2100,日本);超声波清洗仪(KQ-400KDE,常州诺基仪器有限公司)。
对照品党参炔苷(批号MUST-11111901)、苍术内酯Ⅲ(批号MUST-11122211)、葡萄糖(批号130407)、芦丁(批号05-1001)均由上海中药标准化研究中心提供,纯度均为98%;甲醇、乙腈为色谱纯,乙醇为分析纯,水为重蒸馏去离子水。
纹党参药材采自甘肃省文县中寨镇大海村,经兰州大学药学院周印所教授鉴定为纹党参Codonopsis pilosula Nannf.var.modesta(Nannf.)L.T. Shen的根。
2 方法与结果
2.1 加工炮制方法
2.1.1 新工艺Ⅰ饮片(XⅠYP)的制备 取同一批大小均匀的鲜纹党参,均分为8份,每份2.0 kg,在80 ℃条件下分别烘至含水量为药材原始含水量的30%、40%、50%、60%、70%、80%、90%、100%时,取出切片(厚度为3.0 mm),50 ℃烘干,制得8个饮片样品(XⅠYP1~XⅠYP8)。每个样品平行做3份。加工特征描述及所需时间见表1。
2.1.2 新工艺Ⅱ饮片(XⅡYP)的制备 取同一批大小均匀的鲜纹党参,均分为8份,分别在50、60、70、80、90、100、110、120 ℃条件下烘至含水量为药材原始含水量的50%,取出切片(厚度为3.0 mm),50 ℃烘至干燥,制得8个饮片样品(XⅡYP1~XⅡYP8)。每个样品平行做3份。加工特征描述及所需时间见表1。其中新工艺Ⅱ中XⅡYP4的加工方法与新工艺Ⅰ中XⅠYP3相同。
2.1.3 传统纹党参饮片(TDYP)的制备 取同一批纹党参鲜药材20 kg,按药材原料→淘洗→上串→晾晒→揉搓→发汗→揉搓→清洗→整形(修枝)→晾晒至干燥→闷润→切厚片(3.0~5.0 mm)→干燥的传统工艺制备饮片[6]。加工特征描述及所需时间见表1。
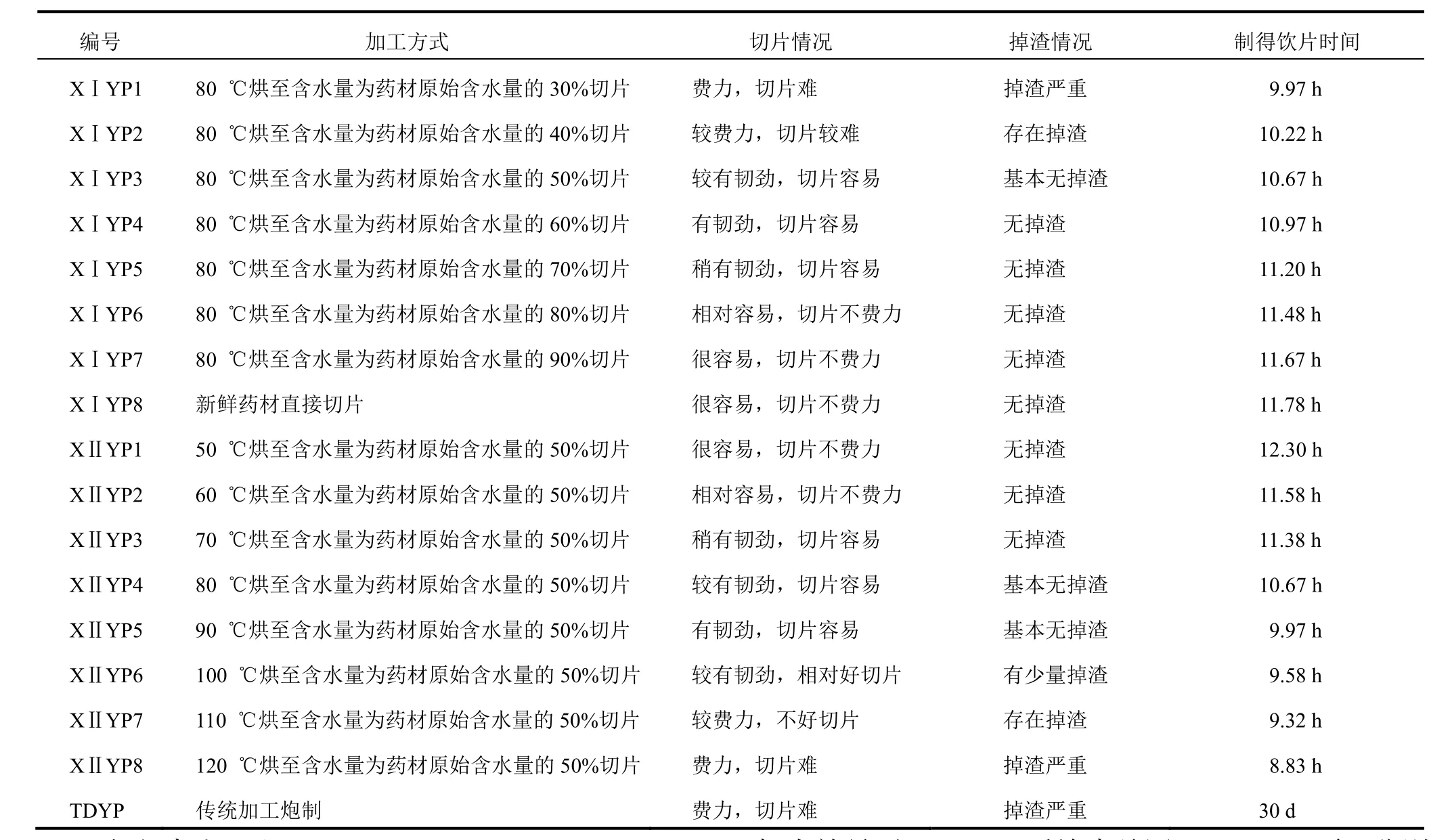
表1 鲜纹党参产地加工炮制一体化工艺试验特征描述
2.2 指标成分测定
2.2.1 醇浸出物和水浸出物含量测定 按2015年版《中华人民共和国药典》附录方法分别测定样品中醇浸出物和水浸出物的含量。
2.2.2 多糖含量测定
2.2.2.1 样品溶液的制备 精密称取2 g纹党参饮片粉末(过40目筛),脱脂(95%乙醇加热回流2次,每次1 h);弃去醇提液,药渣干燥后,加12、10、8倍量水煎煮,煎煮3次,每次40 min。合并提取液,浓缩至干,加水定容至10 mL,过滤,得样品溶液,于4 ℃放置,备用。
2.2.2.2 标准曲线的制备 精密称取葡萄糖对照品1 mg,置10 mL容量瓶中,加水定容至刻度,配成浓度为0.1 g/L的葡萄糖对照品贮备液。精密移取0.00、0.20、0.40、0.80、1.00 mL对照品贮备液于试管中,用蒸馏水补足至2 mL,加入5%苯酚溶液1 mL,摇匀,迅速加入浓硫酸5 mL,摇匀,放置10 min。于40 ℃水浴中保温15 min,取出,冷却至室温,490 nm处测吸光度。平行测定3次。以质量浓度为横坐标,平均吸光度(A)为纵坐标,绘制标准曲线,得回归方程Y=3.974 4X-0.001 3,r=0.995 6。表明在0.000~0.051 mg范围内有良好的线性关系。
2.2.2.3 样品测定 精密量取“2.2.2.1”项下样品溶液25 µL,蒸馏水定容至10 mL。每个样品移取150 µL,加水补足至2.0 mL,后续步骤同“2.2.2.2”项。分别测定3次,计算平均吸光度,根据标准曲线计算样品中多糖的含量[21]。
2.2.3 总黄酮含量测定
2.2.3.1 对照品溶液的制备 精密称取芦丁对照品5 mg,置25 mL容量瓶中,加适量甲醇溶解,并以甲醇定容至刻度,摇匀,得芦丁标准品储备液,于4 ℃放置,备用。
2.2.3.2 供试品溶液的制备 精密称取2 g样品粉末(过40目筛),置圆底烧瓶中,加10、8倍量甲醇,回流提取2次,每次40 min,过滤,滤液浓缩,再定容至10 mL。
2.2.3.3 标准曲线的制备 精密量取芦丁对照品0.0、1.0、2.0、3.0、4.0、5.0、6.0 mL置于25 mL容量瓶中,各加水至6.0 mL,加5%亚硝酸钠溶液1 mL,摇匀,放置6 min,加10%硝酸铝1 mL,摇匀,再放置6 min,加4%氢氧化钠溶液10 mL,再加水至刻度,摇匀,放置15 min。以无芦丁对照品溶液的阴性试剂为空白,于波长505 nm处测定吸光度,平行测定3次。以平均吸光度(A)为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程Y=3.172 5X+0.002 3,r=0.996 7。表明在0.002 5~0.100 0 g/L范围内有良好的线性关系[22]。
2.2.3.4 样品测定 精密移取“2.2.3.2”项下供试品溶液1 mL,蒸干,加2 mL蒸馏水复溶,精密移取0.5 mL,置25 mL容量瓶中,后续步骤同“2.2.3.3”项,测定3次,计算平均吸光度,根据标准曲线计算各样品中总黄酮的含量。
2.2.4 党参炔苷含量测定
2.2.4.1 色谱条件 色谱柱:Diamonsil C18(250 mm× 4.6 mm,5 µm);流动相:乙腈-水(26∶74);流速:1 mL/min;柱温:30 ℃;检测波长:267 nm;进样量:10 µL。
2.2.4.2 标准曲线的建立 精密称取党参炔苷对照品1.18 mg,置于2 mL容量瓶中,加甲醇超声溶解并定容至刻度,配成浓度为0.590 g/L的党参炔苷对照品贮备液。贮备液以甲醇稀释,配制浓度为0.004 6、0.009 2、0.018 4、0.036 9、0.073 8、0.147 5、0.295 0、0.590 0 g/L的标准溶液,按“2.2.4.1”项下色谱条件测定。以峰面积为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程Y=9 337 428.638 9X+36 628.162 9,r=0.999 5。表明在0.004 6~0.590 0 g/L范围内有良好的线性关系[23-24]。
2.2.4.3 样品测定 取“2.2.3.2”项下制备的供试品溶液,摇匀,用0.45 µm微孔滤膜过滤后,取续滤液进样,根据色谱峰面积,代入回归方程计算。
2.2.5 苍术内酯Ⅲ含量测定
2.2.5.1 色谱条件 色谱柱:Diamonsil C18(250 mm× 4.6 mm,5 µm);流动相:乙腈-水(71∶29);流速:1 mL/min;柱温:30 ℃;检测波长:220 nm;进样量:10 µL。
2.2.5.2 对照品溶液的制备 精密称取苍术内酯Ⅲ对照品1.97 mg,置2 mL容量中瓶,加甲醇超声溶解并定容至刻度,配成浓度为0.985 g/L的苍术内酯Ⅲ对照品贮备液。贮备液以甲醇稀释,配制浓度为0.000 2、0.000 5、0.001 0、0.001 9、0.003 8、0.007 7、0.015 4、0.030 8 g/L的标准溶液,按“2.2.5.1”项下色谱条件测定。以峰面积为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程Y=51 897 794.508 3X-2413.159 3,r=0.999 6。表明在0.000 2~0.030 8 g/L范围内有良好的线性关系[25]。
2.2.5.3 样品测定 取“2.2.3.2”项下供试品溶液,摇匀,用0.45 µm微孔滤膜过滤,取续滤液进样,根据色谱峰面积,代入回归方程计算。
2.2.6 样品含量测定结果 各样品中指标成分含量测定结果见表2。饮片XⅠYP3的醇浸出物(55.36%)、水浸出物(54.91%)、多糖(27.29%)、总黄酮(1.58 mg/g)、党参炔苷(1.90 mg/g)和苍术内酯Ⅲ(10.95 µg/g)的含量均高于传统工艺制得的饮片,同时XⅠYP3的醇浸出物、水浸出物、苍术内酯Ⅲ的含量也高于其他工艺。因此,优选的工艺为:80 ℃烘至含水量为药材原始含水量的50%时切片。
表2 不同加工炮制方式的各样品指标成分含量测定结果(±s,n=3)
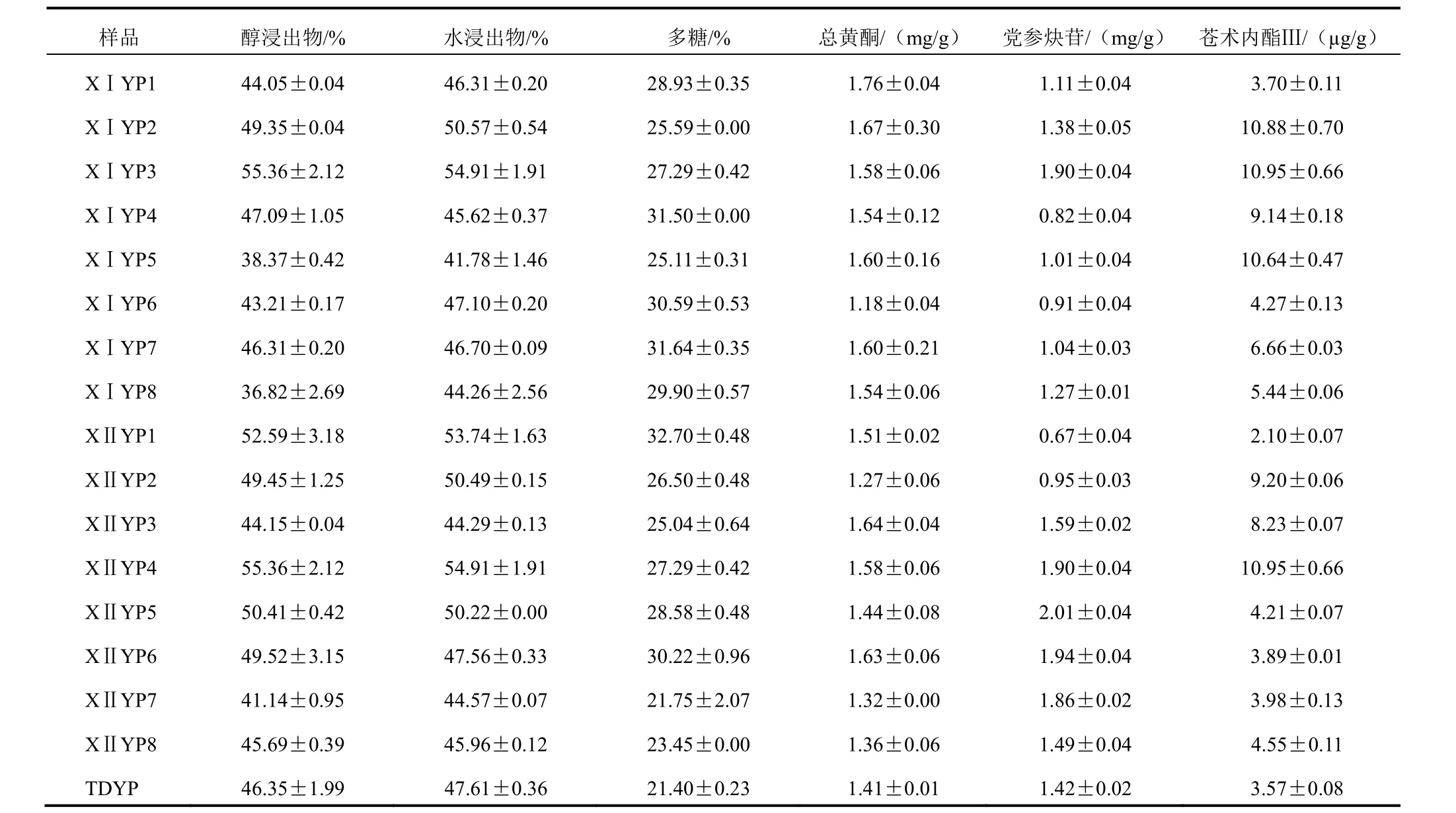
表2 不同加工炮制方式的各样品指标成分含量测定结果(±s,n=3)
样品 醇浸出物/% 水浸出物/% 多糖/% 总黄酮/(mg/g)党参炔苷/(mg/g) 苍术内酯Ⅲ/(µg/g)XⅠYP1 44.05±0.04 46.31±0.20 28.93±0.35 1.76±0.04 1.11±0.04 3.70±0.11 XⅠYP2 49.35±0.04 50.57±0.54 25.59±0.00 1.67±0.30 1.38±0.05 10.88±0.70 XⅠYP3 55.36±2.12 54.91±1.91 27.29±0.42 1.58±0.06 1.90±0.04 10.95±0.66 XⅠYP4 47.09±1.05 45.62±0.37 31.50±0.00 1.54±0.12 0.82±0.04 9.14±0.18 XⅠYP5 38.37±0.42 41.78±1.46 25.11±0.31 1.60±0.16 1.01±0.04 10.64±0.47 XⅠYP6 43.21±0.17 47.10±0.20 30.59±0.53 1.18±0.04 0.91±0.04 4.27±0.13 XⅠYP7 46.31±0.20 46.70±0.09 31.64±0.35 1.60±0.21 1.04±0.03 6.66±0.03 XⅠYP8 36.82±2.69 44.26±2.56 29.90±0.57 1.54±0.06 1.27±0.01 5.44±0.06 XⅡYP1 52.59±3.18 53.74±1.63 32.70±0.48 1.51±0.02 0.67±0.04 2.10±0.07 XⅡYP2 49.45±1.25 50.49±0.15 26.50±0.48 1.27±0.06 0.95±0.03 9.20±0.06 XⅡYP3 44.15±0.04 44.29±0.13 25.04±0.64 1.64±0.04 1.59±0.02 8.23±0.07 XⅡYP4 55.36±2.12 54.91±1.91 27.29±0.42 1.58±0.06 1.90±0.04 10.95±0.66 XⅡYP5 50.41±0.42 50.22±0.00 28.58±0.48 1.44±0.08 2.01±0.04 4.21±0.07 XⅡYP6 49.52±3.15 47.56±0.33 30.22±0.96 1.63±0.06 1.94±0.04 3.89±0.01 XⅡYP7 41.14±0.95 44.57±0.07 21.75±2.07 1.32±0.00 1.86±0.02 3.98±0.13 XⅡYP8 45.69±0.39 45.96±0.12 23.45±0.00 1.36±0.06 1.49±0.04 4.55±0.11 TDYP 46.35±1.99 47.61±0.36 21.40±0.23 1.41±0.01 1.42±0.02 3.57±0.08
2.3 验证试验
取同一批大小均匀的鲜纹党参,精密称取1.0 kg。按优选的工艺,即鲜纹党参药材80 ℃烘至含水量为药材原始含水量的50%,取出切片(厚度为3.0 mm),50 ℃烘干得饮片,平行制备3份。按“2.2”项下各指标成分含量测定方法进行测定,结果见表3。按优选工艺制备的饮片中各成分含量与方法学研究时的饮片XⅠYP3及XⅡYP4结果基本一致。与传统工艺相比,各指标成分含量均有所增加,指标变化率见表3。变化率(%)=(新工艺饮片中含量-传统饮片中含量)÷传统饮片中含量×100%。
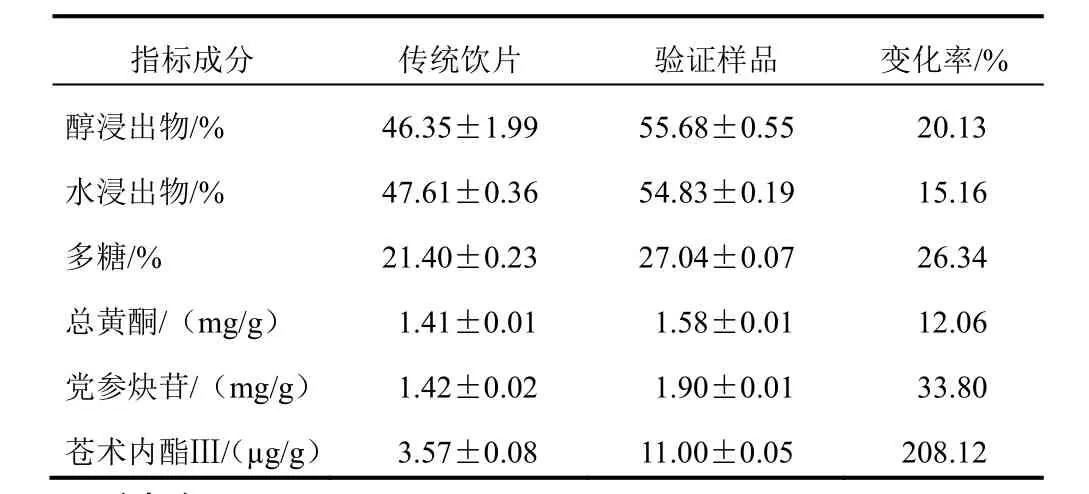
表3 验证试验结果
3 讨论
本试验首先考察了80 ℃烘至含水量为药材原始含水量的不同百分比时切片对纹党参饮片中指标成分含量的影响(新工艺Ⅰ),由表2可以看出,XⅠYP2、XⅠYP3、XⅠYP4和XⅠYP7的醇浸出物含量与TDYP相比均有不同程度的提高。由图1可见,含水量为药材原始含水量的50%时切片,制得的饮片XⅠYP3 的醇浸出物和水浸出物含量均最高,分别为55.36%和54.91%,与TDYP相比分别提高15.33%和19.44%。新工艺Ⅰ的加工条件下,各饮片多糖含量随含水量的变化呈先降后增的变化趋势,但总体较传统工艺制备的饮片均有提高,最高变化率达47.85%。饮片中总黄酮的含量与加工时饮片的含水量无关。党参炔苷和苍术内酯Ⅲ的含量都会因处理方式的差异而变化,当80 ℃烘至含水量达药材原始含水量的50%时制得的饮片(XⅠYP3)党参炔苷和苍术内酯Ⅲ的含量均最高,分别为1.90 mg/g和10.95 µg/g,与TDYP相比,分别提高了33.80%和206.72%。综上,优选的工艺为:新鲜纹党参药材80 ℃烘至含水量为药材原始含水量的50%时切厚片,50 ℃干燥。
其次,本试验新工艺Ⅱ考察了不同温度(50~120 ℃)烘至含水量为药材原始含水量的50%时切片对纹党参饮片中指标成分含量的影响。由表2可见,XⅡYP1、XⅡYP2、XⅡYP4、XⅡYP5、XⅡYP6的醇浸出物高于TDYP。XⅡYP2、XⅡYP4、XⅡYP5的水浸出物含量高于TDYP。由图2可见,当80 ℃烘至含水量为为药材原始含水量的50%时切片,制得的饮片XⅡYP4的醇浸出物含量(55.36%)和水浸出物含量(54.91%)均最高。该加工条件下,各饮片样品中多糖含量随温度的增加呈先增后降的变化趋势,但总体较传统工艺制备的饮片均有所提高,最高变化率可达52.80%。XⅡYP2、XⅡYP7、XⅡYP8的总黄酮含量稍低于TDYP,其他样品均有不同程度提高(2.13%~16.31%)。饮片中党参炔苷的含量随温度的升高先升后降,90 ℃时最高,之后又逐渐降低。苍术内酯Ⅲ的含量因处理方式的差异而变化。综合分析可见,新工艺Ⅱ中XⅡYP4的加工方式与新工艺Ⅰ中XⅠYP3的加工方式完全相同,而且各指标成分均较TDYP有所改善。
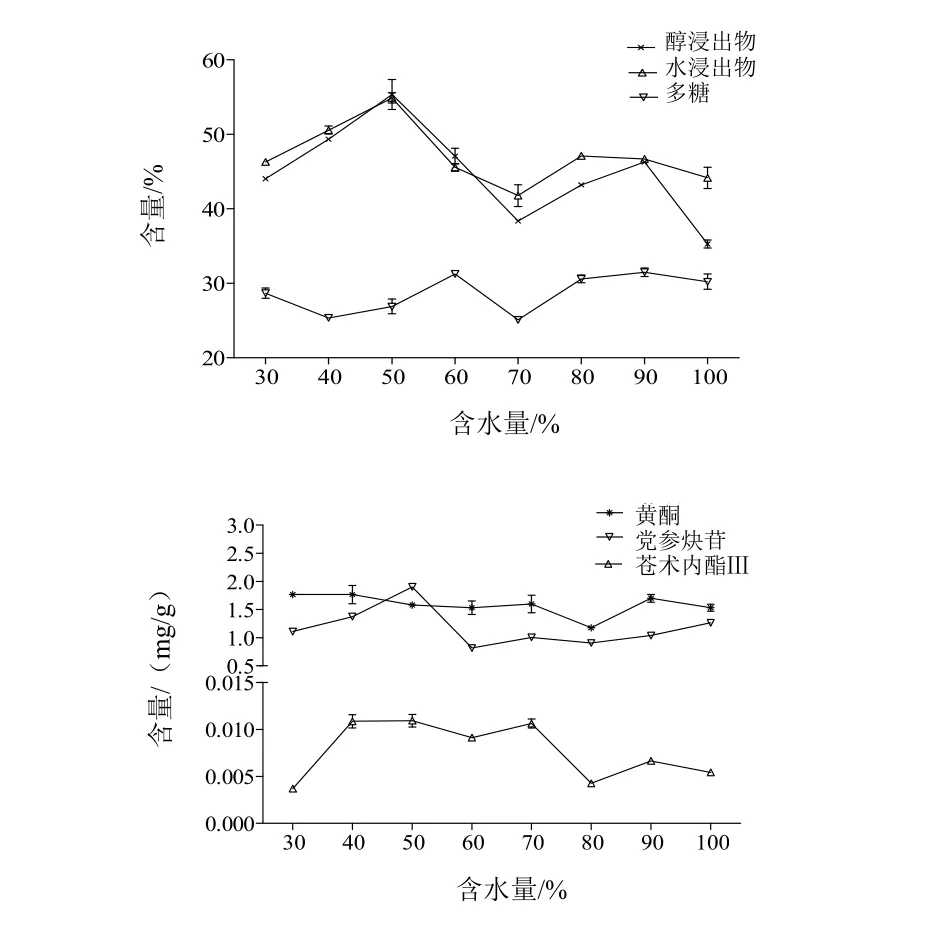
图1 新工艺Ⅰ中含水量变化对纹党参饮片中指标成分的影响
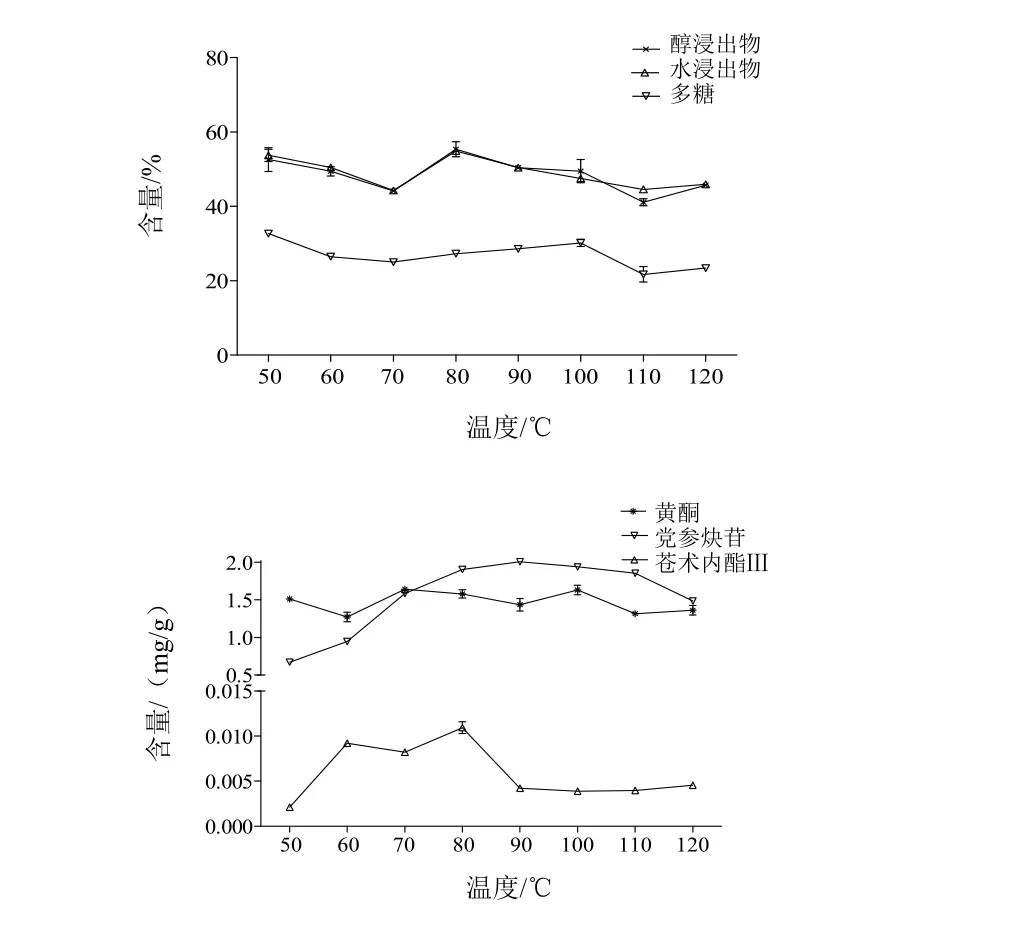
图2 新工艺Ⅱ中温度变化对纹党参饮片中指标成分的影响
4 结论
药材加工过程受多种因素的影响,往往会因错误的处理过程而造成活性成分或一些指标成分含量的损失,从而使药材的品质发生改变。因此,应该将鲜药材进行科学的前处理加工干燥,最大化地保留药材中的有效成分,而非随意采用晒干、阴干等粗放方式干燥鲜药材。
“新鲜纹党参药材80 ℃烘至含水量50%时切厚片,干燥”的产地加工一体化技术,一方面使纹党参饮片的制备时间大大缩短,且50%含水量切片时不渗汁、无掉渣,断面平整,切片较为容易,干燥后的饮片外形美观;另一方面,与传统饮片加工方法相比,因避免了药材干燥后二次闷润的过程,极大程度地保留了纹党参中的活性成分。验证试验进一步说明所建立的一体化加工工艺稳定可行。
[1] 邵宜,朱发伟.中药饮片的质量现状与控制[J].海峡药学,2013, 25(11):214-215.
[2] 饶伟文,周文杰.中药产地加工规范化研究进展[J].中国中医药信息杂志,2012,19(2):106-109.
[3] 王海鹏,韩多,井彩巧,等.对甘肃省党参、当归、黄芪等特产名贵药材的综述[J].中国农业信息,2013(7):68-69.
[4] 黄冬兰,陈小康,徐永群,等.纹党参与白条党参红外光谱的SIMCA聚类鉴别方法研究[J].分析测试学报,2009,28(12):1440-1443.
[5] 李宝凤.文县纹党的初加工技术规程[J].农业科技与信息,2006(1):30.
[6] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:281.
[7] 全世佑.浅析党参的加工储藏技术[J].甘肃农业,2013(12):25-26.
[8] 贺玉林,李先恩,潘广州,等.党参质量变异研究[J].时珍国医国药, 2006,17(9):1727-1728.
[9] 于晓东.党参加工技术研究[J].人参研究,2010,22(2):48.
[10] 宋晓燕.党参的研究进展[J].内蒙古中医药,2011,30(8):112-113.
[11] 李晓峰.党参的化学成分及药理作用研究概况[J].中国乡村医药, 2014,21(21):83-84.
[12] 陈克克,王喆之.党参多糖的研究进展[J].现代生物医学进展,2007, 7(4):635-637.
[13] 谢大泽,湛学军,章涛,等.枸杞等5种多糖清除氧自由基的实验研究[J].江西医学检验,2002,20(4):195-196.
[14] 陈嘉屿,胡林海,吴红梅,等.党参多糖类对荷瘤小鼠免疫应答及抑瘤作用研究[J].中华肿瘤防治杂志,2015,22(17):1357-1362.
[15] 王敏,王彦春,洪小平,等.党参及其复方对亚急性衰老模型小鼠IL-2影响的研究[J].湖北中医杂志,2004,26(7):6-7.
[16] LIU C, CHEN J, LI E T, et al. The comparison of antioxidative and hepatoprotective activities of Codonopsis pilosula polysaccharide (CP) and sulfated CP[J]. Int Immunopharmacol, 2015,24(2):299-305.
[17] YANG C X, GOU Y Q, CHEN J Y, et al. Structural characterization and antitumor activity of a pectic polysaccharide from Codonopsis pilosula[J]. Carbohydrate Polymers,2013,98(1):886-895.
[18] 褚海滨,王玉芳.党参多糖对小鼠抗运动性疲劳作用的研究[J].中国现代医生,2011,49(30):1-2.
[19] 张振东,吴兰芳,景永帅,等.党参多糖对小鼠学习记忆作用研究[J].山地农业生物学报,2010,29(3):242-245.
[20] 王绍坤,刘荣建.党参和维生素E对大鼠下丘脑室周核生长抑素神经元增龄变化的影响[J].解剖学杂志,1996,19(6):489-493.
[21] 李艳,孙萍,刘霞,等.新疆党参多糖的提取、含量分析及免疫功能的初步研究[J].中成药,2005,27(7):839-840.
[22] 万利秀,肖更生,徐玉娟,等.甲醇提取柑橘皮总黄酮的工艺优化[J].安徽农业科学,2010,38(27):15087-15089.
[23] 冯月,吴文夫,魏建华,等.正交设计优化党参炔苷提取工艺的研究[J].人参研究,2013,25(2):46-48.
[24] 赵晓华,刘养清,王润生,等.党参不同部位中党参炔苷的RP-HPLC分析[J].中成药,2007,29(7):1046-1047.
[25] 武果桃,贺东昌,张李俊,等.中药党参的HPLC指纹图谱研究[J].中兽医医药杂志,2009,28(5):54-56.
Study on Producing and Preparing Integration Process based on Fresh Codonopsis pilosula Nannf.var.modesta (Nannf.) L.T.Shen
QIANG Si-si1,2, GAO Xia1, MA Yu-ling1, ZHENG Xiao-ping1,
HU Fang-di1,3, LI Ying-dong3(1. School of Pharmacy, Lanzhou University, Lanzhou 730000, China; 2. Third Affiliated Hospital of Beijing University of Chinese Medicine, Beijing 100029, China; 3. Gansu University of Chinese Medicine, Lanzhou 730000, China)
Objective To study the effects of different drying processes on the effective constituents in Wen Codonopsis pilosula (WPP) Decoction Pieces; To develop the optimized producing and preparing integration process based on fresh WPP. Methods Fresh WPP in harvest period was prepared respectively as follows: ① Fresh WPP was dried to different percentage (30%–100%) of original moisture contents of crude drugs at 80 ℃ in oven, then sliced and dried at 50 ℃ to obtain eight decoction pieces of WPP (XⅠYP1–8). ② The fresh WPP was baked to 50% of water content of crude drug under different temperatures (50–120 ℃), respectively, then sliced and dried at 50 ℃to obtain eight decoction pieces of WPP (XⅡYP1–8). ③ Dried WPP was moistened, sliced and naturally dried, then were renamed as traditional decoction pieces. The contents of lobetyolin and atractylenolide Ⅲ was determined by HPLC. The phenol-sulfuric acid and colorimetric method were applied respectively to detect contents of polysaccharide and total flavonoids. The contents of aqueous and alcoholic extracts were determined simultaneously. Results The contents of alcoholic extracts (55.36%), aqueous extracts (54.91%) and atractylenolide Ⅲ (10.95 µg/g) in XⅠYP3 pieces were higher than other decoction pieces. Conclusion The optimized process was that fresh WPP was baked to water content of 50% at 80 ℃, then sliced and dried. Compared with conventional preparing methods,the integration process was time-saving and effort-saving. Meanwhile, the prepared pieces have higher content of active ingredients.
fresh Wen Codonopsis pilosula; processing in producing areas; preparing; integration
10.3969/j.issn.1005-5304.2017.01.018
R282.4
A
1005-5304(2017)01-0071-06
2016-01-30)
(
2016-04-28;编辑:陈静)
甘肃省科技支撑计划-社会发展类(1504FKCA010);甘肃中医药管理局科研课题(GZK-2014-13,GZK-2015-19);兰州市科技计划项目(2013-4-75、2014-2-30)
胡芳弟,E-mail:hufd@lzu.edu.cn

