相关炎性因子在脾肾阳虚型溃疡性结肠炎模型大鼠血清和结肠组织的动态表达
何兰娟,朱向东,王燕,郭婷婷,王迪
甘肃中医药大学,甘肃 兰州 730000
相关炎性因子在脾肾阳虚型溃疡性结肠炎模型大鼠血清和结肠组织的动态表达
何兰娟,朱向东,王燕,郭婷婷,王迪
甘肃中医药大学,甘肃 兰州 730000
目的 观察脾肾阳虚型溃疡性结肠炎模型大鼠血清及结肠组织白细胞介素(IL)-1β、IL-4、干扰素-γ(IFN-γ)及转化生长因子-β1(TGF-β1)表达水平的变化,探讨其在脾肾阳虚型溃疡性结肠炎发生发展过程中的作用。方法 采用复合方法建立脾肾阳虚型溃疡性结肠炎大鼠模型。75只Wistar大鼠随机分为空白组、模型3 d组、模型7 d组、模型14 d组和模型21 d组,ELISA检测各组大鼠血清和结肠组织IL-1β、IL-4、IFN-γ及TGF-β1的含量。结果 与空白组比较,各模型组大鼠IL-1β、IFN-γ含量明显升高,IL-4、TGF-β1含量明显降低(P<0.05,P<0.01),其中模型7 d组最为明显(P<0.01)。结论 促炎因子IL-1β、IFN-γ和抑炎因子IL-4、TGF-β1在脾肾阳虚型溃疡性结肠炎的发病过程中发挥了重要作用。
溃疡性结肠炎;脾肾阳虚;白细胞介素-1β;白细胞介素-4;干扰素-γ;转化生长因子-β1;大鼠
溃疡性结肠炎(ulcerative colitis,UC)是一种反复发作的炎性肠病,其发病机制尚不明确。有学者认为细胞因子失衡是发生UC的关键环节,且目前抑炎和促炎因子的失衡机制越来越受到重视[1]。余莹等[2]研究发现,UC患者大多伴有食欲减退、腰酸背痛、畏寒肢冷等脾肾阳虚的症状。曹燕飞等[3]通过文献检索对UC中医证候分布进行分析,发现脾肾阳虚型位居第2,提示脾肾阳虚为UC常见证型。本实验采用ELISA检测促炎因子白细胞介素(IL)-1β、干扰素-γ(IFN-γ)和抑炎因子IL-4、转化生长因子-β1(TGF-β1)在脾肾阳虚型UC大鼠血清和结肠组织的动态变化,探讨其在脾肾阳虚型UC发病中的作用。
1 实验材料
1.1 动物
SPF级Wistar大鼠75只,体质量(180±20)g,雌雄各半,甘肃中医药大学实验中心,动物合格证号SYXK(甘)2001-0001。饲养于SPF级实验室。
1.2 药物及制备
番泻叶,购自兰州惠仁堂药店,100 ℃蒸馏水浸泡30 min,过滤,乙醇浓缩为1 g/mL(即100%浓度),置于4 ℃冰箱保存备用;氢化可的松注射液,天津药业焦作有限公司,批号11080411。
1.3 主要试剂与仪器
2,4,6-TNBS(批号2508-19-2),Sigma公司;大鼠IL-1β(批号12-3012-096)、IFN-γ(批号12-3000-096)、IL-4(批号12-3040-096)、TGF-β1(批号12-3710-096)ELISA检测试剂盒,深圳达科为公司。iMark酶标仪(美国BIO-RAD公司),台式高速冷冻离心机(海天美生化仪器设备工程有限公司)。
2 实验方法
2.1 分组与造模
实验大鼠适应性饲养7 d后,待其体质量达到(180±20)g,按随机数字表法分为空白组、模型3 d组、模型7 d组、模型14 d组、模型21 d组,每组15只。大鼠脾肾阳虚型UC模型采用“病-证”结合方法造模[4-5]。除空白组外,其余4组每日予10 mL/kg 100%浓度番泻叶灌胃、15 mg/kg氢化可的松注射液腹腔注射,空白组予10 mL/kg蒸馏水灌胃、等体积生理盐水腹腔注射,连续21 d。21 d后,禁食24 h,乙醚麻醉,取12 cm聚丙烯管,插入肛门8 cm达结肠部位,快速注入TNBS/乙醇溶液(100 mg/kg),再注入约0.4 mL空气,捏紧肛门,提取大鼠尾巴保持倒立1 min,防注入液倒流,并使药液与结肠充分接触,待麻醉清醒后正常喂养。
2.2 标本采集及处理
分别于造模3、7、14、21 d处死相应模型组大鼠并取材。将大鼠乙醚麻醉固定,股动脉取血,室温静置20 min,3000 r/min离心15 min,取上层血清,用于检测血清细胞因子IL-1β、IFN-γ、IL-4、TGF-β1含量。之后将大鼠脱颈处死,剖取病变最严重处结肠,生理盐水清洗,加9倍量生理盐水匀浆,12 000 r/min离心10 min,取上清液待测。
2.3 结肠损伤评分
参照文献[6]肉眼评分。0分:无溃疡、充血;1分:局部充血,无溃疡;2分:1处溃疡不伴充血或肠壁增厚;3分:1处溃疡伴炎症;4分:>2处溃疡伴炎症;5分:>2处溃疡和/或炎症>1 cm;6~8分:溃疡和/或炎症>2 cm,病变范围每增加1 cm则计分增加1分。
2.4 指标检测
ELISA检测大鼠血清和结肠组织IL-1β、IFN-γ、IL-4、TGFβ-1含量,严格按照试剂盒说明书进行操作。
3 统计学方法
4 结果
4.1 一般状况
造模后第1日出现懒动、扎推,饮食减少及稀便;3 d后反应迟钝,体质量开始下降,大便量多质稀,部分有黏液便和脓血便出现;7 d后饮食明显低于正常,体质量明显下降,皮毛污秽无光泽,肛周污秽,捕捉时抵抗力减弱,有黏液便或脓血便出现;14 d后活动开始恢复正常,但仍有稀便;21 d后大鼠毛色稍晦黯,反应较灵活,精神活动尚可,饮食逐渐恢复,时有稀便。
4.2 各组大鼠结肠损伤肉眼观察结果
空白组肠道无增厚粘连,肠黏膜光滑,肠皱襞纹理清晰,未见充血、水肿、糜烂、溃疡等情况;模型3 d组肠壁明显充血、水肿、增厚,有溃疡面形成;模型7 d组肠道粘连严重,肠黏膜坏死、呈黑褐色,部分可见肠胀气;模型14 d组溃疡面开始愈合,但部分仍有粘连;模型21 d组溃疡面明显缩小,部分可见愈合瘢痕;与空白组比较,各模型组结肠均有明显损伤(P<0.01);与模型7 d组比较,模型21 d组结肠损伤明显恢复(P<0.01)。评分结果见表1。
表1 各组大鼠结肠损伤肉眼评分比较(±s,分)

表1 各组大鼠结肠损伤肉眼评分比较(±s,分)
注:与空白组比较,**P<0.01;与模型7 d组比较,##P<0.01
组别 只数 结肠损伤评分空白组 15 0.33±0.49模型3 d组 15 4.07±1.75**模型7 d组 15 5.47±1.19**模型14 d组 15 2.67±1.29**模型21 d组 15 2.27±1.03**##
4.3 各组大鼠结肠组织和血清白细胞介素-1β的动态表达
与空白组比较,各模型组大鼠结肠组织和血清IL-1β明显升高(P<0.05,P<0.01);与模型7 d组比较,模型21 d组IL-1β明显降低(P<0.05)。结果见表2。
4.4 各组大鼠结肠组织和血清干扰素-γ的动态表达
与空白组比较,各模型组大鼠结肠组织和血清IFN-γ明显升高(P<0.05,P<0.01),其中模型7 d组最为明显(P<0.05,P<0.01);与模型7 d组比较,模型21 d组IFN-γ明显降低(P<0.01)。结果见表3。
表2 各组大鼠结肠组织和血清IL-1β含量比较(±s,pg/mL)

表2 各组大鼠结肠组织和血清IL-1β含量比较(±s,pg/mL)
注:与空白组比较,*P<0.05,**P<0.01;与模型7 d组比较,#P<0.05
组别 只数 结肠组织 血清空白组 8 11.75±5.68 8.13±4.32模型3 d组 8 19.88±5.48*15.13±3.43**模型7 d组 8 26.47±6.20**19.69±4.46**模型14 d组 8 18.72±8.92*16.04±4.82**模型21 d组 8 19.11±5.09*#12.99±5.96*#
表3 各组大鼠结肠组织和血清IFN-γ含量比较(±s,pg/mL)
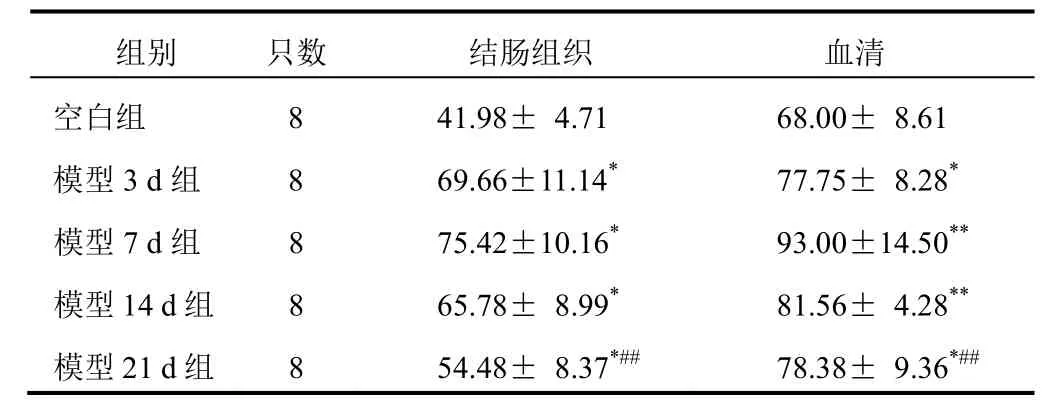
表3 各组大鼠结肠组织和血清IFN-γ含量比较(±s,pg/mL)
注:与空白组比较,*P<0.05,**P<0.01;与模型7 d组比较,##P<0.01
组别 只数 结肠组织 血清空白组 8 41.98± 4.71 68.00± 8.61模型3 d组 8 69.66±11.14*77.75± 8.28*模型7 d组 8 75.42±10.16*93.00±14.50**模型14 d组 8 65.78± 8.99*81.56± 4.28**模型21 d组 8 54.48± 8.37*##78.38± 9.36*##
4.5 各组大鼠结肠组织和血清白细胞介素-4的动态表达
与空白组比较,各模型组大鼠结肠组织和血清IL-4明显降低(P<0.05,P<0.01);与模型7 d组比较,模型21 d组IL-4明显升高(P<0.05,P<0.01)。结果见表4。
表4 各组大鼠结肠组织和血清IL-4含量比较(±s,pg/mL)
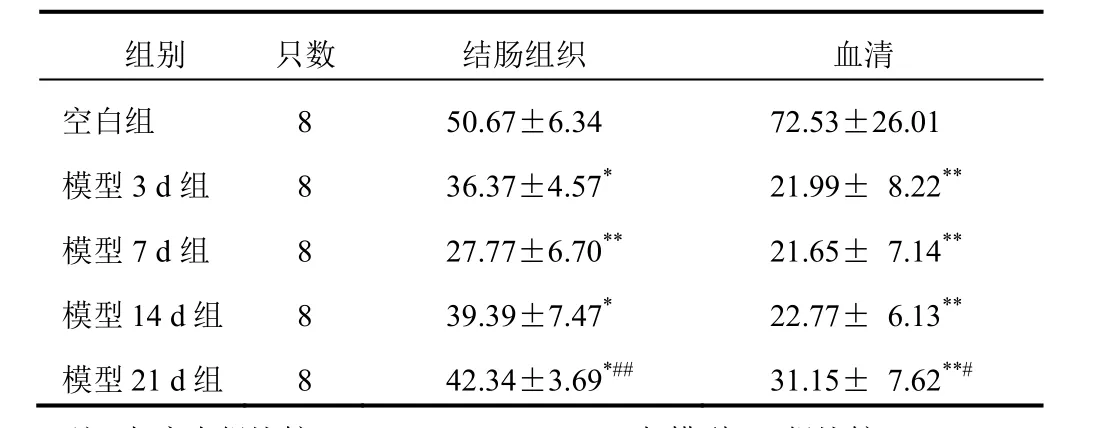
表4 各组大鼠结肠组织和血清IL-4含量比较(±s,pg/mL)
注:与空白组比较,*P<0.05,**P<0.01;与模型7 d组比较,#P<0.05,##P<0.01
组别 只数 结肠组织 血清空白组 8 50.67±6.34 72.53±26.01模型3 d组 8 36.37±4.57*21.99± 8.22**模型7 d组 8 27.77±6.70**21.65± 7.14**模型14 d组 8 39.39±7.47*22.77± 6.13**模型21 d组 8 42.34±3.69*##31.15± 7.62**#
4.6 各组大鼠结肠组织和血清转化生长因子-β1的动态表达
与空白组比较,各模型组大鼠结肠组织和血清TGF-β1明显降低(P<0.01);与模型7 d组比较,模型21 d组明显升高(P<0.05,P<0.01)。结果见表5。
表5 各组大鼠结肠组织和血清TGF-β1含量比较(s,pg/mL)

表5 各组大鼠结肠组织和血清TGF-β1含量比较(s,pg/mL)
注:与空白组比较,**P<0.01;与模型7 d组比较,#P<0.05,##P<0.01
组别 只数 结肠组织 血清空白组 8 72.50± 8.32 384.59±33.09模型3 d组 8 56.38±10.31**290.61±15.45**模型7 d组 8 34.75± 9.75**238.26±26.42**模型14 d组 8 52.75± 8.22**257.05±31.36**模型21 d组 8 52.38± 9.41**##320.15±49.18**#
5 讨论
目前学者多认为UC发生的主要机制是肠道黏膜免疫系统功能紊乱[7],而促炎因子和抑炎因子平衡则是肠道黏膜免疫系统平衡的前提。细胞因子作为细胞间信号传导分子,与靶细胞膜上的特异性受体结合,从而在机体免疫应答和炎症反应过程中发挥重要作用[8]。Asadullah K等[9]研究表明,IL-1β、IFN-γ、IL-4、TGF-β1等因子在UC的炎症反应中起着重要作用。
IL-1β又名前炎症反应细胞因子,它能活化CD4+T细胞,促进B细胞生长、活化以及IL-2R表达,引起炎症介质的释放[10]。它还能通过自分泌或旁分泌促进其下游细胞因子的表达和产生,并与其协同作用,使免疫上调和促进炎症活性,从而引起一系列的肠道炎症和肠黏膜损伤。IL-1β还通过促进白细胞黏附分子的表达,趋化中性粒细胞等炎性细胞进入肠道病变部位,引发一系列肠组织破坏和肠道炎症反应[11]。殷明霞等[12]研究发现,IL-1β在脾肾阳虚型UC大鼠血清中的水平随着炎症的发展而逐渐升高,姬培震等[13]研究也证实了这一观点。
IL-4是由Th2细胞分泌的抑炎因子,有研究表明,其在UC中明显减少[14]。它能刺激B淋巴细胞和T淋巴细胞的增殖,抑制巨噬细胞和T淋巴细胞的产生和移动,从而抑制IL-1的促炎作用[15]。正常状态下,人体肠黏膜分泌的IL-4与IL-1β维持动态平衡。当受到病原刺激后,这种平衡被打破,则发生肠道炎症。因此,IL-4和IL-1β在抑制肠道炎症和维持肠道免疫平衡中起关键作用。余莹等[2]和邹君君等[16]临床研究发现,IL-4含量在脾肾阳虚型UC患者呈下降趋势。
IFN-γ是一种二聚体糖蛋白,由Th1淋巴细胞和自然杀伤细胞产生,可使Th1细胞扩增、活性增强,抑制Th2细胞增生,是IL-4的拮抗因子[14]。它具有很强的免疫调节活性,是强有力的吞噬细胞和中性粒细胞激活物,能加重肠黏膜上皮细胞的凋亡和肠道炎症等,在UC发病过程中产生了重要的作用[17]。殷明霞等[12]通过脾肾阳虚型UC大鼠模型分析发现,IFN-γ在模型组中明显升高;邹君君等[16]在临床研究中也发现IFN-γ在脾肾阳虚型UC患者血清中含量升高。
TGF-β1通过下调过度的免疫反应而抑制炎症的发生与发展,且能促进上皮的修复及血管再生。其还能通过抑制巨噬细胞黏附和迁移,抑制T细胞、B细胞凋亡[18]。作为公认的抑炎因子,其水平的下降还有利于淋巴细胞的激活,从而促进自身抗体和自身致敏T细胞的产生,发生自身免疫反应[19]。这些因素均能减轻肠黏膜的炎症反应和损伤,从而促进UC的恢复。王燕等[20]研究发现,在脾肾阳虚型UC大鼠模型TGF-β1含量明显低于正常组。
本研究结果显示,与空白组比较,各模型组IL-1β、IFN-γ明显升高,IL-4、TGF-β1明显降低,其表达规律与结肠的损伤程度一致,表明UC的产生可能是因为抑炎因子和促炎因子平衡的破坏;且在模型7 d组炎症反应最明显,表明此时炎症细胞因子失衡最明显;而与模型7 d组比较,模型21 d组有所恢复,说明炎症处于恢复阶段,细胞因子逐渐趋于平衡,这与张歆等[21]的研究结论相一致,此时虽然机体自身处于自我修复状态,但防御能力很低,容易复发,所以在此时用药可以降低复发的风险。因此,我们认为抑炎和促炎因子的失衡是UC发病的重要因素,调节免疫平衡是治疗脾肾阳虚型UC的重要思路之一。
[1] STROBER W, FUSS I, MANNON P. The fundamental basis of inflammatory bowel disease[J]. J Clin Invest,2007,117(3):514-521.
[2] 余莹,朱莹.溃结宁膏穴位贴敷治疗脾肾阳虚型溃疡性结肠炎临床疗效及其对血清白细胞介素-4的影响[J].中国中医药信息杂志,2011, 18(10):11-13.
[3] 曹燕飞,朱向东.基于文献学方法对溃疡性结肠炎的中医证候要素分布规律及治法研究[J].中医研究,2013,26(10):73-76.
[4] 邹忠杰,龚梦鹃,谢媛媛,等.氢化可的松诱导的肾阳虚大鼠尿液代谢组学研究[J].中国实验方剂学杂志,2012,18(8):133-136.
[5] 吕爱平,李德新,崔家鹏,等.脾肾阳虚模型大鼠肝细胞线粒体磷脂组分变化的比较研究[J].中医药学刊,2003,21(1):78.
[6] 朱向东,王燕,何兰娟,等.四神丸对溃疡性结肠炎模型大鼠结肠组织Toll样受体2、4表达的影响[J].中国中医药信息杂志,2016,23(10):67-71.
[7] YU Y, SITARAMAN S, GEWIRTZ A T. Intestinal epithelial cellregulation of mucosal inflammation[J]. Immunol Res,2004,29:55-68.
[8] 汪斌,朱向东,段永强,等.芍药苷对溃疡性结肠炎大鼠结肠组织病理形态及血清抗炎和促炎因子平衡的影响[J].中国中西医结合消化杂志, 2013,21(1):1-4.
[9] ASADULLAH K, STERRY W, VOLK H D. Interleukin-10 therapy-review of a new approach[J]. Pharmacol Rev,2003,55(2):241-269.
[10] REGUEIRO M, CURTIS J, PLEVY S. Infliximab for hospitalized patients with severe ulcerative colitis[J]. J Clin Gastroenterol, 2006,40(6):476-481.
[11] HUE S, AHERN P, BUONOCOR S, et al. Interleukin-23 drives in nate and T cell mediated intestinal inflammation[J]. J Exp Med, 2006,203:2473-2483.
[12] 殷明霞,许雅清,李海龙,等.IL-1、IL-6、TNF-α及IFN-γ在脾肾阳虚型溃疡性结肠炎模型大鼠血清及组织中的表达[J].中国实验动物学报,2015,23(2):139-142.
[13] 姬培震,张怡,李雪萍.附子理中汤灌肠对脾肾阳虚型溃疡性结肠炎大鼠NF-κB,TNF-α,IL-1β表达的影响[J].中国实验方剂学杂志,2015, 21(14):124-128.
[14] 王雪茜,王新月.溃结饮2种给药途径对大鼠溃疡性结肠炎血清IFN-γ和IL-4的影响[J].北京中医药大学学报,2010,33(7):468-470.
[15] 赵建学,郭海燕,陆玮婷,等.芍药苷对肝纤维化模型大鼠血清TNF-α、IL-6与IL-10的影响[J].医药导报,2010,29(2):168-170.
[16] 邹君君,朱莹,张晓江,等.溃结宁膏穴位敷贴对脾肾阳虚型溃疡性结肠炎的临床疗效及其对血清γ干扰素、白细胞介素-4的影响[J].中国中西医结合消化杂志,2013,21(6):305-307.
[17] 张志军,刘懿,王磊,等.TLR4mAb对急性期溃疡性结肠炎小鼠结肠黏膜中促炎因子TNF-α、IFN-γ、IL-1β的影响[J].复旦学报(医学版), 2008,35(2):176-180.
[18] 王觅柱,党彤,孟宪梅.溃疡性结肠炎组织IL-8、TNF-α和TGF-β1的表达及其意义[J].内蒙古医学杂志,2012,44(6):641-644.
[19] 王磊,刘懿,张志军,等.TLR4mAb对急性期溃疡性结肠炎小鼠结肠黏膜中细胞因子IL-17、IL-10及TGF-β的影响[J].复旦学报:医学版, 2008,35(6):892-896.
[20] 王燕,何兰娟,朱向东,等.四神丸对脾肾阳虚型溃疡性结肠炎大鼠血清TGFβ1、IL-6及结肠组织TLR-4mRNA表达的影响[J].中医药学报, 2015,43(5):118-122.
[21] 张歆,柯晓,陈锦团,等.IL-1β、IL-4在湿热证溃疡性结肠炎大鼠模型中的动态表达及意义[J].西安交通大学学报:医学版,2015,36(5):697-701.
Dynamic Expression of IL-1β, IL-4, IFN-γ and TGFβ1 in Serum and Colon Tissue in Ratswith Ulcerative Colitis of Spleen-Kidney Yang Deficiency Type
HE Lan-juan, ZHU Xiang-dong,
WANG Yan, GUO Ting-ting, WANG Di (Gansu University of Chinese Medicine, Lanzhou 730000, China)
Objective To observe the change rules of expressions of IL-1β, IL-4, IFN-γ and TGF-β1 in serum and colon tissue in rats with ulcerative colitis of spleen-kidney yang deficiency type; To explore the action in the progress of ulcerative colitis of spleen-kidney yang deficiency type. Methods Composite method was used to establish rat models with ulcerative colitis of spleen-kidney yang deficiency type. 75 Wistar rats were randomly divided into blank group, model 3 d group, model 7 d group and model 21 d group. ELISA was used to test the levels of IL-1β, IL-4, IFN-γ and TGF-β1 in serum and colon tissue. Results Compared with the blank group, contents of IL-1β and IFN-γ in model group increased significantly (P<0.05, P<0.01), and the contents of IL-4 and TGF-β1 content decreased (P<0.05, P<0.01),especially in the model 7 d group (P<0.01). Conclusion The pro-inflammatory factor IL-1β, IFN-γ and anti-inflammatory factor IL-4 and TGF-β1 play an important role in rats with ulcerative colitis of spleen-kidney yang deficiency type.
ulcerative colitis; spleen-kidney yang deficiency; IL-1β; IL-4; IFN-γ; TGF-β1; rats
10.3969/j.issn.1005-5304.2017.01.015
R228
A
1005-5304(2017)01-0059-04
2015-11-23)
(
2015-12-29;编辑:华强)
国家自然科学基金(81360541)
朱向东,E-mail:zhuxiangdong33@163.com

